摘要
碳水化合物是人體不可或缺的成分之一,它是人類生命能量的來源。50%以上的複合型碳水化合物位於細胞膜表面的蛋白質上,它是細胞與細胞之間辨識與連結的調控者。本文以複合型碳水化合物做為藥物應用探討的主軸,主要介紹聚醣(glycan)、唾液酸(sialic acids)和醣複合物(glycoconjugate)等複合型碳水化合物的生物學特性和作用機轉,以及α-半乳醣苷腦醯胺(α-galactosyl ceramide)、毛蕊花醣苷(verbascoside)及半乳醣基絲胺酸類脂質(galactosyl serine-type lipid)等成分之藥物應用與其所扮演的角色與功能。隨著醣苷合成(glycoside synthesis)、分離、分析與應用等技術快速蓬勃發展,醣生物學(glycobiology)成為極為重要的研究領域,研究證實多醣、聚醣、唾液酸和醣複合物具有增強或調節免疫力、抗癌、抗病毒、抗氧化和抗衰老之生物活性。創新研發的複合型碳水化合物不僅能降低藥物成本,提高療效以符合人體所需,而且對於疫苗開發及治療感染、發炎、癌症和遺傳疾病能達到預期成效,所以將天然與合成的複合型碳水化合物應用於藥物研發,勢必能擁有相當大的發展潛力和廣闊的應用價值。
關鍵字:
複合型碳水化合物、醣複合物、醣苷合成、醣生物學
壹、前言
碳水化合物具有不同型態,分為簡單型和複合型兩類,單醣和雙醣屬於簡單型碳水化合物,複合型碳水化合物是由碳水化合物與蛋白質或脂質透過化學鍵結合而成的複合物和多醣類。在正常的消化過程中,碳水化合物會分解為單醣,然而當碳水化合物進入人體後,會轉換成肝糖和葡萄糖形式存在人體內,主要功能是供給人體活動時所需要的能量。複合型碳水化合物是人體不可或缺的成分之一,在人體的生理作用中扮演極為重要的角色,人體一旦缺乏複合型碳水化合物,即使有蛋白質存在,細胞與細胞之間仍然無法傳遞重要的訊息。
1988年Rademacher等人率先開創複合型碳水化合物之化學和生物化學學科,同一時期醣生物學(glycobiology)也獲得生物醫學雜誌及Gordon Research Conference的廣泛認同。醣生物學是研究與複合型碳水化合物有關的生物學,醣生物學研究需要命名法、生合成、架構、化學合成法和聚醣(glycan)功能等研究背景基礎,以及分子遺傳學、細胞生物學、生理學和蛋白質化學等學科知識1。複合型碳水化合物的抗原決定因素(antigenic determinant)和生物活性位置以及結合性質等研究議題已促使複合型碳水化合物在生物醫學領域佔有一席之地,如今複合型碳水化合物儼然成為當前藥物研發的熱門主題,有鑑於此本文將以複合型碳水化合物做為藥物應用探討的主軸。
貳、複合型碳水化合物之簡介
複合型碳水化合物之化學、生物學和生物化學應用是近年來研究學者關注的重要主題之一,但是目前分子生物學的聚醣研究仍遠遠落後其他種類的分子生物研究,為了解析聚醣的架構和結構順序預測聚醣的生合成,已有多種新型技術逐漸開啟分子生物學的新契機。
一、聚醣的生物學特性及作用機轉
聚醣本身具有完全不同的生物機能,主要原因包括:(1)聚醣本身的結構(圖一)與他們被附上的分子調節功能有關;(2)選擇素(selectin)是一種碳水化合物結合蛋白,其具備專一性辨識聚醣的功能,通常會以內源性或是外源性的方式讓生物體合成聚醣。單價碳水化合物-選擇素結合作用只有較低的親合力,因此創造多價碳水化合物-選擇素結合作用,提昇它們的特異性和親合力自然成為另一個新興主題2,3。
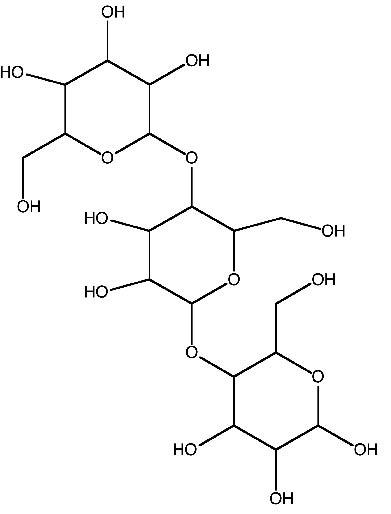
圖一 聚醣結構圖
二、唾液酸(sialic acids)的生物學特性及作用機轉
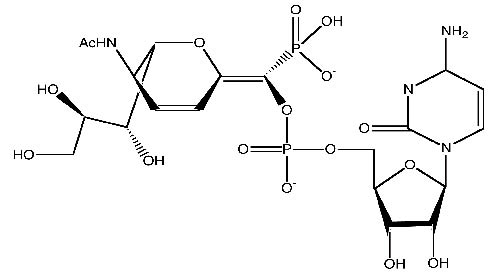
醣複合物(glycoconjugate)的唾液酸(圖二)在化學和生物學意義以及它們的結構、新陳代謝和免疫學活性既重要且深具意義,唾液酸主要是以細胞表面醣蛋白和醣脂末端組成部分形態存在,這些生物活性分子會透過複合型碳水化合物末端聯結成一個或數個唾液酸,殘餘基會因此被高度醣化。另外,許多重要的生物作用也與唾液酸化醣複合物有關,唾液酸在癌細胞中的數量、類型或鍵結方面的變化能影響癌細胞的生長和轉移4,5。選擇素是一種細胞附著分子,它與白血球聚集到淋巴組織及發炎部位有關,而且選擇素必須先與唾液酸配位基結合才能達到分子辨識與細胞附著的功能6。天然的複合型碳水化合物通常是以完全不同的形式與型態存在,就數量和分子種類而言,唾液酸醣化形式合成是一種有效的方法,但是在所有醣苷鍵(glycosidic bond)形成的反應過程中,要以合理的數量形式獲得相同的分子提供研究,唾液酸合成的低反應性、低產率及立體選擇性等問題仍然是研發人員亟需突破的挑戰工作7,8。
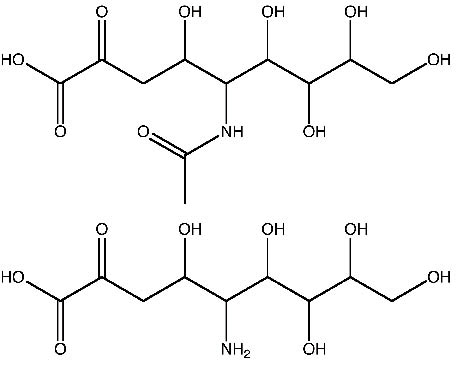
圖二 唾液酸結構圖
三、醣複合物的生物學特性及作用機轉
單醣被細胞吸收並且轉變成單醣基石(building block),稱為核苷糖(nucleoside sugar)。細胞代謝步驟是先從外源性的糖(單醣)轉變成一個基石,之後基石被送進分泌器官(內質網及高爾基體)內,在那裡透過醣基轉移酶(glycosyltransferase)結合到一個蛋白質或脂類架構上的寡醣。就連結氮的(N-linked)醣蛋白來說,一個核心寡醣在細胞質裡聚集,然後運輸到內質網先由醣苷酶(glycosidase)處理,接著透過醣基轉移酶做進一步的處理,當醣複合物在細胞表面以完全成熟的形式呈現時,醣複合物就能做為配位基與其他細胞或者病原體上感受器的結合因子(圖三)9。應用不同的化學物質能抑制或控制這些細胞代謝的路徑(表一)9。
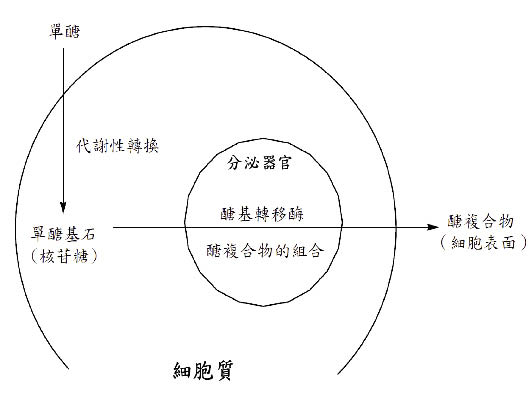
圖三 醣複合物的生合成關係圖9
表一 酵素抑制劑的作用機制9
酵素抑制劑 |
特徵 |
結構 |
作用機制 |
α-2,6-唾液酸轉換酶抑制劑(α-2,6- sialyltransferase inhibitor) |
不同的化學物質能抑制或控制不同的細胞代謝路徑 |
|
直接抑制細胞內的活性表現 |
寡醣轉換酶抑制劑(oligosaccharyl transferase inhibitor) |
|
進入內質網膜阻礙連結氮的醣化反應 |
|
N-乙醯葡萄糖胺-6-轉磺酶抑制劑(GlcNAc-6- sulfotransferase inhibitor) |
|
能通過細胞膜抑制細胞的活性表現 |
參、複合型碳水化合物之藥物應用
一、醣苷合成(glycoside synthesis)的目的與方法
(一)、醣苷合成的目的
醣苷合成能提供不同的反應做為醣脂、醣蛋白和醣胜肽形成寡醣和醣複合物之用,過去20年以來合成複合型碳水化合物在化學領域呈指數發展,主要目的在於合成寡醣以瞭解選擇素的特異性、病毒感受器和細菌感受器的相互作用以及寡醣被運用於抗體生產、抗體篩選及醣苷酶與醣基轉移酶的受質構造分析10。
(二)、建構醣苷鍵的方法
要建構醣苷鍵形成高度控制的位置異構物(regioisomer)和立體異構物(stereoisomer)使其相類似於自然發生的物質實屬不易,直到1901年第一個可以控制醣苷鍵形成的方法才被發現,這個方法叫做Koenigs-Knorr醣化法11。爾後建構糖苷鍵的方法陸續被研發出來,包括酵素O-醣苷鍵形成法和化學O-醣苷鍵形成法,這兩種不同的方法已被廣泛應用於O-醣苷鍵之合成。
(三)、醣苷鍵的位置異構物和立體異構物
酵素O-醣苷鍵形成法是由醣基轉移酶催化糖核苷提供者(sugar nucleotide donor)形成醣苷鍵,它的位置異構物和立體異構物的形成取決於所使用的不同醣基轉移酶(圖四A)。化學O-醣苷鍵形成法是指大多數的醣化包含一個醣苷提供者(glycosyl donor),它在異常的位置有一個離去基團(X),過程中X與一個醣苷接受者(glycosyl acceptor)的反應有關,為了要產生位置異構物,保護基團(P',P)會被用來阻斷其他活化位置的反應,所以透過改變X或P',P的性質可以形成特定的立體異構物(圖四B)9。
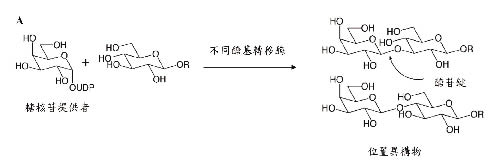
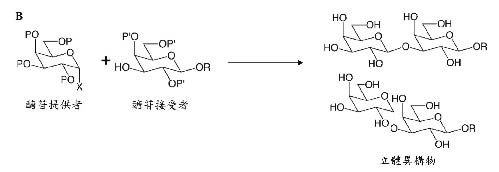
圖四 醣化反應的方法:(A)酵素O-醣苷鍵形成法;(B)化學O-醣苷鍵形成法9
二、醣苷合成在醣胜肽與醣蛋白的應用
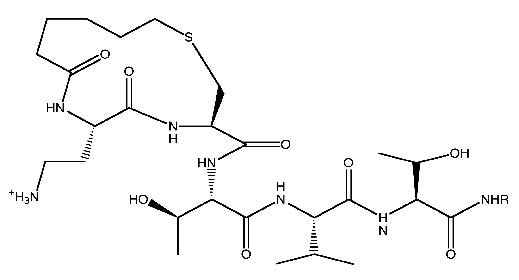
從化學合成的角度來看,寡醣固相合成方法優於傳統方法,它能改善及解決傳統方法需經過多次純化的問題。在Merrifield完成固相胜肽合成(solid-phase peptide synthesis; SPPS)之後12,固相的寡醣合成研究也在70年代之初被開創,使用自動化固相胜肽合成儀能合成類似天然醣蛋白的醣化胜肽片段9,另外採用現代化的Fmoc固相胜肽合成方法也有助於寡醣在整個合成期間保持完整。
Sames等人使用參醣胺基酸當作一個基石化學合成出醣胜肽,在多胜肽骨架上寡醣的架構和他們的排列是與癌相關醣蛋白的特徵息息相關,這樣的合成物質可以做為癌症疫苗組成的成分。近年來蛋白質化學已有突破性發展,天然醣蛋白的全合成也因此較為容易,其中使用SPPS法將每一個沒有保護的醣胜肽碎片聚集縮合,使其產生完整且全功能的醣蛋白自然化學連結法(native chemical ligation)就是一項創新的方法9。
三、天然與合成的複合型碳水化合物之藥物應用
天然的生物活性分子醣複合物被附上聚醣後,會對生合成、穩定度、作用和組織的完整性等方面產生明顯的影響。聚醣的調節功能在生物學的相互作用中容易受活體內的機制影響,在幾種人類的疾病狀態中,以聚醣生合成變化為特點者極具診斷和治療意義。複合型碳水化合物被廣泛應用於心血管疾病、發炎疾病和抗血栓等疾病治療,肝素(heparin)就是一種著名且廣泛被使用的複合型碳水化合物藥物。
(一)、 α-半乳醣苷腦醯胺(α-galactosyl ceramide; α-GalCer)成分
1994年Natori等人從海綿(Agelas Mauritianus)分離出α-半乳醣苷腦醯胺成分(圖五),它是以α-半乳糖連接到脂質上的結構,α-半乳醣苷腦醯胺具有抗癌及刺激免疫的作用13。
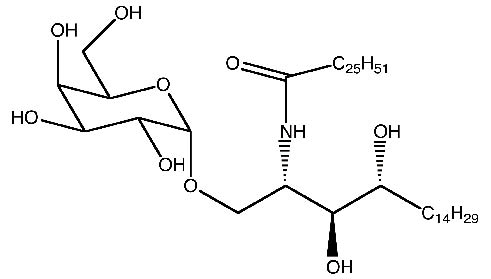
圖五 α-半乳醣苷腦醯胺結構圖13
(二)、 毛蕊花醣苷(verbascoside; acteosid)成分
毛蕊花醣苷是在醣苷的第三位置接上一個鼠李糖(圖六),屬於酚乙烷基醣苷類(phenylethyl glycosides;PhGs)。毛蕊花醣苷為蛋白激酶C(protein kinase C)及醛糖還原酶(aldose reductase)的抑制劑,不僅具有抗菌性、抗病毒性及抗癌的活性,同時也具有細胞毒性及免疫調節的功能14。
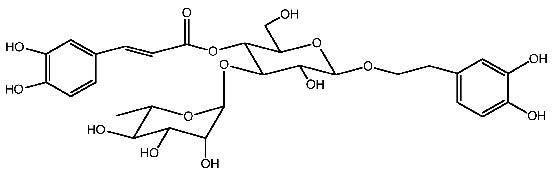
圖六 毛蕊花醣苷結構圖14
(三)、 半乳醣基絲胺酸類脂質(galactosyl serine-type lipid)成分
2005年Fan等人發現半乳醣基絲胺酸類脂質具有刺激干擾素-γ(interferon-γ; IFN-γ)及間白質素-4(interleukin-4; IL-4)的反應,這類化合物可以活化出自然殺手T細胞,而且化合物異鯨腦酸(pentadecanoic acid) [1-tetradecylcarbamoyl-2-(α-D-galactopyranosyl)-ethylamide](圖七)能呈現明顯刺激IFN-γ及IL-4表現之生物活性13。
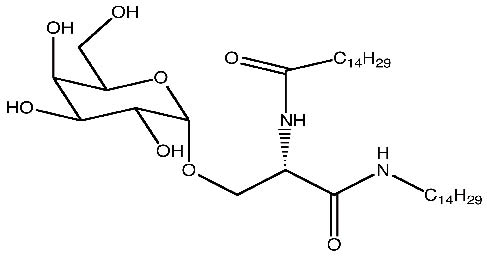
圖七 異鯨腦酸[1-tetradecylcarbamoyl-2-(α-D-galactopyranosyl)-ethylamide]結構圖13
肆、結論
碳水化合物的利用已不再侷限於昔日的食品或調味料,中研院翁院長所研發的「一鍋法醣類合成技術」研究成果也強調生物體內複合型碳水化合物的生合成路徑分析對人類疾病治療的重要性,所以複合型碳水化合物具有廣泛性的應用遠景。多醣、聚醣、唾液酸和醣複合物具有增強或調節免疫力、抗癌、抗病毒、抗氧化和抗衰老之生物活性表現,其生物活性表現與架構特性和化學性質息息相關,科學家也因此更瞭解複合型碳水化合物的結構與功效對維持生命活動極具深層影響。創新研發的複合型碳水化合物對於疫苗開發及治療感染、發炎、癌症和遺傳疾病等將能達到預期成效,讓藥物成本大幅下降,效率更高,且更符合人體所需,筆者衷心期盼複合型碳水化合物的開發與研究能有更新的突破,進而為人類疾病治療帶來更多的貢獻。
參考資料:
1. Axford J: Glycobiology and medicine: an introduction. J R Soc Med 1997; 90: 260-4.
2. Crocker PR, Feizi T: Carbohydrate recognition systems: functional triads in cell-cell interactions. Curr Opin Struct Biol 1996; 6: 679-91.
3. Adenike K, Kayode AF, Akintola A: Purification and characterization of a lectin from the seeds of Psophocarpus palustris. Pak J Biol Sci 2005; 8: 1667-71.
4. Passaniti A, Hart GW: Cell surface sialylation and tumor metastasis. J Biol Chem 1988; 263: 7591-603.
5. Santer UV, DeSantis R, Hard KJ, et al: N-linked oligosaccharide changes with oncogenic transformation require sialylation of multiantennae. Eur J Biochem 1989; 181: 249-60.
6. Varki A: Selectin ligands. Proc Natl Acad Sci USA 1994; 91: 7390-7.
7. Schmidt RR, Castro-Palomino JC, Retz O: New aspects of glycoside bond formation. Pure Appl Chem 1999; 71: 729-44.
8. Ress DK, Linhardt RJ: Sialic acid donors: chemical synthesis and glycosylation. Curr Org Synth 2004; 1: 31-46.
9. Carolyn RB, Laura LK: Carbohydrate and glycobiology review: chemical glycobiology. Science 2001; 291; 2357-64.
10. Baenziger JU: Protein-specific glycosyltransferases: how and why they do it! FASEB J 1994; 8: 1019-25.
11. Wimmer Z, Pechová L, Saman D: Koenigs-Knorr synthesis of cycloalkyl glycosides. Molecules 2004; 9: 902-12.
12. Mitchell AR: Bruce Merrifield and solid-phase peptide synthesis: a historical assessment. Pept Sci 2008; 90: 175-84.
13. Fan GT, Pan YS, Lu KC, et al: Synthesis of α-galactosyl ceramide and the related glycolipids for evaluation of their activities on mouse splenocytes. Tetrahedron 2005; 61: 1855-62.
14. Duynstee HI, de Koning MC, Ovaa H, et al: Synthesis of verbascoside: a dihydroxyphenylethyl glycoside with diverse bioactivity. Eur J Org Chem 1999; 10: 2623-32.