摘要
藥物不良反應通報目的,在於收集國內民眾使用藥物後,產生嚴重不良反應的案例,並經由案例的評估彙整、資料分析以發覺未知的、少見的不良反應,或由已知不良反應發生頻次異常的現象,進而採取必要的措施,如警訊、用藥規範等的發佈,以提昇國人用藥安全。
97年度共收集66件通報案例,其中以抗精神病藥品最常見,佔59.09%;依Naranjo評估為極可能案件佔51.52%;依不良反應結果以不希望的藥理作用佔率最高,佔71.21%;依不良反應發生器官分類,屬神經系統副作用佔率最高,為39.39%。
藉由藥物不良反應之探討,瞭解整個藥物不良反應執行過程及成效,再次呼籲院內醫療相關專業人員能積極主動參與藥物不良反應通報作業,也希望未來能更進一步儘量做到預防藥物不良反應的發生,以維護國人用藥安全。
關鍵字: 藥物不良反應、藥物不良反應通報作業、adverse drug reactions、Naranjo scale
壹、前言
藥物不良反應通報目的,在於收集國內民眾使用藥物產生嚴重不良反應的案例,並經由案例的評估彙整、資料分析以發覺未知的、少見的不良反應,或由已知不良反應發生頻次異常的現象,進而採取必要的措施,如警訊、用藥規範等的發佈,以提昇國人用藥安全。
貳、現況分析
本院自89年實施藥物不良反應通報以來,以往案例數僅為個位數,探究其原因,乃醫療人員對通報概念不甚瞭解,致使通報率甚低;有鑑於此,本院於96年8月起為加強同仁通報之概念,明訂精神科常見不良反應事件務必通報規範,並定期將案例公告醫療人員知曉,通報案例由90年的1件增加至97年的66件。
參、藥物不良反應通報作業流程
本院藥物不良反應通報及評估作業流程如圖一,各醫療人員通報的藥物不良反應報告,經由藥劑科負責統籌評估及通報。院內對於藥物不良反應通報作業,在藥事委員會內設立藥物不良反應工作小組,此小組成員由醫師、藥師組成。
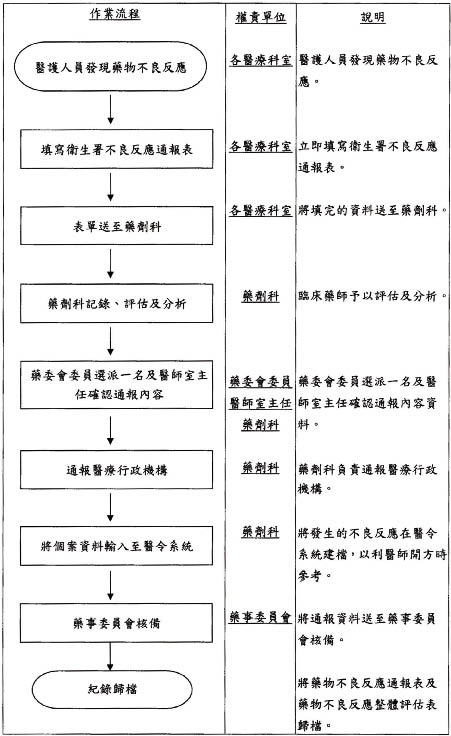
圖一 藥物不良反應通報作業流程
肆、藥物不良反應通報定義
依據美國藥物食品管理局(FDA)的定義,藥物不良反應係指使用藥品時所發生之任何不想要的反應,而不管是否與藥品有關聯,包括任何副作用、毒性或過敏反應,以及藥理學上治療失敗。世界衛生組織則定義為使用藥品於預防、診斷或治療時所發生之任何有害或不預期之反應,且此情況發生於正常使用劑量下。一般將藥物不良反應區分為type A及type B兩大類,type A其藥物不良反應是屬於藥理作用相關的,通常可由藥理作用或其延伸而預估,且大都與劑量相關,這類型藥物不良反應的發生率及致病率高,約佔所有藥物不良反應的70%~80%,如diazepam造成嗜睡或抗高血壓藥物造成的姿態性低血壓。Type B係指不可預期的不良反應,一般常用劑量下無法由已知藥理作用預測,大多與劑量或給藥途徑無關,屬於特異性反應(idiosyncratic reaction)或過敏反應(allergic reaction),其發生率低,但致死率高,如chloramphenicol造成之顆粒性白血球缺乏症(agranulocytosis)1,2。
藥物不良反應嚴重度依衛生署分類,如屬可自行緩解、額外醫療處置則歸類為輕微;如屬導致住院、延長住院時間、需作額外處置以防永久性傷害、造成永久性傷害、造成先天性畸形、危及生命及死亡等,則歸類為嚴重3。
在藥物不良反應與疑似藥物間因果關係的相關性方面,採用1981年Naranjo CA等人所提出的計分方法(表一),將可能性區分為確定(definite)、極可能(probable)、可能(possible)、存疑(doubtful)等四種4。
表一 藥物不良反應可能性評估4
是 |
否 |
不知 |
|
1. 關於不良反應,以前是否已有確定性之報告? |
+1 |
0 |
0 |
2. 該不良反應是否發生於服藥之後? |
+2 |
-1 |
0 |
3. 當停藥或使用此藥之拮抗劑,不良反應是否減輕? |
+1 |
0 |
0 |
4. 停藥一段時間再重新使用該品項,此不良反應是否再發生? |
+2 |
-1 |
0 |
5. 有沒有其他因素可以引起同樣之不良反應? |
-1 |
+2 |
0 |
6. 當給予安慰劑時,此項不良反應是否也會再度發生? |
-1 |
+1 |
0 |
7. 該藥物血液濃度是否已達中毒劑量? |
+1 |
0 |
0 |
8. 藥物劑量與不良反應的程度是否成正比? |
+1 |
0 |
0 |
9. 病人過去對同樣或類似藥物是否也產生同樣的不良反應? |
+1 |
0 |
0 |
10. 此項不良反應是否有客觀的證據?(實驗室檢驗、現場遺留藥瓶等) |
+1 |
0 |
0 |
總分_;判斷屬於下列何者 □ a.確定(≧9分) □ b.極可能(5~8分) □ c.可能(1~4分) □ d.存疑(≦0分) |
|||
伍、藥物不良反應通報之案例分析
一、疑似藥品之藥理分類
以藥理分類分析通報個案的懷疑藥品(表二),以抗精神病藥品最常見,共39件(59.09%);情緒穩定劑次之,共12件(18.18%);抗憂鬱劑則位居第三,共7件(10.61%)。
表二 97年度藥物不良反應通報疑似藥品之藥理分類
變項名稱 |
藥品(個案數) |
個案數 |
百分比 |
抗膽鹼製劑 |
biperiden(1) |
1 |
1.52% |
抗憂鬱劑 |
bupropion(1), escitalopram(2), milnacipran(1), paroxetine(2), sertraline(1) |
7 |
10.61% |
抗精神病 藥物 |
amisulpride(1), chlorpromazine(1), clozapine(3), flupentixol(1), fluphenazine(3), haloperidol(3), olanzapine(2), quetiapine(4), risperidone(7), sulpiride(11), zotepine(3) |
39 |
59.09% |
鎮靜安眠藥 |
clonazepam(2) |
2 |
3.03% |
情緒穩定劑 |
carbamazepine(3), lamotrigine(3), lithium carbonate(4), valproic acid(2) |
12 |
18.18% |
其他 |
methadone(2) |
2 |
3.03% |
未知 |
3 |
4.55% |
|
總計 |
66 |
抗精神病藥品39個案件中,以sulpiride最常見,共11件,其次為risperidone,共7件,再則為quetiapine,共4件。情緒穩定劑最常被通報的藥品為鋰鹽,共4件,其次為carbamazepine及lamotrigine各3件,再則為valproic acid,共2件。抗憂鬱劑則以escitalopram及paroxetine各佔2件,bupropion、milnacipran、sertraline各佔1件。
二、藥物不良反應通報案例統計
本院97年通報案例數共66件,通報者身份以醫師佔大部份,為46.97%;其次為護理人員,為30.30%;再則為藥師,為22.73%。通報個案之男、女性別相當,以男性56.92%略高於女性的43.08%;由通報個案之年齡分析(表三),以31至40歲之病患最多,共16件(24.24%);其次為41-50歲,共15件(22.73%)。
表三 97年度藥物不良反應通報個案基本資料
變項名稱 |
個案數 |
百分比 |
通報來源 |
|
|
個案性別 |
|
56.06% |
個案年齡(歲) |
|
|
總計 |
66 |
以不良反應型態來分類(表四),在通報個案中有83.33%屬於type A,16.67%屬於type B。懷疑藥品與不良反應的相關性,以屬於「極可能」的為最多,佔51.52%,「可能」(45.45%)次之。
表四 97年度藥物不良反應通報個案分析
變項名稱 |
個案數 |
百分比 |
型態 |
|
|
相關性 |
|
|
不良反應特性 |
|
|
不良反應結果 |
|
|
總計 |
66 |
依藥物不良反應特性及不良反應結果分析(表四),以不希望的藥理作用佔率最高,佔所有通報案例之71.21%,其次為過敏反應,佔16.67%、再則為劑量過高,佔6.06%,通報案例中有2個案例是發生鋰鹽中毒,1個案例是停用藥物所造成的副作用。通報案例中,大部份病患需額外醫療處置,佔63.64%,自行緩解則佔28.79%,有4個案例,則須增加住院日,通報案例中有1個案例是疑似服用amisulpride引起猝死。
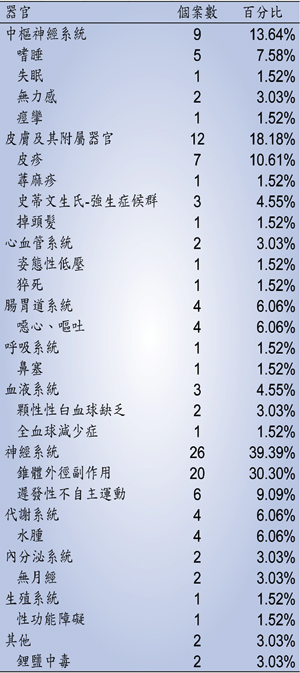
以不良反應發生器官分類(表五),屬神經系統副作用佔率最高,為39.39%;其次為皮膚及其附屬器官,為18.18%;再則為中樞神經系統,為13.64%。其中神經系統副作用以錐體外徑副作用個案數最多,共20件,遲發性不自主運動則佔6件;皮膚及其附屬器官副作用則包括有皮疹7件、史蒂文生氏-強生症候群3件、蕁麻疹及掉頭髮各佔1件;中樞神經系統副作用包括嗜睡5件、無力感2件、失眠及痙攣各佔1件。
表五 97年度藥物不良反應症狀分析
陸、結語
藥品上市前的臨床資料有限,並無法發現所有可能發生之藥物不良反應;一些發生率較低或因人種差異,潛在可能發生之藥物不良反應,藥物上市後之不良反應監視及通報可以幫助發現藥物臨床試驗時所未發現之不良反應,供衛生單位採取必要的措施,以保障用藥者之安全。監測每位患者給藥後的藥效反應,應是護士、醫師、藥師及其他醫事專業人員共同的責任。
該院94及95年通報案例各1件,96年亦僅3件,96年8月起為加強同仁通報概念,訂定務必通報原則操作型指標,且為鼓勵第一線醫護人員發現及通報,凡通報者皆給予獎勵並於網路公告藥物不良反應訊息,至97年12月底通報案件激增至66件。藥物不良反應通報概念方得以落實,雖是如此,事實上無法網羅所有藥物不良反應個案,所以希望藉由瞭解整個藥物不良反應執行過程及成效,再次呼籲院內醫療相關專業人員能積極主動參與藥物不良反應通報作業,也希望未來能更進一步儘量做到預防藥物不良反應的發生,以維護國人用藥安全。
參考資料:
1. Rawlins MD, Thomas HL. Mechanisms of adverse drug reactions. In: Davies DM, Ferner RE, de Glanville H. editors. Davies's Texbook of Adverse Drug Reactions. 5th ed. London: Chapman & Hall; 1998. p. 40-64.
2. Koch KE. Adverse drug reaction. In: Brown TR. ed. Handbook of Institutional Pharmacy Practice. Bethesda: American Society of Hospital Pharmacists, Inc., 1992. p.279-91.
3. 台灣藥物不良反應通報系統。http://adr.doh.gov.tw/
4. Naranjo CA, Busto U, Sellers EM, et al: A method for estimating the probability of adverse drug reactions. Clin Pharmacol Ther 1981; 30: 239-45.
Analysis of the Adverse Drug Reporting System in a Psychiatric Hospital
Shu-Wen Cheng
Department of Pharmacy, Taoyuan Mental Hospital,Department of Health
Abstract
Reporting of adverse drug reactions (ADRs) aims to collect domestic cases of severe adverse reactions as a result of drug use and discover unknown and rare adverse reactions through case assessments and data analysis, or to take necessary measures when an unusual incidence of a known adverse reaction is observed, e.g. the release of warnings and drug use regulations, so as to improve the safety of drug use.
In 2008, 66 reported cases were collected, among which the most common cause was antipsychotic drugs, accounting for 59.09%; cases of probable ADR, assessed using the Naranjo scale, accounted for 51.52%; based on the results of the adverse reactions, unwanted pharmacological effects had the highest rate at 71.21%; according to the classification of organs involved in the adverse reactions, nervous system side effects accounted for the highest rate, 39.39%.
Through the discussion of ADRs, one may understand the whole implementation process of reporting ADRs and its effectiveness. The author once again appeals to medical-related professionals in hospitals to actively participate in the Adverse Drug Reporting System and hopes to further prevent the occurrence of ADRs as much as possible in the future, to ensure the safety of drug use.

