摘要
奈米金具有獨特的物化性質,例如:尺寸微小、大表面積與質量比、顏色、螢光、表面電漿共振效應、表面增強拉曼散射及電化學等性質,使它廣泛被應用在偵檢、診斷及遞送系統,有些證據指出奈米金的大小、表面電荷及形狀可能與其潛在毒性有關,本文將探討奈米金特性、應用及安全性。
關鍵字: 奈米技術、奈米金、生物科技、nanotechnology、gold nanoparticles、biotechnology
壹、前言
奈米(nanometer)是一個長度的單位,表示10-9米。相較於其他金屬奈米粒,目前奈米金(gold nanoparticles, AuNP)是最常被運用的,大小約為1~200 nm,與其他生醫尺標比較詳如圖一所示。金是極為惰性的,然而,將金奈米化之後,除了表面積顯著增加外,活性也增加,若奈米金表面經特殊標記後,即可用來與小分子作鍵結,擴大奈米金的應用性,另外,奈米金還具有特殊的光學、電磁學、化學性質,可被運用在生醫研究及臨床應用。
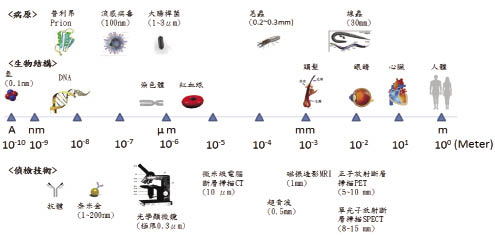
圖一 生物病原、生物結構、偵檢技術之醫學尺標示意圖
貳、奈米金在臨床之應用
一、體外偵檢工具1
(一)奈米金之表面電漿共振效應(surface plasmon resonance, SPR)
奈米金可以用來偵測小分子,球型奈米金不同的核心大小(1~100 nm)會產生顏色變化,此為奈米金表面電漿共振效應而產生光子(photon)所致,周圍的環境,配體(ligand)、溶劑及溫度等因子也會影響,奈米金會因為聚集反應由紅變藍,稱為藍移效應(blue-shift),這個特性作為對金屬離子的偵檢工具,鉀離子會與18 nm奈米金聚集形成15:5皇冠型的結構,當鉀離子的濃度由淡到濃(由μM至mM),奈米金的顏色也會從紅逐漸變成藍色。
另外,奈米金也可用來偵檢葡萄糖,將奈米金附著一層高分子的葡萄聚醣(dextran),加入洋刀豆血球凝集素(concanavalin A,conA),此時奈米金聚集呈現藍色,當加入葡萄糖時,conA會與葡萄糖鍵結,奈米金分散變回紅色。
(二)奈米金之光學性質與螢光能量轉移作用(effective fluorescent energy transfer, FRET)
由於奈米金在500~550 nm有最強吸光作用,將奈米金連結生物素(biotin)與接有鏈黴卵白素(streptavidin)的量子點(Quantum dots, QDs)混合後,生物素與鏈黴卵白素相互結合,會使奈米金與量子點彼此靠近,此時,量子點所放出的發散光(emission)波長即可被奈米金所吸收,若溶液中有卵白素(avidin),他會與量子點上的鏈黴卵白素競爭生物素,使奈米金與量子點分開,量子點的發散光即可被偵測到,量子點放光的強度可用來作為卵白素定性及定量。
另外,奈米金也可以用來篩選蛋白質辨識片段,帶正電之奈米金也可接上各式的蛋白質片段,加入帶負電的PPE(poly p-phenylene- ethynylene),奈米金的發散光會被PPE所吸收,當溶液內有可辨識此蛋白質片段之物質存在時,他就會與PPE競爭,當PPE離開奈米金,奈米金的發散光訊號就可以被偵測到,此方法用來作為蛋白質親和力之檢測。
(三)奈米金之修飾作用(modification)
奈米金以硫醇基修飾後,許多小分子都可以經此與奈米金結合,在奈米金基礎生物條碼分析中(AuNP-based bio-bar-code assay),利用此一特性,將一段當作生物條碼的DNA片段,以及另一個可辨識目標物的抗體或是核酸探針,同時接到奈米金上,此目標物可能是病原之表面蛋白或核酸,將此奈米金與可辨識目標物之磁珠相混合,若溶液內具有目標物,就會形成(磁珠-目標物-奈米金)這樣的鍵結,利用磁力以磁珠將目標物分離出來後,加熱將奈米金上當作生物條碼的DNA變性(denature),藉由偵測此DNA即可推算目標物的數量,利用這樣的設計,可以將微量的訊號放大數百倍。
(四)奈米金之表面增強拉曼散射原理(Surface enhanced Raman spectroscopy,SERS)及電化學性質
生物晶片或紙碟常利用表面增強拉曼散射原理,外加銀離子,其表面之電漿子會與光子作用,增強奈米金的訊號,此方法結合奈米金高線性關係與奈米銀高敏感性之優點。奈米金的電學或是電化學特性,也可當作生物偵測器(biosensor),利用奈米金上的寡核酸(oligonucleotide)探針與互補之DNA結合,奈米金產生氧化還原反應,造成一個氧化波,將DNA結合的訊號轉為電訊號。有些複合奈米金屬顆粒也可以加強奈米金原有之訊號,使奈米金的應用層面更加廣泛。以上體外偵檢之多元應用複合示意圖,詳如圖二。
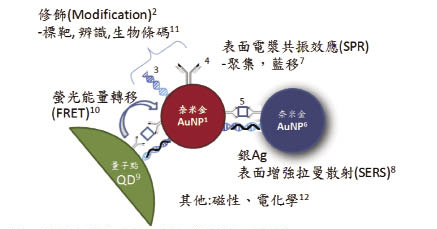
圖二 奈米金體外偵檢之多元應用複合示意圖
奈米金(AuNP)大小約為1~200 nm,單獨存在時呈紅色1,奈米金表面經由硫醇基修飾(modification)2與核酸3或抗體4結合,即可用來辨識目標物(□/ ﹌ 5,目標物可為金屬離子、小分子、蛋白質、核酸、微生物等),結合目標物而聚集之奈米金,由於表面電漿共振效應(SPR)轉為藍色6,稱為藍移(blue shift)7,此效應可以被銀離子之表面增強拉曼散射(SERS)8所增強。奈米金與量子點9(QD)近距離結合時,奈米金會吸收量子點的發散光,稱為螢光能量轉移效應(FRET)10,修飾於奈米金上的核酸還可以當作生物條碼(bio-bar-code)11,另外奈米金本身的磁性及電化學特性12,均為目前體外偵檢應用之範疇。
二、體內遞送系統方面
奈米金有幾個特性可用於體內:(1)金是鈍性無毒,以往就曾當作藥物使用,使用較為安全無慮;(2)目前奈米金的製備方法已相當成熟且簡單,可以控制大小及形狀;(3)奈米金容易被修飾成為有功能性的奈米金。
(一)藥物遞送系統(drug delivery system)2
藥物遞送系統非常多元,其中一種是利用穀胱甘肽(glutathione, GSH)在胞內外濃度差之原理,將藥物與奈米金以雙硫鍵結合,由於血中蛋白質表面的半胱氨酸(cysteine)會產生硫醇基-雙硫鍵對換(thiol- disulfide exchange),利用奈米金的立體結構可以避免此作用之產生,奈米金帶正電之特性也可幫助此藥物遞送顆粒順利通過細胞膜,進入細胞後由於GSH濃度較高,會使GSH與藥物競爭奈米金的結合位,確保藥物被遞送至細胞內後才釋出。
奈米金也可被用來攜帶單重氧(singlet oxygen)或是一氧化氮(nitric oxide),單重氧具有細胞毒性,利用金屬奈米粒攜帶phthalocyanines(PCs)PCs可產生單重氧,奈米金可增加PCs的溶解度並提升單重氧的生成量,加強PCs毒殺癌症細胞之能力。一氧化氮在細胞中扮演相當多的角色,包括血管舒張或參與免疫反應,利用polyamine-stabilized金屬奈米粒與酸性不穩定N-diazeniumdiolate結合,當此藥物遞送顆粒進入微酸環境後,如核內體(endosomes)或是溶小體(lysosomes),一氧化氮才會被釋放,可達到標的治療的效果。在我們的研究中也發現,奈米金可以加強藥物的抗氧化作用並增加其安定性(三總98年民診基金)。
(二)基因治療之核酸遞送系統(nucleic acid delivery system)
奈米金也可以用來攜帶蛋白質或核酸,病毒雖然是個理想的核酸載體,但是研究指出病毒載體可能會有一些難以預料的細胞毒性,進入體內也可能產生一些免疫反應,造成效力下降。微脂粒(liposome)則常有遞送效率過低的問題。奈米金體積很小,具有高表面積/體積比,大大提升了核酸負載量,由於金屬微粒改變電荷性質,使得傳遞的效率增加毒性減低,另外以附有四極胺陽離子(cationic quaternary ammonium)的奈米金與核酸以靜電力結合,可以保護DNA不被酵素降解。
(三)分子標的治療(molecular targeted therapy)
奈米金也被利用在分子標的治療(molecular targeted therapy),在胰臟癌發現tyrosine kinase(TKs)會有大量表現,例如:上皮細胞生長因子接受器(epidermal growth factor receptor, EGFR),利用奈米金為載體,結合抗EGFR的抗體當作辨識癌細胞的工具,另外鍵結一個抗癌藥物gemcitabine,將藥物帶到目標組織,針對癌細胞進行毒殺,不但可以將低抗癌藥物劑量並可減少副作用。
(四)奈米金其他臨床應用
射頻消融術(radio frequency ablation, RFA)是利用微電極在腫瘤組織中,經由交流電在體內產生迴路,產生局部高熱,而將腫瘤細胞燒死,經由奈米金可產生更多熱能,增加腫瘤死亡的數量。由於人體是強吸光體,光熱治療法(photothermal therapy, PTT)僅侷限於皮膚癌症之治療,利用雷射光可將光子的能量集中,加強穿透力,但無組織選擇性。利用奈米金結合抗體後,可以專一性的到達腫瘤的位置,利用表面電漿共振效應加強可見光及近紅外線的吸收,克服穿透力以及專一性的問題,且共振效應產生極大熱能,可達到光熱治療的效果稱為電漿光熱治療(Plasmonic photothermal therapy, PPTT)3。另外,利用奈米金也可以增強X光斷層掃描之訊號,對於疾病的診斷及判讀會更有幫助。奈米金在生物體內之應用詳如圖三。
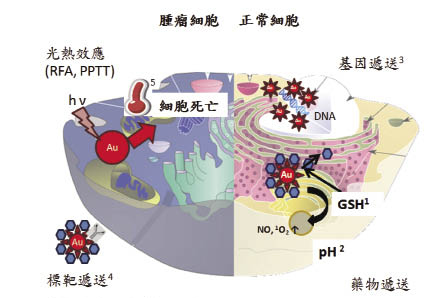
圖三 奈米金在生物體內之應用
奈米金目前在生物體內的應用可分為四個方面,一、利用奈米金硫醇基的修飾,奈米金可攜帶藥物,利用胞內外穀胱甘肽(GSH)濃度差1或是特殊胞器酸鹼值差異2,使藥物在適當部位釋放。二、奈米金攜帶核酸3,增加遞送效率、降低副作用、減少核酸降解。三、奈米金結合抗體,可以將藥物遞送至特定器官4。四、奈米金可增加射頻消融術(RFA)及電漿光熱治療(PPTT)的作用,產生更多熱5來殺死癌細胞。
參、奈米金之健康風險及安全性
由於奈米金獨特的物化性質,其安全性也開始受到重視,奈米金的大小、表面帶電多寡及形狀對細胞產生不同反應,不同尺寸的奈米金在體內具有分佈相差異,10~50 nm小顆粒可以分布到身體各個組織,100~200 nm大顆粒只會到達肝、肺、腎、脾等器官。1.4 nm奈米金顆粒會與DNA結合而造成損傷,18 nm奈米金顆粒則無反應。奈米金顆粒表面帶正電荷,可以增加基因遞送的效率,但正電荷對細胞膜會造成機械性的破壞而引起毒性4。帶有蛋白質之奈米顆粒,進入細胞後被送至核內體,由組織蛋白酶L(Cathepsin L.)對奈米顆粒外的蛋白質進行降解5,在設計體內奈米金之應用時都要注意。
肆、結語
奈米金在生物科技及臨床上的應用上已經越來越廣泛,它具有放大偵測訊號、降低訊號背景值、增加藥物吸收、降低藥物副作用、標的目標組織、殺死癌細胞等優點;奈米金目前已運用於單一目標之檢驗,如何進一步應用在多重偵檢,是個研究重點,在體內由於奈米金的長期毒性及其代謝機制還不是很明確,不同大小及形狀的毒性,代謝產物是否會造成組織之損傷有待更多研究證實。奈米金的物化性質還一直被發掘中,在安全無虞的狀況下,利用奈米金進行更多非侵入性生物造影之研究是趨勢,具標的作用的藥物或基因遞送系統,或是利用奈米金本身的性質來毒殺癌症細胞,是未來繼續努力的目標。
參考資料:
1. Agasti SS, Rana S, Park MH, et al: Nanoparticles for Detection and Diagnosis. Adv Drug Deliv Rev, 2009.
2. Patra CR, Bhattacharya R, Mukhopadhyay, D, et al: Fabrication of gold nanoparticles for targeted therapy in pancreatic cancer. Adv Drug Deliv Rev, 2009.
3. Huang X, Jain PK, El-Sayed IH, et al: Plasmonic photothermal therapy (PPTT) using gold nanoparticles. Lasers Med Sci 2008; 23(3): 217-28.
4. Aillon KL, Xie Y, El-Gendy N, et al: Effects of nanomaterial physicochemical properties on in vivo toxicity. Adv Drug Deliv Rev 2009; 61(6): 457-66.
5. See V, Free P, Cesbron Y, et al: Cathepsin L digestion of nanobioconjugates upon endocytosis. ACS Nano 2009; 3(9): 2461-8.
Nanotechnology: The Clinical Application and Development of Gold Nanoparticles
Yi-Jung Ho1, Ming-Kung Yeh2, Sung-Ling Tang3,
pharmacist1
professor, Institute of Preventive Medicine, National Defense Medical Center2
pharmacist, Department of Pharmacy Practice, Tri-Service General Hospital3
Abstract
Gold nanoparticles(AuNPs)showed unique physico-chemical properties such as small size, large surface area to mass ratio, colorimetric, fluorescence, surface plasmon resonance, Surface enhanced Raman spectroscopy and electrochemical. It was extensively utilized for detection, diagnosis and delivery systems. Some evidences suggested that the size, surface charge, and shape play key factors related to potential toxicity of AuNPs. This article discussed the properties, utilization and safety of AuNPs.

