摘要
自從衛生署執行藥物回收暨通報機制以來,凡是發現違反藥事法所規定之偽藥、禁藥、劣藥、及不良醫材等情形,或有疑似因藥物不良品而可能導致病人受到傷害時,皆可通報藥物不良品系統,藉由全國性通報系統的設置,全民共同監督,讓廠商得以檢討改進,達到全面品質提升,這也是了解藥品上市後品質資訊的重要方式,但是現今醫療人員工作負荷量龐大,持續使用過去紙本的通報方式,無法即時將不良品狀況反應至中央主管機關並獲得有效的處理,由於使用藥物不良品可能會危害病人,導致不良反應發生,本院重視病人用藥的安全,為便利院內同仁通報,自民國98年3月開始建置電子化通報系統,讓藥物不良品相關資料蒐集,得以更加迅速完善。
關鍵字: 藥物不良品通報、藥物安全監視、通報流程、medical product defect reporting system、drug safety surveillance、notification procedures
壹、前言
藥品是醫療衛生產業中相當重要的項目,各國對於藥品的管理都有嚴格的監督系統,以確保病人用藥的安全,藥物品質的監控,除了在申請時必需備有化學製造管制文件 (Chemistry, Manufacturing and Controls, CMC),製造過程須符合藥品優良製造作業規範 (Good Manufacturing Practice, GMP) 相關規定外,上市後藥物品質檢測及不良品的通報與回收也是確保藥物品質重要的一環2。藥物經核准上市後,主管機關藉由主動抽查進行實質檢測,以評估所宣稱的產品品質是否符合,是最能夠確保藥物品質的方法,但如果採用此方式,每一批次均需由主管機關檢測合格後始准販售,主管機關將面臨執行困難的問題,對業者而言,則是金錢與時間的雙重浪費,但由於使用藥物不良品可能導致不良反應發生而危害病人,行政院衛生署為確保藥物的品質與安全,有效維護國人健康,除於實質檢測不足的部分加強製造過程中,原料、製程、分析、清潔確效等步驟,並於民國89年5月公告了「藥物回收作業實施要點」。民國92年並委託全國不良反應通報中心,負責建立藥物不良品通報系統,方便發現藥物不良品的人員,能在第一時間進行通報作業,透過通報機制的建立,希望將安全與療效的資料結合於藥物的製造品質上,減少誤用藥物不良品,進而提高用藥的安全。本院重視病人的用藥安全,鼓勵所有醫療人員通報,為能使第一線醫療人員在接獲民眾抱怨,或發現藥物不良狀況時方便立即通報,並能夠及時獲得說明、換貨、批次回收等處理,因此在民國98年3月建置了院內電子化通報系統,運用院內同仁經常使用的電子表單作業畫面,整合對內、對外之作業窗口,讓資料蒐集得以更加迅速完善。
貳、執行步驟
本院電子化藥物不良品通報流程如 (圖一)。通報來源除了院內的醫療人員,民眾亦可透過藥物諮詢時,將使用發現的不良品反應給藥師,再由藥師至電子表單系統中代為通報 (圖二)。來自各科部醫療人員及民眾的不良品,先由藥局藥師初步判定及更換後,送交藥劑科統一處理窗口彙整資料、評估、處理及通報至全國不良品中心。處理窗口接獲電子表單及不良品後,除了有爭議,或者資料填寫不全、不易追溯查證而無法立案的情形,以及療效不佳的通報案件外,其餘藥物不良品都需要拍照留存,處理窗口負責連絡廠商,請廠商盡可能在期限內回覆說明,藥劑科處理窗口再根據廠商說明資料進行不良品分類改善處理,若藥品屬於嚴重變質,不可繼續使用者,旋即調查統計院內使用狀況及存貨、批號、數量,進入全面回收處理流程 (圖三)。若是由於人為使用不當,則加強民眾衛教、安排時間進行醫療人員教育訓練,或直接於全院網頁上公告正確使用方式。對於同一年度單次發生的案件,但可能危害病人用藥安全,則請廠商更換瑕疵品,通報總院藥劑部,視其它院區是否有相同通報情形而做檢測處理,若其它院區也同時反應相同的狀況,則往上呈報行政院衛生署藥物不良品中心,若在同一年度內陸續接獲類似個案,則除了通報藥劑部、行政院衛生署不良品中心外,另還會建議通知本院財管部,以提供作為續簽藥品合約時之參考。
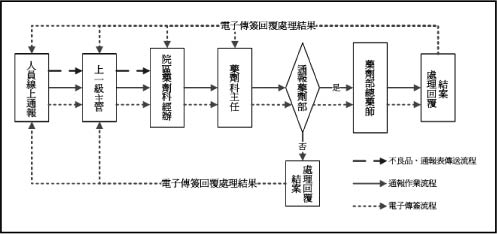
圖一 某醫學中心藥物不良品通報處理流程
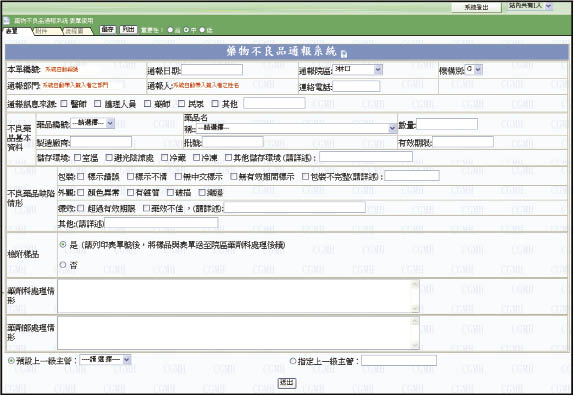
圖二 藥物不良品電子化通報系統
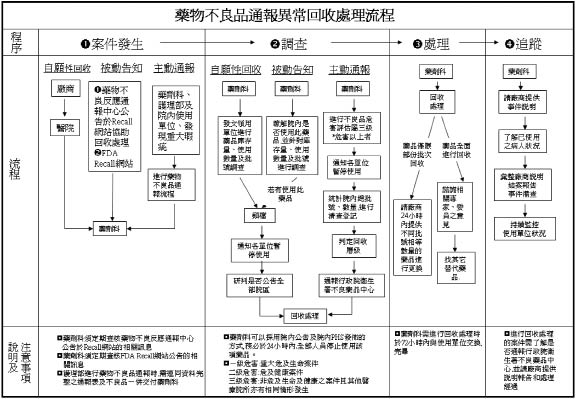
圖三 藥物不良品通報異常回收處理流程
參、結果
本院自從民國92年配合行政院衛生署委託全國不良反應通報中心,接受藥物不良品通報作業以來,案件數從92年度共收到3件,至98年時達到68件,早期案件主要是由民眾使用後發現並主動告知居多,這幾年藥師通報案件則占大多數,顯示出藥師更加主動積極介入藥物品質的監控,本文以民國98年總共收集的68件資料分析,其中衛署藥製藥品共計44件,衛署藥輸藥品共24件,通報案件內容如表一。因為人為使用不當,於全院網頁上公告正確使用方式者共二件,請廠商更換的瑕疵品通報原因分析中,產品外觀異常占最大部份 (共25件,36.8%),其次為產品設計缺陷 (18件,26.4%),此大多發生於給藥輔助器,其中僅一例發生於藥品設計本身,病人描述此藥品服用後無法吸收,最後錠劑整顆完整由糞便排放出,說明於表二。由於民眾消費意識逐漸抬頭,近來療效不佳的案件,案件數與比例都有逐年增多的趨勢,申訴內容也更加多樣性,其中5件,病人認為所服用的藥品除了療效不佳之外,還導致藥物不良反應 (ADR) 的發生。不良品拍照後通常會交由廠商直接帶回化驗並更換新品 (共計49件),但有四項藥品將某些發生問題的批號回收,而有一項藥品基於安全考量,最後進行全院藥品回收處理 (如表三),總計共6件以醫院回覆函及線上通報至全國藥物不良品中心。所有劑型中,針劑是通報件數最高者 (30件, 44.1%),其次才是外用與口服錠劑 (13、11件,19.1%、16.2%),詳見表四。
表一 98年通報案件內容
不良品原因分類 |
通報件數 |
||
國內製造 |
進口 |
合計(%) |
|
藥品外觀異常 |
18 |
7 |
36.8 |
標示 |
1 |
0 |
1.5 |
包裝不完整 |
10 |
6 |
23.5 |
療效不佳 |
7 |
1 |
11.8 |
產品設計缺陷 |
8 |
10 |
26.4 |
總數 |
44 |
24 |
100 |
表二 98年通報不良品原因分類
不良品原因分類 |
件數 |
比例 (%) |
|||||
產品外 觀異常 |
顏色異常 |
潮濕 |
碎裂 |
結晶 |
有雜質 |
25 |
36.8 |
6 |
2 |
5 |
10 |
2 |
|||
藥品標示 |
無有效期限標示 |
1 |
1.5 |
||||
包裝 |
數量缺少 |
5 |
7.3 |
||||
包裝不完整、損害 |
11 |
16.2 |
|||||
療效不佳 |
效果較之前的差 |
3 |
4.4 |
||||
效果較之前的差且引起ADR案件 |
5 |
7.4 |
|||||
其它 產品設計 缺陷 |
噴嘴 |
刻度不準確 |
瓶蓋脫落 |
不易使用 |
其它 |
18 |
26.4 |
2 |
3 |
5 |
1 |
7 |
|||
合計 |
68 |
100 |
|||||
表三 藥品回收案件
藥物不良品回收及更換範圍 |
案件數 |
比例(%) |
無退換貨處理 |
14 |
20.6 |
僅瑕疵品單一更換 |
49 |
72.1 |
依照藥物不良品之批次回收更換 |
4 |
5.9 |
被通報之藥物不良品全院回收更換 |
1 |
1.4 |
表四 98年藥物不良品通報案件劑型分析
藥品劑型 |
通報件數 |
比例(%) |
針劑 |
30 |
44.1 |
大瓶點滴注射液 |
7 |
10.3 |
口服劑 |
||
錠劑 |
11 |
16.2 |
膠囊 |
5 |
7.4 |
水劑 |
1 |
1.4 |
外用 |
13 |
19.2 |
眼用 |
1 |
1.4 |
肆、討論
過去民眾發現不良藥品時,處理方式頂多由藥局更換新品給民眾,並不能提供說明及提出有效的解決、改善方法,回饋給發現人員,因而可能造成其他人不小心再次使用不良品。醫院內藥物不良事件的發生通常由許多複雜的因素所造成,產品品質只是其中的一項、其他還包括了整體作業流程、人員素質、知識、行為、病人特質,也都可能導致藥品使用產生相關問題,因此要做好病人安全照護工作,減少藥物不良事件發生,其中重要的一項工作就是必須能夠從已經發生的事件中,詳細探究原因,進而提出檢討改進4。藉由調查、追蹤、分析通報資料及與廠商溝通,除了可協助發現一些後端的問題,促使廠商重新整體檢驗從生產、運輸、至貯存等流程,提供改善流程及製造的資訊,並可以及時發覺、更正問題點,以預防將來再次發生,有效地改善藥品使用的品質。因此,雖然藥物不良品並不像 ADR 目前以法律強制通報,但如果所有醫療專業人員將通報落實於日常執業行為中,加上醫療機構中藥品採購以實際行動配合,廠商對於通報的問題會更加重視以及謹慎處理,藉此提升藥品穩定度與品質,讓民眾用藥更安全,同時也可以健全上市後的監督機制 (postmarketing surveillance)。
目前國內藥物不良品通報的實施,還未處於完全成熟階段,需要藉由更多人的參與,不斷的改進,才能使通報作業更趨完善,特別是目前面臨越來越多療效不相等的通報案件,這些案件大多發生於相同藥品,醫院更換藥廠之後,由於加入了消費者的主觀意識,因此相當不容易評定3。且大多數通報者申訴之後,都急於知道醫療機構可能採取的做法與行動,如果沒有盡快回覆通報者,或者處理情況不一時,都將使得通報者對通報系統感到灰心與不滿,因此應盡快建立後續處理的相關配套辦法,例如不良品名稱、批號、訊息公告,警示、懲處、訊息發布等方法,以保障全國民眾之用藥安全。醫療人員平時也應多加了解國內各項衛生法規管理機制,收集國內外藥物使用的安全性資訊,培養主動偵測及追蹤不良品的能力,提昇用藥品質,並提供病人正確的藥物使用資訊和品質優良的藥物,以保障國人用藥安全5。
參考資料:
1. 全國藥物不良品通報系統。資料來源: http://recall.doh.gov.tw/。擷取日期:2010/07/08。
2. 葉嘉新、林志六:新藥開發與臨床試驗,一版。臺北市,秀威資訊科技發行,2008:139-143。
3. 美國藥物食品管理局。資料來源: http://www.fda.gov/AboutFDA/CentersOffices/CDER/ucm082071.htm。擷取日期:2010/07/08。
4. 陳惠芬、高純琇:藥物安全監視之藥物不良品通報。藥物安全簡訊2005;10:4-11。
5. Susan Okie. Multinational Medicines-Ensuring Drug Quality in an Era of Global. The New England Journal of Medicine 2009; 20: 361-8.
Implementation of Medical Defect Products Reporting System in a Medical Center
Yi-Chin Chen, Chiu-ying Wu, Ching-Ling Tai, Pin-Yu Lee
Department of Pharmacy, Chang-Gung Memorial Hospital — Kaohsiung Branch
Abstract
Since drugs recall and notification system have been implemented by department of health, those violating the pharmaceutical affairs act like counterfeit, prohibited and illegal medicines and any medical devices which may be hazardous to the consumers or users, can be reported via the medical defect products reporting system. When the defect medical products are detected, health care providers, manufacturers, and the public are encouraged to report the cases to national reporting center through mail, fax, email, or the on-line reporting system. By means of setting up the national medical product defect reporting system in Taiwan, we could prevent people from being harmed due to defect medical products and ensure the quality of medicines. However, due to the huge burden of workload, it seemed not efficient to pass the message to the national medical product defect reporting system by the traditional way. We care about the medication security of patients and thus we have implemented numerous pharmacovigilance activities in recent years to encourage health care professionals to report defect medical products through on-line reporting system since March 1999 in our hospital. By this way we can collect data more rapidly and completely, hence to promote public health.

