摘要
依據 WHO 估計全世界C型肝炎的盛行率約3%,而台灣C型肝炎感染者約有三十萬人。HCV 在世界各地的盛行率及基因型分佈會因地理位置不同而有所差異。目前臨床上用來治療C型肝炎的標準用藥主要是每週給予長效型的干擾素 pegylated interferon alfa (Peg-INF) 和雷巴威林 (ribavirin),治療24~48週,持續性病毒學反應 (sustained virologic response,SVR) 可以達到50%-85%。未來新藥的研發方向包括:改良式的干擾素製劑、特定標靶抗病毒藥物 (specifically target antiviral therapy; STAT-C) 如:蛋白酶抑制劑及聚合酶抑制劑、副作用更小的雷巴威林類似 (Ribavirin-like) 藥物。C肝將走向「雞尾酒合併療法」,治癒率可望提升,造福更多的慢性C型肝炎患者。
關鍵字: 慢性C型肝炎、HCV、長效型干擾素、ribavirin
壹、前言
慢性C型肝炎是全球公衛的主要課題,由C型肝炎病毒感染所引起的,此病毒具有高度的致病率及致死率,預估全球約有一億八仟萬人感染,高達全球總人口數的3%,而大約15~25%感染者不經治療而能痊癒1,75~85%將會發展成慢性肝炎,慢性肝炎患者約有15~20%可能發展成更嚴重的肝硬化及肝細胞癌,若不進行肝臟移植將會導致死亡1。在過去稱為非A /非B型肝炎,於1989年才首度被定義出來2,以前臺灣感染主要來自於輸血造成,但自1992年7月起,C型肝炎抗體檢驗納入血液篩檢後,幾乎罕見輸血後C型肝炎之發生。2007-2009年台灣的急性C型肝炎每十萬人口發生率分別為0.66、0.56、0.573。因為 HCV 突變機率高且基因型變異大,至今還未開發出能有效預防之疫苗。
貳、 C 型肝炎病毒 (Hepatitis C Virus;HCV)
是單股 RNA 病毒 (single-stranded RNA virus) 屬於 Flaviviridae family 的 Hepacivirus2,直徑約30~50 nm,具有外套膜 (envelope),帶有一段正性 RNA (positive-sense) 作為遺傳物質。依據 genomic nucleotide sequence 的差異,目前分成六個主要基因型 (genotypes),及超過50個以上的基因亞型 (subtypes)4,命名方式依發現的次序將基因型由1至6命名,亞基因型也依發現的次序,使用小寫的字母表示 (1a,1b,2a,2b,ect) 4,5。
第1、2、3 型廣泛分佈於全球,其中 1a 主要在西歐和北美,而 1b 常見於日本、台灣、南歐和東歐;4、5、6 型則分佈於少數特定區域,第4型主要存在於非洲,4a 為埃及之主要亞型;第5型存在於南非;而第6型多發現於東南亞如香港和越南。台灣地區之分佈近似於日本,以1b為主,約佔全部之45-71%3。臺灣之流行病學調查,估計約三十萬人口感染,盛行率為2~4%3。
參、藥理學療法 (Pharmacologic Therapy)
治療目的希望能達成清除病毒的目標,進而減緩肝臟損傷的程度及預防併發症,同時期許能避免進展至肝硬化、肝癌,以增進病人的生活品質。
臨床上判斷感染是否根除,是由病毒持續性反應 (SVR定義為停藥後24週在血清中未再驗出 HCV-RNA) 達成與否來判定。此外可藉由早期病毒反應 (early virologic response,EVR,治療12週後 HCV-RNA 是否消失或病毒量降低兩個對數,也就是100倍) 來預測治療結束後是否能得到正面的反應成效,常用於基因型第1型的病人。在治療4週後,血清中病毒量即低於檢測極限者,即達到快速病毒反應 (RVR, rapid virological response),可以縮短治療時間。
在開始抗病毒藥物治療前,會先排除不適合者。接下來會評估病人的情形,如病毒基因型、病毒量、性別、年齡、肝臟健康狀況受損程度和體重,以進一步訂定合適的治療流程與用藥劑量與時間。目前的標準治療是每週皮下注射長效型干擾素 (pegylated interferon,Peg-IFN),使用24~48週,加上每天口服 ribavirin 800~1200 mg (分兩次給藥) 之合併療法。大約有50~80%的病人可以達到病毒持續性反應6。目前全民健保慢性C型肝炎治療藥物健保給付規定其療程是依病毒動力學 (viral kinetics) 作區分,而不以基因型做區別 (圖一)7。
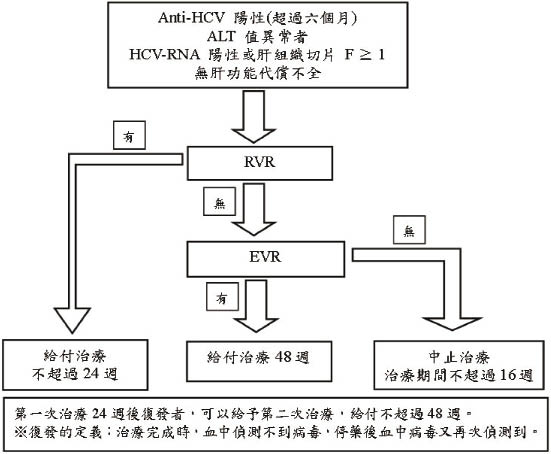
圖一 全民健保慢性C型肝炎藥物給付規定7
肆、治療藥物介紹
一、長效型干擾素9
干擾素治療C肝的作用機轉,主要是藉由刺激免疫系統,產生對抗C肝病毒的作用,並截斷細胞訊息的傳達,達到抑制病毒的複製和造成受感染肝細胞死亡的作用。
目前已上市的傳統型干擾素有IFN-α2a (Roferon-A)、IFN-α2b (Intron A) 和 IFN-alfacon-1 (Infergen)。Peg-IFN-α2a (Pegasys) 及α2b (Peg-Intron) 為 IFN-α2a 和 α2b 加上聚乙二醇 (polyethylene glycol) 之衍生物,也就是長效型干擾素,作用機轉和IFN-α相同,其優點是在注射後,吸收過程延長,加上在體內代謝速度變慢,及延長半衰期,所以使用頻次可降低為一星期只注射一次,臨床上讓患者方便許多。PegIFN-α2a 每次劑量為 180 µg,PegIFN-α2b 之劑量為每公斤1.5 µg。
副作用主要類型包括:類似感冒症狀 (如:頭痛、發燒、肌肉酸痛、四肢無力、疲倦及寒顫等),必要時可使用 acetaminophen (每日小於2 g) 或 NSAID 來緩解。精神症狀 (如:容易激怒、注意力難集中、記憶變差、憂鬱)、自體免疫功能失調 (如:甲狀腺自體免疫性發炎) 及血液檢驗數值異常 (如:白血球減少、血小板減少)…等四大類。
二、Ribavirin9
Ribavirin (RBV) 是一種人工合成之 guanosine nucleoside analog,抗病毒活性可能是透過調節免疫系統,活化免疫T細胞功能,藉由競爭細胞的酵素,以達到抑制病毒 RNA 複製及蛋白質合成。不建議作為單一療法,應合併干擾素治療。建議劑量因病人之基因型及體重而異:基因型第1型的病人,體重小於等於75 kg 者,使用方式為早上400 mg /晚上600 mg;體重大於75 kg 者,早晚各600 mg。基因型第2、3型的病人則是早晚各400 mg。
使用 ribavirin 治療時,由於其致畸胎性,因此無論男女,一般建議治療及停藥半年內需採取兩種以上的避孕措施。缺血性心臟病、腦血管疾病和腎功能不全之病人也應避免使用。其他常見副作用如溶血性貧血、出疹、搔癢等。
伍、C型肝炎治療新藥的發展
儘管目前的治療方法是有效的,效果已經提升,但對於部分病人不能達到 SVR 或是再復發的人是無效的,且考量其治療可能的副作用,尋找更有效且更安全的抗病毒藥物確有其必要。針對有潛力的幾種藥物,其臨床試驗都已在進行中,包括:新的干擾素發展、蛋白酶抑制劑、聚合酶抑制劑、與副作用較低之雷巴威林類似藥物等
一、 Albinterferon α- 2b (alb-IFN;白蛋白-干擾素)10
Albinterferon α-2b 是一個 single polypeptide,利用基因重組而成,它包括人類 IFNalfa-2b的人血清白蛋白融合基因 (Human IFN alfa-2b+Human serum albumin;HAS)。人血清白蛋白是一種天然的載體蛋白,具有半衰期長,做此結合可以延長半衰期,維持生物活性在2~4週的間隔。建議劑量為每兩週使用 albIFN 900 µg,並每天口服 ribavirin 800~1200 mg (分兩次給藥) 之合併療法。治療效果並不亞於長效型干擾素,但是每2週使用一次,可提供病人另一種有效的治療方案。
二、 特定標靶抗病毒藥物 11
以病毒感染肝細胞的過程研發新的抗病毒藥物,STAT-C 就是針對 HCV 生命周期 (特別是基因組結構和多蛋白加工區) 的特定階段所需要的各種蛋白加以抑制,可能有阻擋病毒增生的功效,如解螺旋酵素抑制劑、蛋白酵素抑制劑以及聚合酶抑制劑。
(一) 蛋白酶抑制劑 (NS3⁄4A protease inhibitors)11
這類藥物目前有 Telaprevir (VX-950;Incivek) 和 Boceprevir (SCH503034;Victrelis) 已進入臨床測試第三期,此兩種藥物可以阻斷病毒複製時所需的蛋白酶,單一使用可有效的抑制病毒增生,但是必須與原有治療藥物合併使用。三合一治療使用後可以有效提高 SVR。Ciluprevir (BILN-2061) 是另一種蛋白酶抑制劑,遺憾的是,在動物實驗中所出現的心臟毒性已阻礙其進一步的研究發展。
(二) 聚合酶抑制劑 (NS5B polymerase inhibitors)11
RNA 聚合酶抑制劑包括類核物 (Nucleoside analogue):Valopicitabine (NM283);R1626;PSI-6130 和它的前藥 R7128;IDX184;非核類似物 (Non-nucleoside;NNI):BI207127;Filibuvir (PF-00868554);HCV-796 (已停止) 等。作用機制主要包括阻斷病毒 RNA 合成和抑制 RNA 聚合酶活性。
Valopicitabine 是首個進入 II b 期臨床試驗的聚合酶抑制劑,但它的腸胃副作用及 FDA 對它的效益和安全性表示擔憂,所以美國暫停了它的臨床試驗。
第二個聚合酶抑制劑是 R1626,針對 genotype 1 病人,高劑量的 R1626 有很高的抗病毒活性,然而嚴重的淋巴細胞減少症 (lymphopenia) 和傳染性疾病導致停止發展。
R7128 (Roche公司開發) 是另一個強效抗病毒活性的核苷聚合酶抑制劑。目前,R7128 已經進入第二階段的臨床試驗研究,對其未來的發展正在進行觀察中。
三、雷巴威林類似 (Ribavirin-like) 藥物12
Taribavirin (TBV) 先前的名稱是 Viramidine,是 RBV 的前驅藥物,會優先被肝臟吸收而轉換成 RBV,不會聚積在紅血球引起溶血,副作用較低。在第二期的臨床試驗中,併用 Taribavirin 與長效型干擾素α治療慢性C型肝炎,在24週後的抗病毒效果與 Ribavirin 相當,但顯著地較少引起溶血性貧血;第三期臨床試驗正在進行中。在未來,Taribavirin 有希望可以成為 RBV 外的另一個選擇。
陸、總結
C型肝炎病毒在台灣地區是很高的流行疾病,其造成日後肝硬化及肝癌的機率很高,且目前尚未發展出預防感染的疫苗,因此除了衛教民眾避免可能感染 HCV 的危險行為外,應定期篩檢以早期發現早期治療,預防肝臟功能進一步惡化。雖然目前標準的治療方式無法完全的治癒某些C肝患者,但新開發的藥物,C肝將走向「雞尾酒療法」,配合干擾素、雷巴威林等合併多種藥物治療,都有機會可將血中 HCV-RNA 清除,治癒率可望再提升,造福更多的慢性C型肝炎患者。
參考資料:
1. World Health Organization.Initiative for vaccine research. Hepatitis C virus
2. Suzuki T, Ishii K, Aizaki H, Wakita T.Hepatitis C viral life cycle. Adv Drug Deliv Rev. 2007 Oct 10; 59(12): 1200-12.
3. 疾病管制局全球資訊網
4. Bukh J, Miller RH, Purcell RH.. Genetic heterogeneity of hepatitis C virus: Quasispecies and genotypes. Seminars Liver Dis. 1995; 15(1): 41-63.
5. Simmonds P, Holmes EC, Cha TA et al: Classification of hepatitis C virus into six major genotypes and a series of subtypes by phylogenetic analysis of the NS-5 region. J Gen Virol. 1993; 74: 2391-2399.
6. Fried MW, Shiffman ML, Reddy KR, et al: Peginterferon alfa-2aplus ribavirin for chronic hepatitis C virus infection. N Engl J Med2002; 347: 975-982.
7. 全民健康保險加強慢性B型及C型肝炎治療試辦計畫
8. 好心肝全球資訊網http://www.liver.org.tw/index.php
9. Micromedex
10. Nelson DR, Benhamou Y, Chuang WL, et al: Albinterferon Alfa-2b Was Not Inferior to Pegylated Interferon-α in a Randomized Trial of Patients With Chronic Hepatitis C Virus Genotype 2 or 3, Gastroenterology. 2010, 139 (4): 1267-1276.
11. Lange CM, Sarrazin C, Zeuzem S. Review article: specifically targeted anti-viral therapy for hepatitis C-a new era in therapy. Aliment Pharmacol Ther. 2010 Jul; 32(1): 14-28.
12. Kwo PY, Vinayek R. The Next Step for Taribavirin. Hepatology. 2010 Oct; 52(4): 1185-8.
Chronic Hepatitis C Virus
Chun-Nan Wu1, Chun-Pai Hsiao2, Min-Ling Tsai3
Department of Pharmacy, Chung-Shan Medical University Hospital1
Jen-Ai Hospital Tali Taichung2
Department of Pharmacology, Chung-Shan Medical University3
Abstract
The World Health Organization estimates that 3% of world’s population is infected with the Hepatitis C virus (HCV) and there are 300,000 people with HCV infection in Taiwan. The current standard of therapy is a combination of pegylated interferon and ribavirin (RBV). Sustained virologic response (SVR) rates is 40%-52% for genotype 1,and 70%-85%for genotype 2 or 3. Consequently,there has been a drive to develop new agents specifically targeting essential components of the viral life cycle, such as the hepatitis C virus (HCV) NS3/4A serine protease. HCV will be to "cocktail combination therapy", SVR is expected to enhance the benefit of more patients with chronic hepatitis C.

