摘要
結核病的治療需使用數種抗結核藥,一線藥中 isoniazid (H)、rifampin (R)、和 pyrazinamide (Z),皆具有不同程度的肝毒性。病人服藥後發生肝毒性的試藥方式,尚無統一的標準,本研究回溯某醫學中心自94年至99年間,通報抗結核藥品引起肝毒性的案例,我們觀察肝功能指數的變化,並分析醫師重新投藥的策略。結果符合條件共26位,試藥順序以先給H再給R為最多有15人 (60%),其次是先給R再給H有5人 (20%),此過程有5人 (25%)再次發生肝毒性;另有9位當重新加回Z時,成功有5位 (55%),分析4例 (45%) 失敗的原因皆為肝指數異常,在探究重試Z藥失敗比例高,因此我們認為服用 HRZ 發生肝毒性較嚴重者,不建議再重試時加回Z。
關鍵字:抗結核藥重新投予、抗結核藥致肝毒性、antituberculosis drugs reintroduction
壹、前言
結核病的治療需同時使用數種抗結核藥品,且必須持續使用數個月。常用的一線藥為 isoniazid (H)、rifampin (R)、ethambutol (E) 和 pyrazinamide (Z),其中以H、R和Z皆具有不同程度的肝毒性。現今國際間在結核病處置上,關於肝功能指數監測的必要性及發生肝毒性之後的給藥方式,尚無統一的標準1-7,在台灣,目前建議重新試藥方法採用英國胸腔科協會的指引6。本篇參考前瞻性研究之重新給藥流程設計4,以回溯方式探討結核病人服藥後發生肝毒性,然後從試藥流程作開端進行回顧呈現與討論。
貳、研究方法
一、收案定義
本研究為了評估是抗結核藥品引起的肝炎,採用三種判別方式:(一) 以藥物性肝炎之定義進行評估,定義為「當醫師給予抗結核藥,病人發生厭食、噁心嘔吐、或黃疸及天門冬酸轉胺酶 (aspartate aminotransferase; AST)、丙胺酸轉胺酶 (alanine aminotransferase; ALT)、總膽紅素 (total bilirubin) 等上升,在停藥後肝指數漸漸恢復正常,當再度使用又發生肝炎」;(二) 並排除治療期間發生急性病毒性肝炎者;(三) 以 Naranjo score 藥品不良反應評分表進一步分析8。
二、研究對象之納入與排除條件
本研究以回溯性方式,蒐集94年至99年間,病人同時服用第一線抗結核藥 HRZ,在首次服用後,疑似抗結核藥引起肝毒性症狀進而被通報的對象。研究進一步排除曾經得過結核病者、結核病治療期經菌種鑑定為非結核分枝桿菌 (nontuberculous mycobacterium;NTM) 者9、因病況原因無法追蹤重新用藥後至少三個月以上。
三、重新投藥方式
本研究回溯有重新試藥的病人,我們分析醫師給藥的流程,將病人分為三種方式:第一組為依照英國胸腔科協會指引6,即劑量漸進再逐一加藥加量、第二組為依照美國胸腔科協會指引5,即一次給予病人足夠的劑量再逐一加藥;而在給藥的環節,若病人試藥採部分調整劑量,分類上無法歸為以上二組,即為研究的第三組。
參、結果
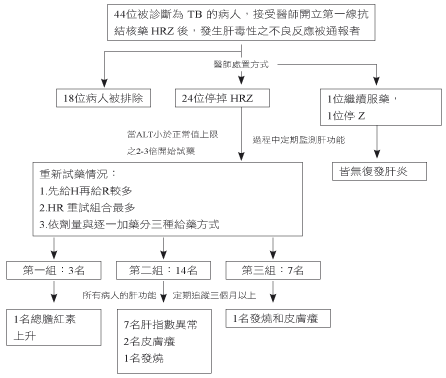
研究共44位服用抗結核藥品引起肝毒性被通報者,其中18位病人因條件不符而排除,排除原因為:病人無法追蹤到重新用藥後至少三個月有13人、曾經得過結核病者有4人、結核病治療期經菌種鑑定為非結核分枝桿菌 (nontuberculous mycobacterium;NTM) 有1人。在符合研究條件的26人,16位是男性,10位是女性,年齡範圍7-95歲 (平均56.88 ± 23.87歲)。
肝炎的定義是以病人無出現肝炎症狀,肝指數大於正常值的5倍;病人有症狀,肝指數大於正常值的3倍或總膽紅素大於正常值的2倍來表示。研究中有2位發生輕微肝功能異常的病人,並沒有馬上停止全部的抗結核藥而是持續追蹤;其他24位,醫師當下採立即停藥處置的情況分別:當血清轉胺酶大於3倍正常值上限,出現肝炎症狀者有7人,以及當血清轉胺酶大於5倍正常值上限者有17人。引用 Naranjo score 評估抗結核藥與發生肝毒性之相關性,結果「極有可能」佔21例,「可能」為5例。
26位被醫師診斷為結核病的新病人,首次接受 HRZ 發生肝炎時間,範圍8-64天 (平均為24.65 ± 17.68天),有70%病人是發生在服藥後一個月之內,AST/ALT/total bilirubin的平均尖峰值分別是401.68 ± 543.90 U/L/372.04 ± 360.71 U/L/1.88 ± 2.03 mg/dL。在發生肝炎時的處置如圖一,醫師依病人情況採取停用Z有1例、繼續原處方服藥有1例及停服 HRZ 有24例;前2例病人定期回診監測肝指數皆回復到正常值,另24位停藥的病人,研究發現當 ALT 回到正常值上限的2-3倍後開始重新投藥,平均約在停藥後17.92 ± 17.11天,如表一。
表一 依重新給藥方式定義三組病人的基本資料與臨床數據
參數 (24人) |
第一組 |
第二組 |
第三組 |
各組人數 |
3 |
14 |
7 |
性別 (人) |
女:1 男:2 |
女:6 男:8 |
女:2 男:5 |
年齡 |
76±20.13 |
54±22.85 |
60±25.92 |
得過B型病毒性肝炎 (人) |
1 |
1 |
0 |
得過C型病毒性肝炎 (人) |
0 |
2 |
0 |
得過B和C型病毒性肝炎 (人) |
0 |
0 |
0 |
惡性腫瘤 (人) |
0 |
1 |
0 |
肺外的結核病† (人) |
1 |
1 |
0 |
天門冬酸轉胺酶 (AST) 尖峰值 |
272.66±65.74 |
383.57±570.04 |
558.57±656.22 |
丙胺酸轉胺酶 (ALT) 尖峰值 |
237.67±189.62 |
409.78±393.85 |
379.85±392.08 |
總膽紅素 (total bilirubin) 尖峰值 |
1.36±0.40 |
1.50±1.40 |
3.11±3.22 |
服用抗結核藥品後,發生肝毒性的時間 (天數) |
17±7.94 |
24.92±16.78 |
23.14±19.00 |
發生肝毒性停藥後,間隔多久開始重試藥 (天數) |
9.33±3.06 |
25.64±18.86 |
11.28±11.54 |
病人試藥有投與Z者 |
0 |
6 |
3 |
發生肝炎有住院者 |
3 |
6 |
7 |
備註:
1.年齡、血清轉胺酶尖峰值、天數皆以平均值±標準差表示。
2.†為頸部淋巴節結核病、粟粒性結核。
3.第一組為劑量漸進再逐一加藥加量;第二組為一次給予病人足夠的劑量再逐一加藥;第三組為部分調整劑量。
圖一 納入研究的病人在抗結核藥發生肝毒性後的處理方式與重新試藥情況。ALT, alanine aminotransferase; R, rifampin; N,isoniazid; Z, pyrazinamide.
回溯重新試藥的24位病人,我們將病人依給藥情況分為三組討論,各組人數為第一組有3人、第二組有14人、第三組有7人。在這段時期,探究醫師依序加回抗結核藥品的組合中,先給 H 再給 R 為最多有15人 (60%),其次是先給 R 再給 H 有5人 (20%),如圖二。
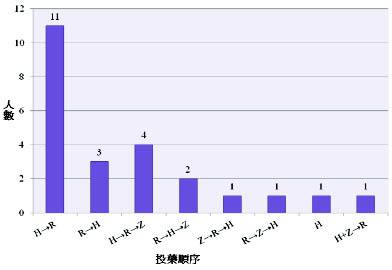
圖二 醫師重新試藥的順序呈現
分析24位重新服藥的過程發生副作用情況共14件,分別是肝指數異常有8件,藥物熱2件,皮膚癢3件,總膽紅素上升1件,發生肝毒性的件數上共9件,1人涵蓋2件對2種一線藥產生肝毒性,結果為8人 (32%) 對藥品復發肝炎,如圖三。
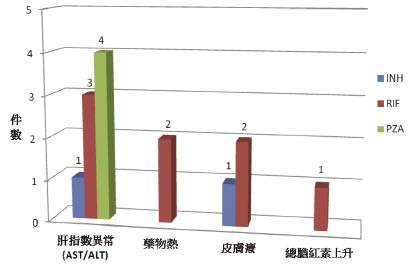
圖三 藥品重試失敗的原因
肆、討論
在過去的研究指出,年紀愈大 (大於35歲) 在結核病治療期間,是較易發生肝毒性的危險因子之一5,10。本研究的對象平均年齡為56.88 ± 23.87歲,年齡分布以中高齡為主,為高危險群。
在台灣結核病治療指引下,醫師治療新病人的優先處方:在起始期 (initial phase) 使用 H、R、Z 及 E 治療2個月,持續期 (continuation phase) 停用 Z 再治療4個月,能夠使結核病人完治率達95%7。抗結核的第一線藥品 H、R 及 Z 最常造成的副作用之一就是藥物性肝炎,當病人重新給予 H 及 R 成功之後,Z 就可能被醫師臆測為具有危險性,即使肝炎發生前使用 Z 小於2個月,病人也無尿酸指數過高 (標準上限13 mg/dL) 或關節痛症狀,此副作用非常明確地是由Z所造成,故醫師傾向不再加入 Z 於治療組合中,也使得以 HRE 組合治療方式,建議最少持續9個月1,5,11。對於本研究當 H 與 R 成功試藥的病人 (13位、52%) 有再給予 Z,只有3名,但只有1例是成功的加回,另2名因肝指數升高而失敗;何以 Z 在此病人未引發肝毒性?研究者認為可能採取劑量逐漸加回的方式1,3,6,7、或本身個體 (如年輕族群或沒有慢性肝病史) 在最初使用 HRZ 引發肝功能反應較輕微有關,Saukkonen 的假說支持這樣的再給予情況12,就是最初的肝毒性事件結果,可能使病人的身體在對抗結核藥產生一種肝適應狀況,如轉氨酶的升高,對病人反映屬於輕度的、或是抗結核藥對肝細胞和臟器沒有造成進行性的損傷,所以再次使用原來的藥品,可能比較少發生藥物性肝炎的情況。
我們觀察到醫師在試藥順序上並沒有限定何藥先後,但 Z 常是當病人逐一給予 H、R 之後,醫師看每位病人表現的試藥結果,再決定是否需重新加回;研究中有嘗試加回Z的病人全數9位 (36%),有5位為試藥成功 (55%),有4例 (45%) 失敗,失敗原因皆為肝指數異常,斟酌重試 Z 失敗比例高的情況下,我們認為服用 HRZ 發生肝毒性較嚴重者,不建議再重試時加回 Z。
回溯病人試藥大致分三組討論,第一組因年齡較大 (76.33 ± 20.13歲) 且發生肝炎時間最早 (17 ± 7.94天),推估醫師再次試藥時,採取最安全和保守的方式,也就是符合台灣結核病診治指引的小量漸進式給藥方式,結果有1位使用 R 致總膽紅素持續上升,就停止不再使用。第二組則因年齡較小 (54 ± 22.85歲),推估醫師重試藥時,採取較為積極的方式,即美國胸腔科學會建議,當肝指數回復到小於正常值上限的2倍,嘗試一次加一種藥,3-7天後如無肝毒性,再加另一種藥。該組病人嘗試給藥時間約在停藥後25.64 ± 18.86天,比平均值17.92 ± 17.11天來得長,結果7位肝指數異常,其中2位曾發生嚴重肝毒性 (ALT>10倍以上)2,但身體已耐受 HR 的重新投予,之後想縮短療程再加 Z,可是病人情況如文獻所知又發生嚴重的肝炎。研究者發現此組為三組中唯一有門診病人的組別,病人數過半,而門診為一週回診一次,病人遵循醫囑的困難度高,醫師重新給藥在控制與追蹤上不易,故該組重新試藥的天數較長,病人的穩定性也不佳。
探討第三組的病人,當發生肝毒性期間若有住院治療,醫師就能視病況方便調藥,而該組病人皆試藥成功沒有發生肝炎。原先服用 HRZ 出現肝指數和總膽紅素過高有3位病人,總膽紅素異常問題過去就被高度懷疑由 R 造成2,5,11,因此,當醫師後來一次加回H 的劑量成功,R 就從小劑量慢慢給,或是R 就被停用換成二線 Rifabutin 代替;另有1位病人嘗試 H、R 是一次加一種藥的足夠劑量後,對 R 發生肝毒性,但後來調整 R 從小量慢慢漸進嘗試,最後仍可成功加回。該組用藥方式並非採用台灣或美國的標準,考量是總膽紅素的數值,先給予 H,因 H 是抗結核藥品中具有最高的早期殺菌力,可以迅速減少體內結核菌量7,研究也注意到 H 是醫師試藥的第一順位,並且劑量上採取一次給足較常見。
伍、結論
結核病治療需使用多種的藥品組合,在發生肝毒性後,醫師重新試藥的方式之考量依據為病人年齡、肝功能狀態、住院與否,而給藥後若出現副作用,醫師會評估是由哪種藥品引起,並彈性調整配方或劑量。另一方面,若為門診病人,避免因副作用影響服藥意願,此時更需配合指示規則服藥,定期回診追蹤檢查,及時留意服藥後的反應,就能提高治療的成功率。
參考資料:
1. Tahaoglu K, Ataç G, Sevim T et al: The management of anti-tuberculosis drug-induced hepatotoxicity. Int J Tuberc Lung Dis 2001;5:65–69.
2. Tostmann A, Boeree MJ, Aarnoutse RE et al: Antituberculosis drug-induced hepatotoxicity: concise up-to-date review. J Gastroenterol Hepatol 2008;23:192-202.
3. Singh J, Garg PK, Tandon RK. Hepatotoxicity due to antituberculosis therapy: Clinical profile and reintroduction of therapy. J Clin Gastroenterol 1996;22:211-4.
4. Sharma SK, Singla R, Sarda P et al: Safety of 3 different reintroduction regimens of antituberculosis drugs after development of antituberculosis treatment-induced hepatotoxicity. Clin Infect Dis 2010;50:833-9.
5. American Thoracic Society Hepatotoxicity of Antituberculosis Therapy Subcommittee. An official ATS statement: hepatotoxicity of antituberculosis therapy. Am J Respir Crit Care Med 2006 Mar 15;174(8):935-52.
6. Joint Tuberculosis Committee of the British Thoracic Society. Chemotherapy and management of tuberculosis in the United Kingdom: recommendations. Thorax 1998;53:536–548.
7. 行政院衛生署疾病管制局出版「結核病診治指引」第四版 http://www2.cdc.gov.tw/ct.asp?xItem=33699&ctNode=78&mp=1
8. Naranjo CA, Busto U, Sellers EM et al: A method for estimating the probability of adverse drug reaction. Clin Pharmacol Ther 1981;30:239-45.
9. Medical Section of the American Lung Association. Diagnosis and treatment of disease caused by nontuberculous mycobacteria. Am J Respir Crit Care Med 1997;156:S1-25.
10. Pande, J. Singh, S. Khilnani, G. Tandon, R. Risk factors for hepatotoxicity from antituberculosis drugs: a case-control study. Thorax 1996 February;51(2):132–136.
11. Thompson N P, Caplin M E, Hamilton M I. Antituberculosis medication and the liver: dangers and recommendationsin management. Eur Respir J 1995;8:1384–1388.
12. Jussi Saukkonen. Challenges in Reintroducing Tuberculosis Medications after Hepatotoxicity. Clinical Infectious Diseases 2010;50:840–842.
Reintroduction of Regimens after Hepatoxicity Caused by Antituberculosis Therapy
Liu Chin-Feng, Wang Ching-Chin, Xiao Hui-Juan, Tsao Hui-Liang, Liao Fen-Fen
Department of Pharmacy, Kaohsiung Medical University Hospital
Abstract
First-line anti-tuberculosis (anti-TB) drugs contain isoniazid (H), rifampicin (R), and pyrazinamide (Z). However H, R, Z each is accompanied by different degrees of hepatotoxicity. The reintroduction of anti-TB drugs to patients who have developed drug-induced hepatitis (DIH) is controversial.
This is a retrospective study on patients who are diagnosed with anti-TB DIH, starting from 2005 to 2010. We checked the patients’ liver functions and then analyzed the strategy-result of reintroduction regimens.26 cases with anti-TB DIH were assessed as eligible for this study, the process of the reintroduction goes as follows: up to 15 (60%) of the patients restarted with H and then R, while only 20% (5) of the patients used R first and then took H. However, DIH recurred 5 among of them. Also, we found 9 of the patients who had rechallenged with Z, 5 patients (55%) successed after the reintroduction. Lastly, our analysis shows that the treatment of the other 4 patients (45%) failed because of the recurrence of DIH.
The recurrence rate among those who were rechallenged with Z, on the other hand, was high. Therefore we suggest that the patients who have serious liver toxicity after taking HRZ should not use Z-adding when rechallenged.

