摘要
近10年癌症的治療發展仍是以標靶治療為主流,由於生物技術和癌症生物學的進步而引入癌症個人化治療的概念。腫瘤的個人化用藥,包括使用生物標記檢測,可當做選擇最佳標靶藥物的治療目標。預測性的生物標記可識別最有可能從治療中獲益的患者族群。以肺癌的治療而言,病理分類必須在很小的標的上進行許多檢測,包括以免疫組織化學染色 (IHC)、直接定序或是 Scorpion ARMS 等方式偵測上皮生長因子 (EGFR) 突變;若 EGFR 有突變可考慮使用 gefitnib 等標靶治療藥品;若 EGFR 沒有突變,接著以 IHC、RT-PCR 或 FISH 等方分子診斷式檢測變性淋巴瘤激酶 (EML4-ALK) 變異;若 EML4-ALK 有變異可考慮使用 crizotinib;若 EML4-ALK 沒有變異則需檢測 KARS 突變,再根據整體的檢測結果提供不同的個別治療建議。
關鍵字:crizotinib、EGFR、EML4-ALK、標靶治療、分子病理檢測
壹、前言
隨著突變位點的腫瘤標靶治療發展,一些治療非小細胞肺癌的新藥,例如 gefitinib、erlotinib、afatinib 以及目前在台灣已被核准的新藥 crizotinib,可用於治療局部晚期或轉移性非小細胞肺癌 non-small cell lung cancer (NSCLC)。而使用輔助診斷檢測 (即生物標記檢測) 可辨識那些最有可能從治療中獲益的病人亞族群,目前是癌症臨床治療的一大進展1。
貳、肺癌組織學分類
病理學依組織學 (圖一) 將肺癌分成非小細胞肺癌 (NSCLC) 及小細胞肺癌 (SCLC) 兩大類分別佔所有肺癌的80-85%和15-20%。非小細胞肺癌 (NSCLC) 另外依型態分類分為鱗狀細胞癌及非鱗狀細胞癌,其中非鱗狀細胞癌非小細胞肺癌又細分為腺癌、大細胞癌或其他非小細胞肺癌類型。大細胞癌又分類為大細胞神經內分泌癌 (large cell neuroendocrine carcinoma) 和其他大細胞癌。小細胞癌及少數的典型/非典型類癌腫瘤 (carcinoid tumors) 與大細胞神經內分泌癌,在治療的分類皆歸納為神經內分泌腫瘤 (neuroendocrine tumors) 類型。目前臨床上的治療角度較為合理的分類。
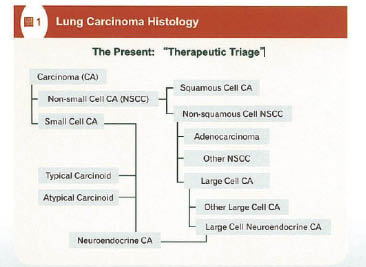
圖一 肺癌組織學分類
參、肺癌之病理學診斷
腫瘤的標本會來自外科的器官切片及內科的組織切片,以及細針穿刺、灌洗液、肋膜積水等細胞學標本。然而晚期非小細胞肺癌患者的檢體量都是以小而少的量進行病理診斷。對於臨床上的病理診斷,必須配合免疫組織化學染色 (immunohistochemistry,IHC) 及分子診斷資訊來提供臨床用藥的參考。
新的 IASLC (International Association for the Study of Lung Cancer) 分類指出,未明確分類的非小細胞肺癌 (not otherwise specified) 應該要進行免疫染色或 mucin stain,以進一步區分是否為鱗狀細胞癌或其他型態;若是仍無法區分時,則建議進行分子診斷,有助於病理分類以及提供臨床用藥參考。因此,特殊染色、免疫組織化學染色和分子病理對於肺癌病理診斷是相當重要。即使在相同組織學診斷的病人之間,上皮生長因子接受器 EGFR、EML4-ALK、KRAS 或其他項目的分子診斷檢測,區分出不同的基因變異 (圖二)。便可在治療上根據不同的基因變異提供不同的標靶治療2。
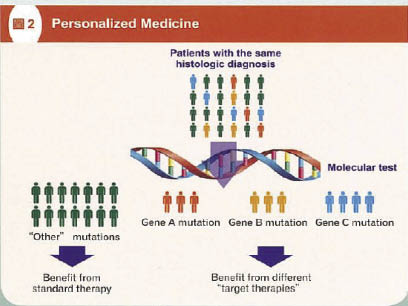
圖二 個人化醫療
肆、肺癌之分子診斷
肺腺癌在非小細胞肺癌中佔了70%以上,在肺腺癌的分子診斷中目前最常使用的標的包括 EGFR (epidermal growth factor receptor) 以及將被納入檢測的 EML4-ALK;將來還會發展鱗狀細胞癌的分子診斷。
伍、EGFR
在2004年 NEJM (New England Journal of Medicine) 發表的研究對 EGFR 就已經有清楚的機轉描述,當病人之 EGFR 發生突變時,會改變標靶藥物與接受器的親合力,進而影響藥物的作用。所以預測病人對於 EGFR TKI (tyrosine kinase inhibitor) 是否會有反應,最重要的還是檢測病人是否具有 EGFR 突變3。
在 EGFR 的分子診斷方面,基於檢測標本中癌細胞及組織細胞的異質性,通常會以顯微切割 (microdissection) 取得切片中癌細胞比例較高的區域來進行分子檢測,(圖三)。
有許多方法可以檢測 EGFR 的突變,目前最常用的方法是直接定序法 (direct sequencing),也有醫院使用 Scorpion ARMS (Amplified Refractory Mutation System、TaqMan PCR (polymerase chain reaction)、及 PNA- LNA PCR clamp 等方法。直接定序法其優點是可以偵測到新的突變點,但缺點是敏感度相對較低;然而,對於其他敏感性較高的檢測方法,因受限於引子 (primer) 的設計,只能偵測到已知的 EGFR 突變型。其中,使用 Scorpion ARMS 這個敏感性高的檢測法,特別設計的 primer 己可偵測出20多種的突變型別。簡而言之,若是單純要進行檢測,建議使用敏感度高的檢測方法如 Scorpion ARMS;若是要研究未知的突變點,則建議使用直接定序法。此外,免疫染色也是未來可發展的檢測法,主要是因為檢測方便以及成本上的優勢,目前常用的 L858R 和 Exon19 del 抗體便佔了所有已知突變的50%以上,若和直接定序法的結果進行比較,此方法具有相當高的專一性,但若要運用到臨床上,還需要更多的臨床數據證實4。
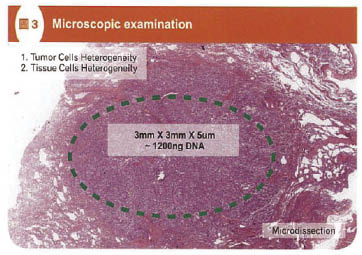
圖三 顯微鏡病理組織鏡檢
陸、EML4-ALK 融合蛋白
擁有變形淋巴瀏激酶 (EML4-ALK) 融合蛋白變異,病人在臨床的特徵包括年輕、不吸菸、EGFR/KARS 沒有突變等,但目前仍缺乏確切的標準。研究顯示,EML4-ALK (echinoderm microtubule-associated protein-like 4,anaplastic lymphoma kinase) 融合蛋白變異較為複雜,這也是偵測上困難的地方,目前臨床研究是以 FISH (fluorescence in situ hybridization) 作為偵測標準;除此之外,使用 RT-PCR (reverse transcription polymerase chain reaction) 進行放大後再直接定序或是免疫染色也都是檢測 EML4-ALK 融合蛋白變異的方法5。
柒、Crizotinib 臨床研究證據
ALK (anaplastic lymphoma kinase) 的染色體重排與 crizotinib 之臨床反應習習相關。因此學者進行全球性第 III 期臨床試驗 PROFILE 1007,自2010年2月到2012年2月間,納入347名罹患第 IIIB/IV 期 ALK 陽性、且先前接受過以 cisplatin 為基礎的療程之 NSCLC 病人;而後將之隨機分配至以下二治療組:crizotinib 250 mg PO BID (C組,n = 173);或是以 pemetrexed 500 mg/m2或 docetaxel 75 mg/m2 IV q3w 治療 (P/D 組,n = 174;58% P, 42% D)。本研究設立中央實驗室,以 FISH 法檢測 ALK。P/D 組疾病惡化者可進入 PROFILE 1005試驗,轉為接受 crizotinib 治療。
結果發現,C組與 P/D 組相比,PFS (Progress-Free Survival) 確實顯著增加;中位時間分別為7.7和3.0個月 (P < 0.0001)(圖四)。C組之客觀反應率 (objective response rate, ORR) 亦明顯較高 (65% vs. 20%, P < 0.0001)。期中分析時二組之 OS (Overall Survival) 並未有顯著的差別,但此時資料尚未依療程轉換 (182 名 P/D 組病人轉為接受 crizotinib) 而校正。與治療相關的不良反應,在C組最常見為視覺異常 (59%)、腹瀉 (53%)、噁心 (52%)、嘔吐 (44%) 及 transaminases 升高 (36%);在 P/D 組則為噁心 (35%)、倦怠 (29%)、嗜中性白血球低下 (22%)、食慾減退 (21%) 及落髮 (20%)。二組與治療相關的第3、4級不良反應發生率均為31%;因而造成停藥的比例則分別為6%和10%。C組之治療時間亦較 P/D 組長,中位治療週期分別為11和4。總結上述研究成果,crizotinib 用於治療晚期 ALK(+) NSCLC 患者,其 PFS 和 ORR 皆優於現行標準化療,而且具有良好的安全性及耐受性6。
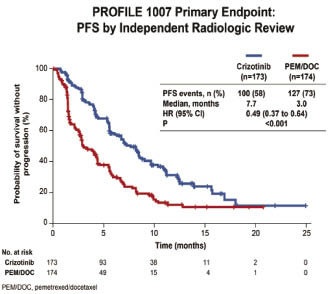
圖四 第 III 期臨床試驗 PROFILE 比較分析
捌、總結
NSCLC 病人中約有1%-7%的病人有 ALK 基因異常,這種類型這種類型的肺癌病人通常是非吸煙者。Crizotinib 是 FDA 批准的 ALK(+)抑制劑,適用於有局部晚期或轉移非小細胞肺癌 (NSCLC) 患者,crizotinib 通過阻斷激酶來抑制由異常 ALK 基因所產生的蛋白。Gefitinib 和 erlotinib 是小分子的表皮生長因子受體 (EGFR) 抑制劑,在臨床試驗中,大部分對 gefitinib 治療有反應的患者在其腫瘤中都有 EGFR 突變。許多研究顯示肺癌的基因突變與對藥物的反應是相關的。Crizotinib 為變性淋巴瘤激酶 (ALK) 抑制劑,經過輔助診斷檢測選出 ALK 陽性患者,可過濾 ALK 陰性患者的來節省治療成本,作為一個 FDA 批准的測試檢測。將治療與生物標記檢測資料結合來作預測,是個人化治療的策略。這種新穎的輔助診斷檢測法,可以鑒別出最有可能從治療中獲益的非小細胞肺癌患者。
參考資料:
1. Kerr KM, et al: Personalized medicine for lung cancer: new challenges for pathology. Histopathology. 2012 Mar; 60(4): 531-46.
2. Tanner NT, Pastis NJ, Sherman C, et al: The role of molecular analyses in the era of personalized therapy for advanced NSCLC. Lung Cancer. 2012 May; 76(2): 131-7.
3. Yauch RL, Settleman J. Recent advances in pathway-targeted cancer drug therapies emerging from cancer genome analysis. Curr Opin Genet Dev. 2012 Feb; 22(1):45-9.
4. Ong FS, Das K, Wang J, et al: Personalized medicine and pharmacogenetic biomarkers: progress in molecular oncology testing. Expert Rev Mol Diagn. 2012 Jul;12(6):593-602.
5. Shaw AT, et al: ESMO 2012 Vienna, Austria. Abstract LBA1_PR.
Crizotinib and Molecular Pathology for Lung Cancer Target Therapy
Hui-Ti Sung1, Yi-Ping Hsiang1, Chia-Che Wu2
Department of Pharmacy, Kaohsiung Chang Gung Memorial Hospital1
Division of Hematology and Oncology, Kaohsiung Chang Gung Memorial Hospital2
Abstract
Targeted therapy has been the state-of-the-art treatment for lung cancer in the last decade. The progress in biotechnology and knowledge of cancer biology has led us to the concept of personalized medicine in oncology. The molecular testing for biomarkers is critical in selecting the optimal therapeutic targets for targeted cancer therapy; prediction biomarkers help screen out the patient populations that are most responding to the targeted therapy. Taking lung cancer treatment as an example, a series of molecular tests can be performed on a small piece of biopsy tissue, including immunohistochemistry, direct sequencing, or Scorpion-ARMS real-time PCR for EGFR mutations. When the testing for EGFR mutation is negative, the immunohistochemistry, reverse-transcription PCR or fluorescence in situ hybridization tests for EML4-ALK translocations will be applied. K-ras mutation analysis will follow if the testing for EGFR mutation and ALK translocation is negative. The management for lung cancer will be evaluated when comprehensive molecular information has been documented.

