摘要
肺癌在台灣是主要的癌症死亡原因。約有85%的肺癌為非小細胞肺癌 (non-small cell lung cancer,NSCLC),其常在晚期才被診斷出來,若以傳統第一線化學治療,療效反應率約僅20%,病人整體存活率之中位數為8-11月。NSCLC 病人約有40-80%會有表皮細胞生長因子接受器 (epidermal growth factor receptor,EGFR) 過度表現,導致癌症的快速生長、轉移與抗藥性。如能使用表皮細胞生長因子接收器-酪胺酸激酶抑制劑 (epidermal growth factor receptor-tyrosine kinase inhibitors,EGFR-TKIs),則可抑制肺癌細胞的增生。NSCLC 的 EGFR 有幾種基因型 (如 kinase domain exon 18-21、T790M) 的變異,使治療肺癌藥品的發展,由可逆性的第一代 EGFR-TKIs (gefitinib、erlotinib) 進展至不可逆性的第二代 EGFR-TKIs (afatinib),這些藥品的上市讓肺癌有新的治療選擇。
關鍵字: 非小細胞肺癌、表皮細胞生長因子接收器-酪胺酸激酶抑制劑、non-small cell cancer、NSCLC、epidermal growth factor receptor-tyrosine kinase inhibitors、EGFR-TKIs
壹、前言
近年來,肺癌已成為癌症死亡原因,而非小細胞肺癌 (non-small cell lung cancer,NSCLC) 在肺癌中約佔85%以上,且常在晚期才被診斷出來。若以傳統第一線以鉑 (platinum) 為主之化學治療,例如:pemetrexed 加上 cisplatin 的治療效果不佳,療效反應率僅約20%,病人整體中值存活期 (overall survival,OS) 約8-11月1,在亞洲人的 NSCLC 約有50%會發生突變,常發生 EGFR 活化突變,突變的位置以 exon 19與 exon 21 (L858R) 佔突變中90%,故標的在 EGFR 也成為 NSCLC 重要的策略之ㄧ1,所以在1980s 年第一代抗 EGFR 藥品上市成為晚期 NSCLC 之口服標靶藥品,是表皮細胞生長因子接收器-酪胺酸激酶抑制劑 (epidermal growth factor receptor-tyrosine kinase inhibitor,EGFR-TKIs),包括有 gefitinib、erlotinib。而 EGFR 的 kinase domain exon 18-21有突變的病人對 EGFR-TKIs 的反應較好,治療反應率約60%到85%。對有 T790M 突變,k-ras 突變,或 MET 活化的癌細胞對 EGFR-TKIs 有效的機率極低。所以第二代不可逆 EGFR-TKIs afatinib 的發展改善了第一代 EGFR-TKIs 的抗藥性的問題,afatinib 也比 gefitinib 或 erlotinib 更廣泛的阻斷 ErbB 家族,除了 EGFR (ErbB1) 外,更增加了 HER2 (ErbB2) 和 HER4 (ErbB4) 等治療標的,讓肺癌病人的治療有了新的選擇。最近幾年 NSCLC 已有幾種組織型態之基因型的變異,也使得肺癌治療有別於傳統標準治療,不再是一種療法適用於全部的人,已走入個人量身化的治療時代,未來必須利用許多分子方法來檢測 NSCLC 基因型,專一性的用藥,可提高 NSCLC 病人之無疾病進展存活期 (progression-free survival, PFS)、OS 以及生活品質。本文將會針對 EGFR-TKIs 用於晚期 NSCLC 的角色並做文獻回顧與整理。
貳、EGFR-TK 訊息傳遞
EGFR 又稱人類表皮細胞生長因子受體1 (human epidermal growth factor receptor 1,HER1) 是此路徑起始的一個重要的跨膜 tyrosine kinase 受體。當表皮生長因子 (epidermal growth factor) 或轉形生長因子 (transforming growth factor-alpha) 結合到 EGFR 時,受體會形成雙聚體 (dimer),會導致 tyrosine kinase 的催化區自我磷酸化 (autophosphorylation),同時細胞內進行一連串的訊息傳遞路徑來維持細胞的增生與存活2。其中 MAPK 路徑會促進細胞增生、PI3K 和 STAT 路徑會讓細胞生長、凋亡與存活。但當 EGFR 發生活化性的突變時,EGFR 受體不需外界配體的刺激即可與 erbB3形成雙聚體,因如此而磷酸化的 erbB3活化 PI3K 傳遞路徑,使得有 EGFR 突變的細胞較能存活。能活化 EGFR 的突變大多發生在 tyrosine kianse exon 18-21。EGFR-TKIs 可阻斷而使 erbB3不被突變之 EGFR 所磷酸化,則腫瘤細胞無法複製則產生凋亡,TKIs 與細胞內催化區之 ATP (adenosine triphosphate) 競爭受體,因此阻止了 ATP 與受體結合後的自動磷酸化,因此 PI3K 路徑不再活化。在亞洲人 EGFR 突變之發生率高達50%,所以使用 EGFR-TKIs 的治療可使病人有較佳的預後及治療的敏感度。
參、 第一代 EGFR-TKIs (Gefitinib、Erlotinib)
2004年開始有許多的 EGFR 突變被發現,大部分的突變發生在 exon 19與exon 21,其他的突變位置則為 exon 20、G719X、T790M3,但仍有一些特徵是與 EGFR 突變有相關性,如抽菸與否、女性、腺癌等4。在一些未篩選的病人可發現 EGFR 突變的比例,如腺癌 (40% vs. 3%其他組織型態)、亞洲人 (30% vs. 8%非亞洲人)、女性 (42% vs. 14%男性) 及未抽菸 (51% vs. 10%曾抽煙)。然而,將 EGFR-TKIs 加入以第一線化學治療非選擇性的 NSCLC 病人,並未觀察到有治療效益,在這些病人中又以未抽菸者有較好的存活效益。據此觀察,後來的研究都以 EGFR-TKIs 對特殊族群 (未抽菸、EGFR 突變肺腺癌) 的療效做評估5。
Gefitinib 的療效在 IPASS (Iressa Pan-Asian Study) 研究中得到證實,共收納1,217晚期肺腺癌、未吸煙或少吸菸的亞洲人,隨機分派至 gefitinib 或 carboplatin/paclitaxel (CP) 作第一線治療。結果顯示,PFS 於使用 gefitinib 的病人效果比 CP 組較好 (12個月無疾病進展存活期 24.9% vs. 6.7%,疾病惡化 Hazard Ratio (HR) 0.74,95% Confidence Interval (95% CI) 0.65-0.85),而在 OS 則無統計上的差異 (中值存活期18.8 個月vs. 17.4 個月,死亡 HR 0.90,95% CI 0.79-1.02)6。
Gefitinib 用於 EGFR 突變也有療效,在此試驗中,有437個病人以生物標記方式分析 EGFR 突變狀態,發現437個病人中約有60%有 EGFR 突變,當中96%不是在 exon 19就是在 exon 21 L858R 位置發生突變。Gefitinib 組比 CP 組,PFS 在 gefitinib 組明顯延長 (中值存活期9.5個月vs. 6.3 個月, 疾病惡化 HR 0.48,95% CI 0.36-0.64),但 OS 沒有明顯增加,用於沒有 EGFR 突變的病人 gefitinib 效果比 CP 差 (中值生存期1.5個月 vs. 6.5個月, 疾病惡化 HR 2.85,95% CI 2.05-3.95),但兩組 OS 也無統計上的意義 (中值存活期11.2 個月vs.12.7個月,死亡 HR 1.18)6。
Erlotinib 的作用機轉和 gefitinib 相同,也對 EGFR 突變者特別有效。在 OPTIMAL 臨床試驗,收納了154位中國病人,隨機分派至 erlotinib 與 gemcitabine/carboplatin (GC),PFS 在 erlotinib 組病人明顯比 GC 組較長 (13.1個月 vs. 4.6個月,疾病惡化 HR 0.16,95% CI 0.10-0.26)7。目前 gefitinib 與 erlotinib 已成為第一線治療晚期 NSCLC 以及 EGFR 過度活化或者突變者。
肆、EGFR-TKIs 抗藥性
雖然第一代 EGFR-TKIs 已被證實對 NSCLC 有不錯療效,但仍有30%病人對第一代 EGFR-TKIs 產生抗藥性,目前對造成抗藥性的原因並不清楚,推測與繼發性 EGFR 突變與 MET 致癌基因的擴增有關。繼發性EGFR 突變最見常為在790位置 (T790M) 以 methionine 取代 threonine,進而造成 EGFR 的構形改變而產生抗藥性;MET 致癌基因的擴增 (amplification),也會造成 EGFR-TKs (gefitinib,erlotinib) 約5-20%的抗藥性,有些 MET 致癌基因擴增的病人也同樣有繼發性 T790M 突變8,所以目前 afatinib 的上市改善了第一代藥品抗藥性的問題。
伍、第二代 EGFR-TKIs (Afatinib)
Afatinib 可以向下調節 ErbB 的訊息傳遞,藉由在 EGFR,HER2,HER4 kinase domains 不可逆共價結合,導致不可逆地抑制 tyrosine kinase 自我磷酸化。也可阻斷 HER3磷酸化轉移,導致細胞內訊息無法傳遞,進而抑制腫瘤生長或使腫瘤消退。由於共價結合的因素,讓第二代 EGFR-TKIs 比第一代更具對抗 T790M 突變或其他的突變活性。
在2014年 American Society of Clinical Oncology (ASCO) 會議中,報導了將兩個第三期試驗 LUX-Lung 3及 LUX-Lung 6的資料合併分析後的結果,共631的病人,在 afatinib 組與化學治療組相比整體存活率的中位數顯著增加27 vs. 24個月,HR 0.81,95% CI 0.66-0.999。在突變次分組分析,exon 19 缺損的病人中,PFS 與 OS 在 afatinib 組都有顯著改善,但在 L858R 突變組中,雖然 PFS 在 afatinib 組都有顯著改善 (3.3個月vs. 1.1個月,P < 0.0001),但 OS 則無顯著差異10。因此美國 FDA 在2013年7月核准 afatinib 上市,適用於在 exon 19基因缺陷或 exon 21 (L858R) 位置發生突變之非小細胞肺癌病人。目前台灣所核准之適應症為『適用於具有 EGFR-TK 突變之局部晚期或轉移性之非小細胞肺癌 (NSCLC) 患者之第一線治療』,afatinib 與其他兩種 EGFR-TKIs 的比較及療效研究 (表一~二)。在 LUX-Lung 1研究 afatinib 用於第一或二線治療失敗且又以 erlotinib/gefitinib 治療12週產生疾病惡化的晚期 NSCLC 的療效,Afatinib 的中位數 PFS 比安慰劑顯著延長,但兩者在 OS 並無顯著差異11。
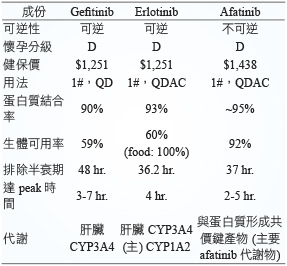
表一 Afatinib、erlotinib 及 gefitinib 的比較13
表二 第一線使用 gefitinib、erlotinib、afatinib 治療 NSCLC 的研究1,5,11
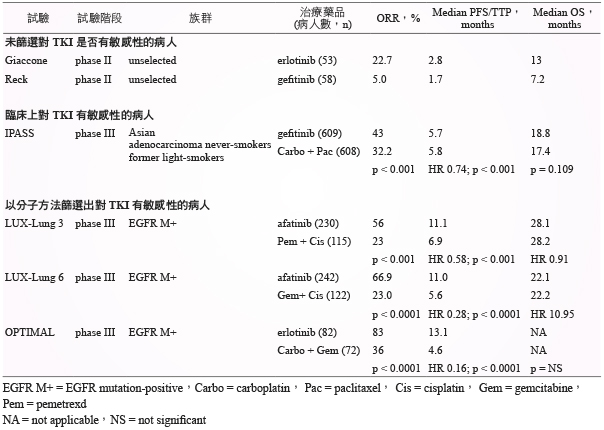
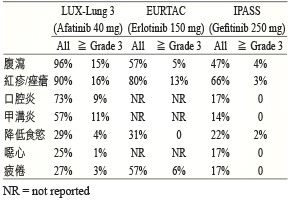
因目前並未有針對 EGFR-TKIs 之間療效作用 head to head 比較的研究;但在一個統合分析研究比較 EGFR-TKIs 用於晚期 NSCLC 且有 EGFR 活化突變的病人,此研究收納8個隨機第三期臨床試驗,gefitinib、erlotinib、afatinib 分別與化學治療比較其 PFS 與 OS 皆有顯著差異,然而比較 erlotinib 與 gefitinib、afatinib 與 gefitinib、erlotinib 與 afatinib 其 PFS 與 OS 則無顯著差異12。副作用方面,EGFR-TKIs 的副作用差異不大,常見為腹瀉、紅疹、口腔炎、甲溝炎及皮膚乾躁,其中以 afatinib 發生比例為最高 (表三)。
表三 Afatinib、 erlotinib 及 gefitinib 常見副作用發生與 ≧ Grade 3比例比較10
陸、結論
許多研究顯示 EGFR 活化突變若使用 EGFR-TKIs 的 PFS、OS 及病人生活品質皆比化學療法好,儘管可以依臨床判斷推測是否有 EGFR 突變 (未抽菸、女性、腺癌、亞洲人),但仍建議在新診斷為第四期 NSCLC 的病人應先依腫瘤的分子與組織學特徵,並且檢測腫瘤組織 EGFR 突變。如在基因檢測前,病人可接受化學治療者,則先以化學治療為優先,當有基因檢測報告結果再依結果決定治療方式 (圖一)。根據基因檢測結果選擇藥品作治療,若檢測結果 EGFR 未發生突變,則以化學治療為優先;若檢測結果 EGFR 發生突變,又可依據突變位置做藥品的選擇,如在 exon 19與 exon 21發生突變可選擇 gefitinib 或 erlotinib 治療,gefitinib 用於無抽菸、女性、腺癌及亞洲人療效較佳;而 erlotinib 用於抽菸、男性及非腺癌較具療效;待 gefitinib 或 erlotinib 治療治療失敗後或突變位置在 exon 20則可改用 afatinib。當病人已使用化學療法,可待疾病惡化時,再開始給予標靶治療。
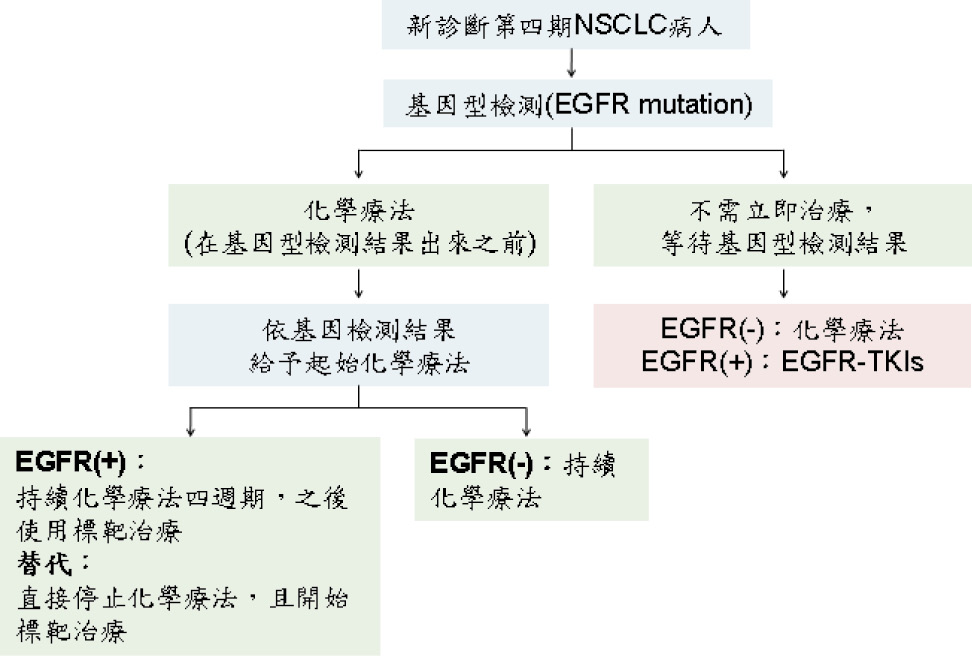
圖一 新診斷為晚期 NSCLC 治療方式14
Treatment of EGFR-TKIs in Non-Small Cell Lung Cancer
Tzu-Rong Peng, Ming-Chia Lee, Ta-Wei Wu
Department of Pharmacy, Taipei Tzu Chi Hospital
Abstract
Lung cancer is the major cause of all cancer-related deaths in Taiwan. Non-small cell cancer (NSCLC), the most common type, comprising 85% of lung cancer is usually diagnosed at advanced stages. The response rate is only 20%, with median survival of 8 to 11 months even if the first line chemotherapy administrated. The epidermal growth factor receptor (EGFR) family members seem to play a critical role in lung tumourigenesis, metastasis, drug resistant and are overexpressed in 40-80% of NSCLC. Epidermal growth factor receptor-tyrosine kinase inhibitors (EGFR-TKIs) seem to be an effective therapy for inhibiting the growth of cancer cells. Several mutations have been identified in NSCLC, including kinase domain exon 18-21 and T790M. The development of drugs for lung cancer therapy has gone from the first-generation characterized by reversibility of EGFR-TKIs to second-generation as of irreversibility of EGFR-TKIs. And the induction of these drugs has provided new choices for the lung cancer treatment.
參考資料:
1.Keating GM: Afatinib: A review of its use in the treatment of advanced non-small cell lung cancer. Drugs 2014;74(2):207-21.
2. Thariat J, Milas L, Ang K: Integrating radiotherapy with EGFR antagonists and other molecular therapeutics for the treatment of head and neck cancer. Int J Radiat Oncol Biol Phys 2007;15: 974-984.
3. Rosell R, Moran T, Queralt C, et al: Screening for epidermal growth factor receptor mutations in lung cancer. N Engl J Med 2009;361(10):958-967.
4. Nguyen KS, Neal JW, et al: First-line treatment of EGFR-mutant non-small-cell lung cancer: the role of erlotinib and other tyrosine kinase inhibitors. Biologics 2012;6:337-45.
5. Köhler J, Schuler M: Afatinib, Erlotinib and Gefitinib in the First-Line Therapy of EGFR Mutation-Positive Lung Adenocarcinoma: A Review Onkologie 2013;36:510–518.
6. Fukuoka M, Wu YL, Thongprasert S, et al: Biomarker analyses and final overall survival results from a phase III, randomized, open-label, first-line study of gefitinib versus carboplatin/paclitaxel in clinically selected patients with advanced non-small-cell lung cancer in Asia (IPASS). J Clin Oncol 2011;29(21):2866-74.
7. Zhou C, Wu YL, Chen G, et al: Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer (OPTIMAL, CTONG-0802): a multicentre, open-label, randomized, phase 3 study. Lancet Oncol 2011;12(8):735-42.
8. Bean J, Brennan C, Shih JY, et al: MET amplification occurs with or without T790M mutations in EGFR mutant lung tumors with acquired resistance to gefitinib or erlotinib. Proc Natl Acad Sci U S A. 2007;104(52):20932-7.
9. Yang JC, Sequist LV, Schuler MH, et al: Overall survival (OS) in patients (pts) with advanced non-small cell lung cancer (NSCLC) harboring common (Del19/L858R) epidermal growth factor receptor mutations (EGFR mut): Pooled analysis of two large open-label phase III studies (LUX-Lung 3 and LUX-Lung 6 ) comparing afatinib with chemotherapy (CT). 2014 American Society of Clinical Oncology (ASCO) meeting.
10. D'Arcangelo M, Hirsch F R: Clinical and comparative utility of afatinib in non-small cell lung cancer. Biologics 2014;8:183-92.
11. Genova C, Rijavec E, Barletta G, et al: Afatinib for the treatment of advanced non-small-cell lung cancer. Expert Opin Pharmacother 2014;15(6):889-903.
12. Haaland B, Tan PS, de Castro G Jr, et al: Meta-analysis of first-line therapies in advanced non-small-cell lung cancer harboring EGFR-activating mutations. J Thorac Oncol 2014;9(6):805-11.
13. Peters S, Zimmermann S, Adjei AA: Oral epidermal growth factor receptor tyrosine kinase inhibitors for the treatment of non-small cell lung cancer: Comparative pharmacokinetics and drug-drug interactions. Cancer Treatment Reviews 2014;40: 917-926.
14. Lilenbaum RC: Systemic therapy for advanced non-small cell lung cancer. with an activating mutation in the epidermal growth factor receptor. In: UpToDate, Post TW (Ed), UpToDate, Waltham, MA. (Accessed on 2014)

