摘要
骨髓增生不良症候群 (myelodysplastic syndrome, 簡稱 MDS) 是最常見的罕見血液疾病,好發於老年人 (≧ 65歲),男性居多。此病常併有 DNA 的不正常甲基化,導致骨髓產生無功能的血液細胞。MDS 早期的臨床症狀是貧血,接著血小板及白血球也會減少。臨床上 MDS 預後大多採用 IPSS 分數來評估。MDS 根據病情和病人狀況,可給予輸血、施打 azacitidine (或 decitabine) 或是進行異體幹細胞移植的處置。對於具有單純5q 缺乏 (deletion) 的染色體異常者,可選擇 lenalidomide。大部分 MDS 病人藉由支持性療法 (例如輸注紅血球、血小板) 就可存活十年以上。長期輸血要注意鐵質沉積問題,必要時應給予排鐵劑。MDS 的藥物治療中,在台灣具有衛福部核准適應症和健保給付的只有 azacitidine。
關鍵字: 骨髓增生不良症候群、myelodysplastic syndrome(MDS)、azacitidine、decitabine、lenalidomide
壹、簡介1
骨髓增生不良症候群,是發生於骨髓的一種惡性造血疾病,使得骨髓產生無功能的血液細胞,導致紅血球、血小板及白血球減少。大部份 MDS 病人會出現貧血的症狀,感染及出血風險也會提高。一旦 MDS 發展成急性骨髓性白血病 (acute myelocytic leukemia, AML),其治療則會變得相當棘手。
貳、病因1
MDS 的致病機轉未明。此病常併
DNA (去氧核甘酸) 的不正常甲基化 (methylation),使得促進細胞分化及成熟之基因無法正常表現。病因可為原發性或是繼發性 (例如之前曾使用過化療藥物)。
參、流行病學
MDS 好發於老年人 (≧ 65歲),男性居多。除了因之前使用化療藥物引起 MDS 外,50歲前發病是少見的;也有少數的孩童病例報告1。MDS 的發生率以台灣在民國100年癌症登記報告來看,每十萬人中有約225人發生 MDS (男性143人,女性82人)2。
肆、分類3-5
MDS 有國際世界衛生組織 (WHO;World Health Organization) 及法美英共識 (FAB;French-American-British) 兩種分類系統 (表一、表二)。這兩個系統大致上相類似,兩者皆以骨髓芽細胞 (myeloblast) 所佔比例的多寡來作為 MDS 進程的主要依據。隨著疾病的惡化,骨髓芽細胞之百分比會上升。兩者最大的差別是 FAB 系統界定骨髓芽細胞在30%內是屬於 MDS 範疇,一旦大於30%則歸類為 AML。然而,WHO 系統則界定骨髓芽細胞 ≧ 20%時即屬於 AML。台灣健保給付 azacitidine 的標準是根據 FAB 分類 (見本文藥物治療部份)。
表一 WHO 系統對 MDS 的分類3
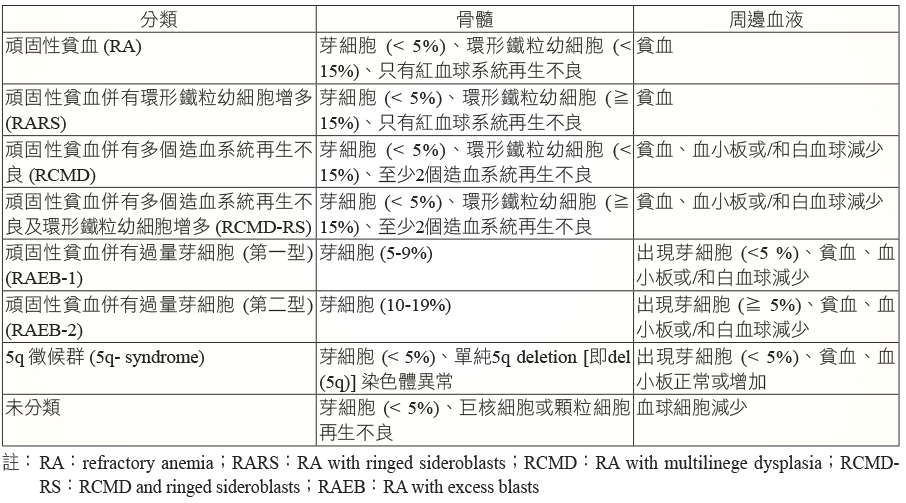
表二 FAB 系統對 MDS 的分類4,5
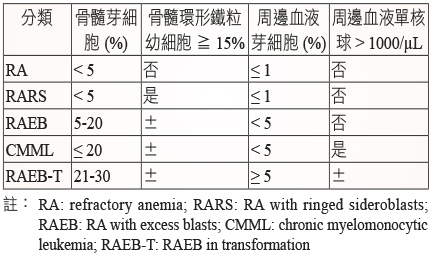
伍、預後
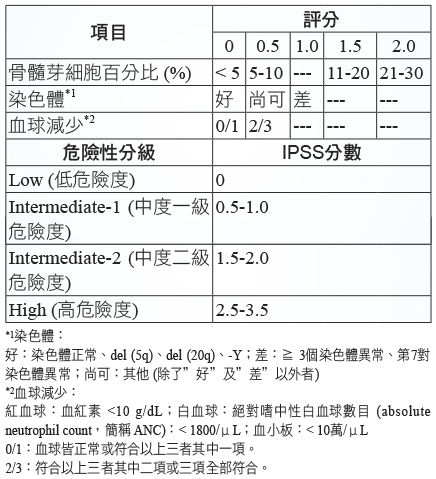
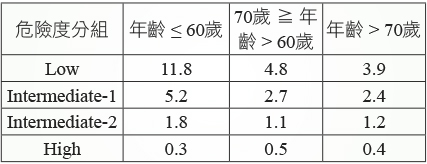
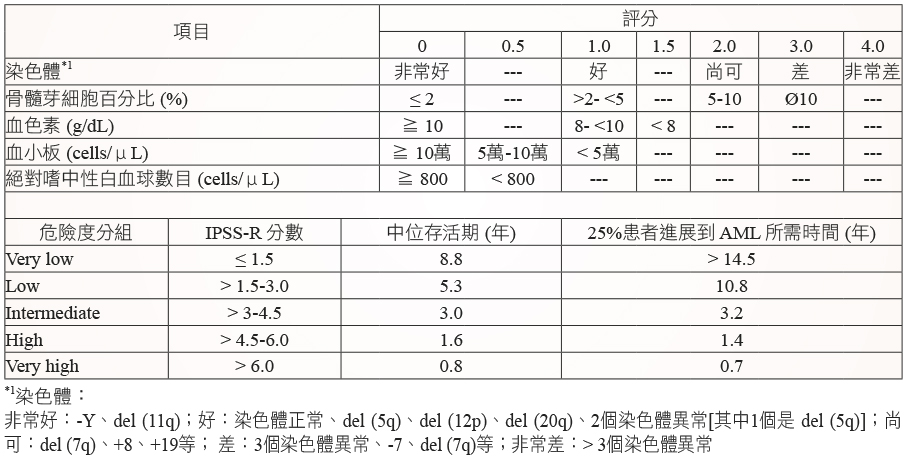
長久以來,MDS 預後是用國際預後評分系統 (International Prognosis Scoring System;IPSS) 分數來評估 (表三)3。評估的項目有三:一、骨髓芽細胞百分比;二、染色體;三、血球減少。依這三項嚴重程度分別給分,然後加總後即得 IPSS 分數,分數越高其預後越差。由 IPSS 分級加上年齡可用來決定 MDS 病人的預後 (表四)。由表四可看出 MDS 預後的差異性相當大,其存活期可從超過十年到小於一年。
表三 IPSS 分數3
表四 IPSS 加上年齡決定 MDS 病人的中位存活期 (年)3
為了更準確地評估 MDS 病人存活期,以及更正確地選擇治療策略,在2012年發展出修訂版 IPSS (IPSS-R;Revised IPSS) 分數 (表五)6。不同於 IPSS,在 IPSS-R 中將血球減少分別獨立給分。然而目前臨床上以及 MDS 治療準則內容仍然是採用 IPSS。
表五 IPSS-R 分數6
陸、 治療
一、通論
大部分 MDS 病人可藉由支持性療法 (例如輸注紅血球、血小板) 就可存活十年以上,但是也有部分病人活不到一年。除非進行異體 (allogenic) 幹細胞移植,否則 MDS 是不可能痊癒的。然而,MDS 病人通常都大於60歲,可能也不太適合執行移植,因為研究顯示 MDS 病人進行異體幹細胞移植後的第4年死亡率可能高達43%7。
對於低危險度 MDS 病人,如果是無症狀貧血,只需採用支持性療法即可,因為沒有任何證據顯示積極地給予這類病人藥物治療可以延長存活期。當疾病進展到有症狀的貧血時可考慮藥物治療。對於高危險度 MDS 病人,若能進行異體幹細胞移植者則應優先選擇移植;若不適合移植者則採用藥物治療。至於中度危險度 MDS 病人,經由醫師評估以及病人意願可選擇藥物治療或是幹細胞移植。若 MDS 已惡化至 AML 則需考慮安寧療護8。
二、支持性療法以及排鐵劑的使用
當病人貧血或是血小板低下時,視症狀輕重,必要時可輸注紅血球或血小板。長期輸紅血球可能造成鐵質沉積。一般而言,輸血超過20次以上就可能要考慮鐵質沉積問題。當血清鐵蛋白 (serum ferritin) 大於1000μg/L 時即應給予排鐵劑,以避免肝臟、心臟等器官因鐵質沉積而發生功能障礙9。可以口服給予排鐵劑 deferasirox,其成人起始劑量為20 mg/kg QD,每三到六個月視血清鐵蛋白值來調升5-10 mg/kg/day,一般維持劑量是20-30 mg/kg/day,除非鐵質沉積 > 2500μg/L 才可調整劑量到40 mg/kg/day。也可選擇靜脈注射排鐵劑 deferoxamine,輸注時間約8-12 小時,每週使用5-7天,建議劑量為40-50 mg/kg/day,最高劑量則為60 mg/kg/day。以上兩種排鐵劑健保皆有給付。
雖然給予紅血球生成素 (EPO) 治療可以大幅降低輸血次數,但是因為其使用劑量高 (每週需要6萬到8萬單位) 且健保不給付,因此臨床上很少使用9。
三、藥物治療
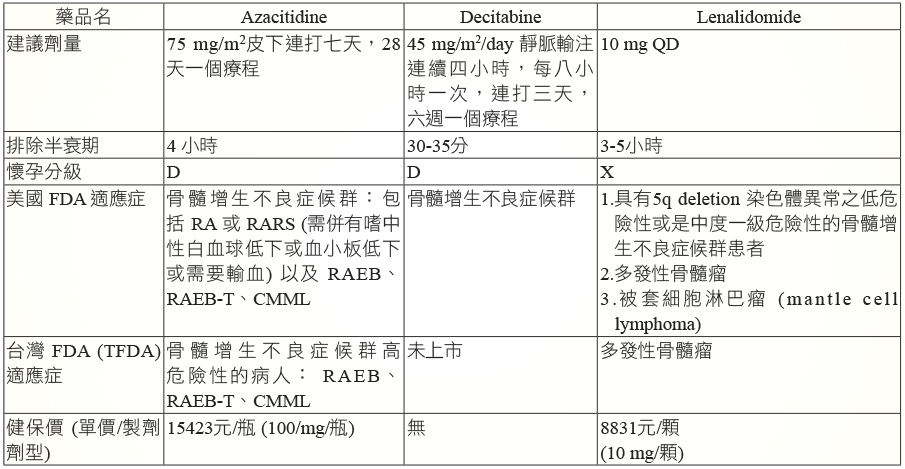
MDS 的藥物治療選擇並不多,azacitidine、decitabine、lenalidomide 是目前經美國 FDA 核准可用於治療 MDS 的三個藥品,其中只有 azacitidine 取得台灣衛福部的適應症和健保給付 (表六)。
表六 藥物比較
(一)Azacitidine (委丹扎)
Azacitidine 是 cytidine 衍生物,作用機轉是抑制 DNA 甲基化和直接毒殺骨髓中不正常的造血細胞。研究顯示高危險度 MDS 病人使用 azacitidine 相較於常規療法 (支持性療法、低劑量 cytarabine 或是其他加強化療),其中位存活期明顯延長 (24.5月 vs 15.0月,hazard ratio 0.58; 95% CI 0.43-0.77; p = 0.0001)10。Azacitidine 是經由皮下給予75 mg/m2/day,連打七天,每28天一個療程。通常在第三次療程以後才開始出現療效,在連續六次療程後可以達到90%的反應率,因此進行療效評估要在第四次療程之後11。Azacitidine 常見副作用為血液毒性 (貧血、嗜中性白血球低下、血小板低下),多數病人會在前幾個療程出現嚴重的嗜中性白血球低下合併發燒 (neutropenic fever) 而住院,此時可給予白血球生長刺激因子 (G-CSF) 和抗生素來治療;然而隨著 azacitidine 使用次數增加,其血液毒性發生機率就會大幅降低。使用 azacitidine 時也要監測腎功能的變化,若在治療過程中發生無法解釋的血清尿素氮 (BUN) 或血清肌酸酐 (serum creatinine) 值上升時,則需在下個療程調降50%劑量12。此外,本品也可能引起代謝性酸中毒,因此若血中重碳酸鹽 (serum bicarbonate) < 20 mEq/L 時,經排除感染因素後,要高度懷疑和本品有關,如此在下個療程則要調降50%劑量12。使用禁忌是對於 azacitidine 成份或是其賦形劑 mannitol 過敏者以及惡性肝腫瘤病人 (因為有可能引起肝昏迷)。懷孕 (本品懷孕分級為D) 和哺乳婦女不建議使用本品。Azacitidine 的健保給付條件是 MDS 高危險度病人:FAB 系統中的 RAEB、CMML、RAEB-T,一旦骨髓芽細胞大於30%則屬於 AML,此時健保就不給付 azacitidine。
(二)Decitabine
Decitabine 的作用機轉同 azacitidine,亦是抑制 DNA 甲基化,但是 decitabine 並不具有直接毒殺骨髓中不正常造血細胞的作用。研究顯示,decitabine 相較於最佳支持性療法,前者雖有明顯較高的整體反應率 (17% vs. 0%, p < 0.001) 且可以延長 MDS 惡化至 AML 或死亡所需的時間,但不具有統計上意義 (12.1月 vs. 7.8月, p = 0.16)13。
在一個系統性回顧的統合分析中發現 azacitidine 可以明顯延長 MDS 惡化至 AML 或死亡所需的時間 (hazard ratio 0.54, 95% CI 0.42-0.70, p < 0.00001),然而 decitabine 雖然也可延緩疾病惡化的時間,但是其效果並不顯著也不具統計學意義 (hazard ratio 0.85, 95% CI 0.66-1.07, p = 0.17)14。
美國 FDA 有核准 decitabine 用於治療 MDS。目前國內尚未上市。
(三)Lenalidomide15
美國 FDA 核准 lenalidomide 用於治療對於具有5q deletion 染色體異常之低危險度或是中度一級危險度的 MDS 患者。Lenalidomide 常見副作用有骨髓抑制、水腫、皮疹,嚴重副作用則要小心靜脈栓塞。此外,由於 lenalidomide 的懷孕分級是X,因此要特別囑咐病人使用該藥期間不可懷孕。台灣 FDA (TFDA) 只核准 lenalidomide 用於治療多發性骨髓瘤 (multiple myeloma),並無 MDS 適應症。
柒、結論
MDS 是最常見的罕見血液疾病,好發於老年人。此病早期的臨床症狀就是貧血,如果輕忽不去檢查,有可能會延誤就醫的黃金治療期。MDS 根據病情和病人狀況,可分別給予輸血、施打 zacitidine (或 decitabine) 或是進行異體幹細胞移植。對於具有單純5q deletion 染色體異常者,可選擇 lenalidomide,但是衛福部尚未核准該藥品此適應症。選擇上述治療方式對於 MDS 症狀的緩解、生活品質的提升及存活期的延長都有相當的進展。
Myelodysplastic Syndrome
Mei-Yun Lai, Chi-Yuan Cheng, Chi-Hua Chen
Department of Pharmacy, Chang Gung Memorial Hospital, Linkou
Abstract
Myelodysplastic syndrome (MDS) is one of the most common rare hematological disorders. The majority of MDS patients are men over 65 years old. This disease is often accompanied by abnormal gene methylation, resulting in ineffective blood cells production by bone marrow. Early symptom of MDS is anemia, followed by thrombocytopenia and neutropenia. IPSS score is a generally accepted tool to evaluate the prognosis of MDS. Management of MDS includes blood transfusion, medication (azacitidine, decitabine, lenalidomide) and allogenic stem cell transplantation according to the disease status and the patient's condition. Lenalidomide is the drug of choice for patients with 5q deletion chromosome. Azacitidine is the only drug approved by TFDA and reimbursed by the NHI for the treatment of MDS in Taiwan. Most MDS patients can survive for more than 10 years only through supportive care by transfusion of red blood cells and/or platelets. Iron overload should be noted in long-term transfusion patients, and administered iron chelating drugs if necessary.
參考資料:
1.Jon C Aster: Clinical manifestations and diagnosis of the myelodysplastic syndromes. UpToDate Oct 21, 2014.
2. 衛生福利部國民健康署。http://www.hpa.gov.tw/BHPNet/Web/Stat/StatisticsShow.aspx?No=201404160001/引用日期 2015/01/11.
3. Greenberg P, Cox C, Le Beau MM, et al. International scoring system for evaluating prognosis in myelodysplastic syndromes. Blood 1997;89:2079-88.
4. Bennett, JM, Catovsky, D, Daniel, MT, et al: FAB Cooperative Group: Proposal for the classification of the myelodysplastic syndromes. Br J Haematol 1982;51:189-99.
5. Greenberg, PL. The Myelodysplastic Syndromes. In: Hematology: Basic Principles and Practice, 2nd ed, Hoffman, R, Benz, E, Shattil, S (Eds), Churchill Livingstone, New York, 1994, p.1098-1121.
6. Greenberg PL, Tuechler H, Schanz J, et al: Revised International Prognostic Scoring System (IPSS-R) for myelodysplastic syndromes. Blood 2012;120:2454-65.
7. Anderson JE, Appelbaum FR, Fisher LD, et al: Allogeneic bone marrow transplantation for 93 patients with myelodysplastic syndrome. Blood 1993;82:677-81.
8. Stanley L Schrier: Overview of the treatment of myelodysplastic syndromes. UpToDate Oct 21, 2014.
9. Elihu H Estey: Management of the complications of the myelodysplastic syndromes. UpToDate Nov 19, 2014.
10. Fenaux P, Mufti GJ, Hellstrom-Lindberg E, et al: Efficacy of azacitidine compared with that of conventional care regimens in the treatment of higher risk myelodysplastic syndromes: a randomised, open-label, phase III study. Lancet Oncol. 2009;10:223-32.
11. Silverman LR, McKenzie DR, Peterson BL, et al: Further analysis of trials with azacitidine in patients with myelodysplastic syndrome: studies 8421, 8921, and 9221 by the Cancer and Leukemia Group B. J Clin Oncol 2006;24:3895-903.
12. Drug information: Azacitidine. UpToDate. 2015. 01. 06 retrieved.
13. Kantarjian H, Issa JP, Rosenfeld CS, et al: Decitabine improves patient outcomes in myelodysplastic syndromes: results of a phase III randomized study. Cancer 2006;106:1794-803.
14. Gurion R, Vidal L, Gafter-Gvili A, et al: 5-azacitidine prolongs overall survival in patients with myelodysplastic syndrome--a systematic review and meta-analysis. Haematologica 2010;95:303-10.
15. Drug information: Lenalidomide. UpToDate. 2015.01.06 retrieved.

