摘要
結核病是全世界最致命的傳染病之一,然而第一線治療用藥常見有肝毒性,且合併使用會增加肝毒性的風險。過去國外研究顯示使用抗結核藥產生肝毒性的發生率約為2%-28%。抗結核藥物引起的肝毒性在亞洲人是比較嚴重的,發生的風險是歐洲、非洲、加拿大的2.8倍。其他可能影響抗結核藥物產生肝毒性的因素包括高齡、女性、營養不良、低白蛋白血症、慢乙醯化狀態、過去肝臟疾病。抗結核藥引起肝毒性的機轉很多部份仍是未知的,且風險因子的研究未有一致之定論。本文藉由文獻回顧探討相關機轉與潛在風險,提供醫療人員在使用抗結核病藥物治療過程作為參考依據,以提升抗結核治療的安全性及完治率。
關鍵字: 結核病、肝毒性、抗結核藥引起肝毒性、antituberculosis drug-induced hepatotoxicity
壹、前言
結核病 (tuberculosis;TB) 在台灣是最嚴重的傳染病之一,經過多年防治的努力,發生率逐年降低,但目前一年仍有約一萬兩千名的新發病個案1。根據台灣衛生福利部疾病管制署 (Centers for Disease Control;CDC) 在2014年3月發佈的「第五版結核病診治指引」,治療不曾治療過的病人建議 isoniazid (INH) + rifampicin (RMP) + pyrazinamide (PZA) + ethambutol (EMB) 2個月,再 INH + RMP + EMB 4個月1。結核病的治療需要多種藥物合併使用以減少抗藥性的發生,然而目前抗結核病的第一線用藥:INH、RMP 及 PZA 都具有肝毒性,且研究顯示合併使用會增加肝毒性的風險2。
國內藥物不良反應統計資料顯示藥品引起肝傷害的發生率約為萬分之一到十萬分之一,然而實際發生率可能更高3。分析1999-2010年間國內不良反應通報資料中,因藥物引起的肝臟損害共2,680件 (約4%),依可疑藥品作藥理分類 (ATC code),其中以抗感染劑比例最高;再依可疑藥品排序前十名 (佔全部通報案件的41.1%),其中前三名皆為抗結核病用藥,依序為 rifater (INH + PZA + RMP)、RMP、INH4。可見使用抗結核病藥物引起的肝毒性是需要重視的課題。本文分別就抗結核病藥物引起肝毒性的機轉、危險因子作探討。
貳、抗結核藥引起肝毒性的機轉
抗結核藥是國內外常見的肝毒性藥物,尤其常見第一線的三個抗結核藥,包括 INH、RMP、PZA。以下一一討論引起肝毒性的機轉。
一、Isoniazid (INH)
INH 引起的肝毒性目前機轉仍不明,多數研究討論可能與個人特異體質 (idiosyncratic) 相關,涉及 INH 的肝毒性代謝物。肝毒性可能發生在藥物治療後一週到六個月,甚至超過六個月,與代謝延遲相關5。根據過去動物跟人體研究顯示,INH 所引起的肝毒性主要為肝細胞病變及壞死,因毒性的 INH 代謝產物會共價結合到細胞的大分子6。在大多數的情形,繼續維持治療,增加的轉氨酶可能因 adaptation 而逐漸恢復水平。有嚴重的肝臟損傷時,停止使用藥物通常可以恢復正常,避免持續損傷引起肝衰竭5。
INH 的代謝反應主要經過兩個路徑 (圖一)6。其中 hydrazine 的毒性早在1908年文獻描述會引起細胞損傷6。
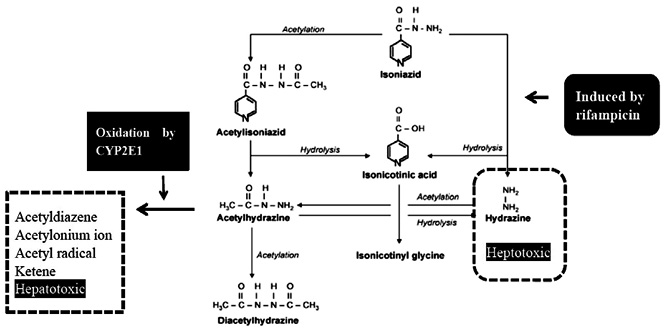
圖一 isoniazid 的代謝路徑6
(一)RMP 會影響 INH 的代謝反應,誘導 INH 形成毒性的 hydrazine。Yew WW 等人研究顯示併用 INH、RMP 的肝毒性發生率為2.6%,高於單獨使用 RMP (1.1%)、INH (1.6%)7。(二)人體的乙醯化反應由基因決定分快速、慢速乙醯化。過去研究證實慢速乙醯化者會有較高比率經由水解反應形成毒性的 hydrazine,且較慢代謝成 acetylhydrazine,在體內累積較多的 hydrazine 有較高比率產生肝毒性6。(三)另一方面受 CYP2E1誘導形成多種肝毒性化合物。Huang YS 等人在2003年發表 CYP2E1 c1/c1 基因型為獨立風險因子,有較高比率產生肝毒性 (OR = 2.52;95% CI = 1.26-5.05;P = 0.009) 。若同時為慢速乙醯化與 CYP2E1 c1/c1 基因型則產生肝毒性的相對風險更高 (OR = 7.43;95% CI = 2.42- 22.79;P = 0.001)5。
而年齡遞增為 INH 增加肝毒性的風險因子,在西方國家,年齡小於20歲者很少出現嚴重的肝毒性。比利時 van den Brande 等人的研究指出60歲以上使用 INH 與 RMP 產生肝毒性的比例高於較年輕的族群為38 vs. 18 %。Snider JD 等人的觀察性研究描述177個 INH 相關的死亡,20歲以下為9.2%、20-34歲為12.4%、35-49歲為17.6%、50-64歲為37.9%而22.9%的人超過65歲8。
在台灣,使用 INH 治療約10-20%的病人血中轉氨酶會暫時輕微升高,多發生於用藥後十週內,通常不需停藥即會恢復正常;嚴重肝炎發生率約0.1-0.15%,發生率和年齡相關,35歲以下約為0.3%,35-49歲1.2%,50-64歲2.3%,通常停藥後肝功能會逐漸恢復正常1。除此之外,病毒性肝炎帶原、肝臟移植、過去肝臟損傷、酗酒史都是使用 INH 產生肝毒性的相關風險因子5。
二、Rifampicin (RMP)
RMP 的主要代謝反應為去乙醯化成 desacetylrifampicin9。RMP 會競爭性的抑制肝細胞回收膽紅素,使得非結合型的膽紅素增加影響藥物的作用。且減少膽紅素的清除影響肝功能。另外 RMP 可能引發膽汁鬱積、肝小葉壞死而造成肝細胞病變,可能是使用 RMP 產生肝毒性的可能因素6。然而目前無相關研究證實與 RMP 代謝產物有相關性9。
RMP 是 CYP450的誘導劑,已證實會誘導 INH 水解產生 hydrazine,兩者併用增加肝毒性的風險。RMP 也會與抗轉錄病毒的藥物產生交互作用,影響藥物血中濃度,增加肝毒性風險6。在治療開始的前兩周經常會增加血中膽紅素的濃度,影響肝細胞功能,會隨著停藥後改善。過去有研究顯示病人有酗酒、肝臟疾病史會增加 RMP 產生肝毒性的風險9。
RMP 經由肝臟代謝,一次給予600 mg 可以達到血中最高濃度約10μg/mL,並可在血中維持2-4小時之久,為短程治療中最重要的藥物1。然而 Schultz V 等人的研究顯示 RMP 的使用劑量大於600 mg/day 是產生肝毒性的獨立風險因子 (OR = 2.47;95% CI = 1.18-5.15;P = 0.016)10。藥物劑量調整如何兼顧療效與不良反應發生,也是重要課題之一。
三、Pyrazinamide (PZA)
PZA 在1952年首次被合成,其主要代謝物為 pyrazinoic acid,再進一步被 xanthine oxidase 氧化成5-hydroxypyrazinoic acid,會抑制腎臟中尿酸的排泄。目前 PZA 引起肝毒性的機轉顯示可能同時與劑量、特異性體質相關;Forget EJ 等人研究發現肝毒性與劑量相關,研究探討可使用低劑量的20-25 mg/kg 治療,或改為一週2-3次的治療療程9。另外 PZA 可能誘發與嗜酸性球相關的過敏反應及肝損傷或肉芽腫性肝炎 (granulomatous hepatitis)6。
近來多個研究證實使用 PZA 會增加肝毒性的風險,一個印度的研究發現將 PZA 加入原本 RMP 與 INH 的治療中,引起肝毒性為70% vs. 42%6。Forget EJ 等人研究顯示在潛伏性肺結核感染使用2個月的 RMP 與 PZA 比使用6個月的 INH 治療有更頻繁及更嚴重的肝毒性8-13% vs. 1-4%9。Tost JR 等人在2005年發表的研究結果,PZA 產生肝毒性與劑量相關,尤其劑量高於30 mg/kg/day。對於產生肝毒性的病人應避免再次投與 PZA,因會增加肝毒性復發的風險11。Shu CC 等人的研究結果,PZA 是第一線抗結核藥物中最常見引起肝毒性的藥物,發生肝毒性的比率 (每百人/月):INH 為0.59,RMP 為0.66,PZA 為3.712。
在台灣,肝毒性發生率為2-20%,在高劑量 (3 gm/day) 時較常發生,使用劑量小於25 mg/kg 發生率低於5%,與 INH、RMP 同時使用會增加肝毒性的風險1。
參、危險因子
一、年齡
國外 Forget EJ 等人的回顧性研究,統整多篇臨床研究結果計算年齡與肝毒性產生的相關性,以每千人的肝毒性發生率來計算,0-19歲為0.8,20-34歲為2.8,35-54歲為9.1,大於55歲為31.09。故國外研究多數以大於35歲以上為風險因子。
另外國內 Shu CC 等人的臨床研究收納926個病人,同時分析年齡、性別對肝毒性產生的風險,兩個風險因子加成後肝毒性產生的危險性越高2。在 Tostmann A 等人的研究中討論年紀較大的病人可能因為藥物代謝的清除率降低,肝臟血流量、肝臟大小改變影響藥物的結合與分布,因而較易產生肝毒性6。
在台灣使用健保資料庫分析年齡與肝毒性的相關性,楊氏的研究結果顯示35-59歲與小於35歲以下:OR = 2.26;95% CI = 1.76-2.91。大於60歲與小於35歲以下:OR = 1.92;95% CI = 1.49-2.46;P = 0.03512。
二、營養 (Nutrition)
根據 Makhlouf HA 等人在美國進行的前瞻性研究,共收納100個病人,同時以白蛋白濃度及 BMI 值去評估,研究結果顯示:albumin < 3.5 g/dL 的病人發生肝毒性的比例是 albumin≧3.5 g/dL 的3.31倍 (OR = 3.31;95% CI = 1.04-10.56;P = 0.035) ;而 BMI < 20 kg/m2 的病人發生肝毒性的比例是 BMI 大於等於20 kg/m2 的3.73倍 (OR = 3.73;95% CI = 1.04-10.56;P = 0.037)13。在 Tostmann A 等人的研究中討論營養不良會降低體內的清除率而使藥物血中濃度增加,可能影響肝毒性的發生率6。
三、HIV感染 (HIV infection)
根據世界衛生組織的統計資料,有 HIV 感染的病人比沒有感染的病人多26-31倍會感染結核病,且有1/4的 HIV 感染的病人會死於結核病。同時結核病也對 HIV 感染有影響,HIV 感染的病人發生結核病會造成病毒量升高、CD4 (cluster of differentiation 4) 淋巴球數會下降造成病程加速。且合併使用抗愛滋病毒藥物與抗結核藥物時會產生交互作用,RMP 會刺激肝臟 CYP 450的活性,降低抗愛滋病毒藥物的血中濃度,因此可能影響抗愛滋病毒藥物的療效1。
國外 Schaberg T 等人的研究,HIV 感染的病人產生肝毒性的比例是沒有的1.96倍 (OR = 1.96;95% CI = 0.5-7.5)14。國外 Ungo JR 等人的研究,HIV 感染的病人產生肝毒性的風險比值是沒有 HIV 感染的4倍 (relative risk = 4;95% CI = 1.114- 19.541;P = 0.036)15。國內 Shu CC 等人的研究,收納926個病人,研究結果顯示有 HIV 感染的病人產生肝毒性的風險比值是沒有 HIV 感染的3倍 (relative risk = 3.080;95% CI = 1.399-6.783;P = 0.005)2。
四、慢性肝臟疾病
Schaberg T 等人在德國進行的研究,收納519個病人,分析住院病人使用抗結核用藥產生肝毒性的風險。進行多變數分析,其中有慢性肝炎的病史發生肝毒性的比例是沒有的3.4倍 (OR = 3.4;95% CI = 1.6-7.6;P = 0.0026)14。
其中慢性B型、C型肝炎感染 (HBV、HCV) 是常見的慢性肝臟疾病,一些研究顯示共同感染時會增加抗結核藥引起的肝毒性。國外 Ungo JR 等人的研究則顯示 HCV 的病人比沒有疾病的人相對風險達5倍 (relative risk =5 ;95% CI = 1.305- 23.311;P = 0.028);且合併 HCV + HIV 的病人相對風險達14倍 (relative risk = 14;95% CI = 2.740-76.135;P = 0.002)15。另外 Makhlouf HA 等人在美國進行的前瞻性研究結果顯示:有過去肝炎病史的病人發生肝毒性的風險是無肝炎病史的3.6倍 (OR = 3.6;95% CI = 1.16-11.18;P = 0.024)13。
而國內楊氏使用健保資料庫分析結果,有 HBV 或 HCV 感染的病人比沒有的病人風險為6.47倍 (OR = 6.47;95% CI = 4.37-9.55);另外臨床收納237個病人,分析有慢性肝炎的病史發生肝毒性的比例與沒有病史的達顯著差異 (P < 0.05)12。
五、其他風險因子
除了上述因子,種族、性別、酒精使用、共病、併用藥物,亦為相關危險因子,然而目前國內外相關研究未有一致之定論2,6,7,10,12,14,15。
肆、結論
抗結核藥引起肝損傷的機轉仍有很多部分是未知的。目前國內外針對基因多型性、抗結核藥物代謝酶進行多方面的研究,找尋與藥物產生肝毒性的相關性。希望藉由風險因子的分析研究,探討藥理機轉的依據,降低藥物不良反應發生的風險。雖然多數抗結核藥引起的肝毒性為短暫的肝功能指數上升,然而嚴重的個案若沒有早期發現並停止藥物治療,可能會是致命的。
抗結核藥物的合併使用降低抗藥性的產生卻提高肝毒性的發生率;治療時間長,影響病人治療依順性與有效性。且近年來 HIV 與結核病的雙重感染機率大幅提升,兩者的用藥選擇與藥物交互作用是臨床治療的一大困境。未來須要更多研究探討病人基因多型性、疾病與藥物、藥物與藥物的交互作用,找出相關風險因子,並密切監測肝功能,以減少肝毒性的發生,降低肝毒性造成的影響,提升抗結核藥物治療的安全性。
Review of Antituberculosis Drug-Induced Hepatotoxicity
Ai-Yu Yang
Department of Pharmacy, Kaohsiung Medical University Chung-Ho Memorial Hospital
Abstract
Tuberculosis (TB) remains one of the world's deadliest communicable diseases. However, the first line treatment drugs, isoniazid (INH), pyrazinamide (PZA) and rifampicin (RMP), used in the regimen are potentially hepatotoxic and may lead to drug-associated hepatitis. The reported incidence of antituberculosis drug-induced hepatotoxicity, varies between 2% and 28%. The condition is more serious among asians, for whom the hepatotoxicity hazard ratio is reportedly around 2.8 compared to patients from Europe, Africa and Canada.Risk factors are advanced age, female sex, malnutrition, hypoalbuminemia, slow acetylator status and pre-existent liver disease. The exact mechanism of antituberculosis drug-induced hepatotoxicity is unknown, variation in risk factor prevalence among different regions. This article will discuss the relationship between hepatotoxicity of each first-line anti-tuberculosis drug and risk factor to be able provide medical health team. To enhance the safety and complete cure rate of antituberculosis treatment.
參考資料:
1. 行政院衛生署疾病管制局. 結核病2015; http://www.cdc.gov.tw/professional/ThemaNet.aspx?did=652&treeid=89B930C89C1C71CF&nowtreeid=89B930C89C1C71CF.
2. Shu CC, Lee CH, Lee MC, et al: Hepatotoxicity due to first-line anti-tuberculosis drugs: a five-year experience in a Taiwan medical centre. Int J Tuberc Lung Dis 2013;17(7):934-939.
3. 趙必暉、陳文雯、翁菀菲:國內藥物不良反應通報資料分析藥品引起肝傷害。Formosan J Med 2013;17(5).
4. 黃靖雅、謝右文:全國藥物不良反應通報系統「藥物引起之肝毒性」通報資料分析。Drug Safety Newsletter 2011;136.
5. Metushi IG, Cai P, Zhu X, et al: A fresh look at the mechanism of isoniazid-induced hepatotoxicity. Clinical pharmacology and therapeutics 2011;89(6):911-914.
6. Tostmann A, Boeree MJ, Aarnoutse RE, et al: Antituberculosis drug-induced hepatotoxicity: concise up-to-date review. Journal of gastroenterology and hepatology 2008;23(2):192-202.
7. Yew WW, Leung CC: Antituberculosis drugs and hepatotoxicity. Respirology 2006;11(6):699-707.
8. Stine JG, Sateesh P, Lewis JH: Drug-induced liver injury in the elderly. Current gastroenterology reports 2013;15(1):299.
9. Forget EJ, Menzies D: Adverse reactions to first-line antituberculosis drugs. Expert opinion on drug safety 2006;5(2):231-249.
10. Schultz V, Marroni CA, Amorim CS, et al: Risk factors for hepatotoxicity in solid organ transplants recipients being treated for tuberculosis. Transplantation proceedings 2014;46(10):3606-3610.
11. Tost JR, Vidal R, Cayla J, et al: Severe hepatotoxicity due to anti-tuberculosis drugs in Spain. Int J Tuberc Lung Dis 2005;9(5):534-540.
12. 楊敏慧:台灣地區結核病流行趨勢與前瞻性分析抗結核藥物導致肝損傷之相關性研究:中國醫藥大學;2007.
13. Makhlouf HA, Helmy A, Fawzy E, et al: A prospective study of antituberculous drug-induced hepatotoxicity in an area endemic for liver diseases. Hepatology international 2008;2(3):353-360.
14. Schaberg T, Rebhan K, Lode H: Risk factors for side-effects of isoniazid, rifampin and pyrazinamide in patients hospitalized for pulmonary tuberculosis. European Respiratory Journal 1996;9(10):2026-2030.
15. Ungo JR, Jones D, Ashkin D, et al. Antituberculosis drug-induced hepatotoxicity. The role of hepatitis C virus and the human immunodeficiency virus. American journal of respiratory and critical care medicine 1998;157(6 Pt 1):1871-1876.

