摘要
紅斑性狼瘡 (Systemic lupus erythematosus, SLE) 是一種會影響身體多種器官的全身性自體免疫疾病,目前尚無法利用藥物或其他方式完全治癒。發生處多為皮膚、關節、中樞神經系統或腎臟等器官。雖然文獻證實賀爾蒙、環境與基因等因素皆跟 SLE 有關係,但確切的致病機轉仍然需要更深入的了解。目前除了傳統療法之外,近幾年亦陸續有新型單株抗體藥物問世,對於 SLE 的治療多了一項選擇。
關鍵字: 紅斑性狼瘡、Systemic lupus erythematosus、SLE、Belimumab、Sifalimumab、抗 IFN-α單株抗體
壹、前言
SLE 好發於育齡期婦女,每100,000位女性就有20至70個發病案例。且與種族背景有相當的關聯性。一般而言,美洲與加勒比海黑人有著較高的盛行率,而非裔、西裔或亞裔相較於其他人種的 SLE 盛行率則有日趨增加的趨勢。存活率方面,與種族背景也有關係,白人五年後的存活率為95%、黑人為90%、拉丁裔為87%。另外,研究顯示男性及較低社會經濟族群與帶有腎病的患者,其存活率也比其他罹患 SLE 的病患來得低。其發病會導致死亡 (特別是腎炎)、感染與加速動脈粥狀硬化。且將近80% SLE 的病患會持續發病或治療失敗。在美國,有三分之一的病人因為骨骼肌狼瘡而不能工作1。其中較值得注意的是,一般 SLE 罹病族群十年後存活率為70%左右。但在狼瘡急性腎絲球腎炎 (lupus glomerulonephritis) 增生的病患中,造成末期腎臟疾病 (end-stage ranal disease) 的風險則為10-30%。在大多數 SLE 的病患中,通常在發病六年後會有造成器官不可逆損害的可能,其中又以大腦、血液與腎臟為主要侵犯對象。尤其又因 SLE 的臨床表徵擁有各種不同面向,因此也讓臨床醫師在治療方面備受挑戰。幾個機轉會使自我耐受性喪失與器官發生障礙,有基因、環境、賀爾蒙與免疫調節等因素會促成組織傷害與臨床的表徵,也可以發展出對於疾病的合理治療方法2。
貳、致病機轉
SLE 是一種多方面全身的自體免疫疾病,會影響皮膚、關節、中樞神經系統或腎臟等器官。雖然賀爾蒙、環境與基因因素跟 SLE 有關係,但對其致病機轉仍然需要更深入的了解3。人體內成熟B細胞 (漿細胞,plasma cells) 能夠產生抗體來對抗外來的病原體,而 SLE 會使得大多數狼瘡病患的抗體活性升高。SLE 一般被認為是一種B細胞疾病:當抗原 (像是雙股螺旋 DNA (double stranded DNA, dsDNA) 與核糖核酸蛋白 (ribonucleoproteins, RNPs)) 與核糖核酸蛋白與它們的標的 (自體抗原) 與補體因子形成循環免疫複合物 (circulating immune complexes, CICs) 後,則會沈積在標的器官內,開始與持續的免疫反應進而導致產生疾病的症狀。
SLE 之疾病活性已知是跟自體活性有關聯,特別是G次型態的抗雙股螺旋 DNA (anti-dsDNA) 免疫球蛋白。SLE 與遺傳性免疫系統的免疫細胞不正常之生長過程亦有關聯,它會製造過多的高親合力自體抗體。許多環境與基因的因子會影響B與T細胞喪失耐受性。這種分化的輔助T細胞 (T helper cells,TH),像是TH1, TH2, TH17, TFH (T濾泡輔助細胞,T follicular helper),甚至調節T細胞(Treg),均跟疾病發炎過程有所牽連4。關於遺傳免疫系統,嗜中性白血球,跟免疫抗原的分化來源一樣,漿細胞樣樹狀細胞 (plasmacytoid dendritic cells,pDCs) 是interferon-alpha (IFN-α)5、嗜鹼細胞與自體活性 IgE 的主要製造者,可促成適應性免疫系統的活化與持續的免疫反應。傳統治療方式係藉由特殊性的主動免疫抑制藥物治療,但是仍然會有缺失與疾病再發作之風險。
參、傳統藥物治療
SLE 的早期診斷與選擇較好的治療方式均會使存活的 SLE 病患五年內之併發症有所改善。然而,在長期追蹤後的發病率,這別是腎臟衰竭,與心血管事件引起的致死率仍然是重要的爭議。使用常規的療法,像是 corticosteroids、hydroxychloroquine、aspirin。在確診後的一半的病人因為損害或危及重要器官而無法存活超過二十年,而且這些 SLE 病患的個人生活品質嚴重受到影響。因此針對 SLE 的療法有必要作進一步改善而產生 SLE 更新的治療方法。Hydroxychloquine 則藉由降低 peptide-MH 蛋白複合物 (peptide-MHC protein complexes) 刺激 CD4 + T cell,peptide-MH 蛋白複合物的處理與轉化而產生免疫反應對抗自體抗原胜肽的形成。研究顯示 hydroxychloroquine 在狼瘡腎炎、神經狼瘡與減輕侵犯皮膚、關節與狼瘡的其他臨床表徵的藥物治療均具有不可缺乏的角色。益處包含狼瘡的效果,較低的副作用與防止血栓性事件的發生。它的效果也被證實能降低 SLE 病患突然發作的風險與在病患存活上有保護的作用。Hydroxychloroquine 常見的副作用為腹痛、噁心、下痢、視力模糊。有可能發生色素沉積改變的視網膜病變與視野缺陷,但若未超過每日的建議劑量,則此副作用的發生並不常見。如果在副作用發生的初期就停藥,則其傷害為可逆的。但若任其發展,則即使在停藥後,其傷害也有可能持續惡化。
肆、新型單株抗體用於 SLE 之治療研究與發展
一、標靶治療原則
B淋巴球在 SLE 患者的致病機轉中扮演中心的角色。B細胞會產生致病的自體抗體與抗原形成免疫複合體與補體的活化,它皆作用在細胞上而導致組織損害。藉由產生細胞激素 (cytokines)、抗原的存在與T細胞的調節功能會促使免疫調節異常6。在 SLE 病患中的T細胞功能之調節與反應也會異常。細胞激素、chemokines、生長因子的濃度會由單核白血球、巨噬細胞與內皮細胞製造而上升,且會驅動狼瘡疾病的活化與使器官受損。這些細胞激素包含B細胞活化因子 (B-cell activating factor, BAFF)、B淋巴球刺激器 (B lymphocyte stimulator)、腫瘤壞死因子 (tumor necrosis factor, TNF)、INF-a、IFN-γ、interleukin (IL)-12,、IL-6、IL-10、與 MCP-1。因此,新型單株抗體的研究,主要著重於與B淋巴球相關的抑制作用,致病機轉 (圖一)。
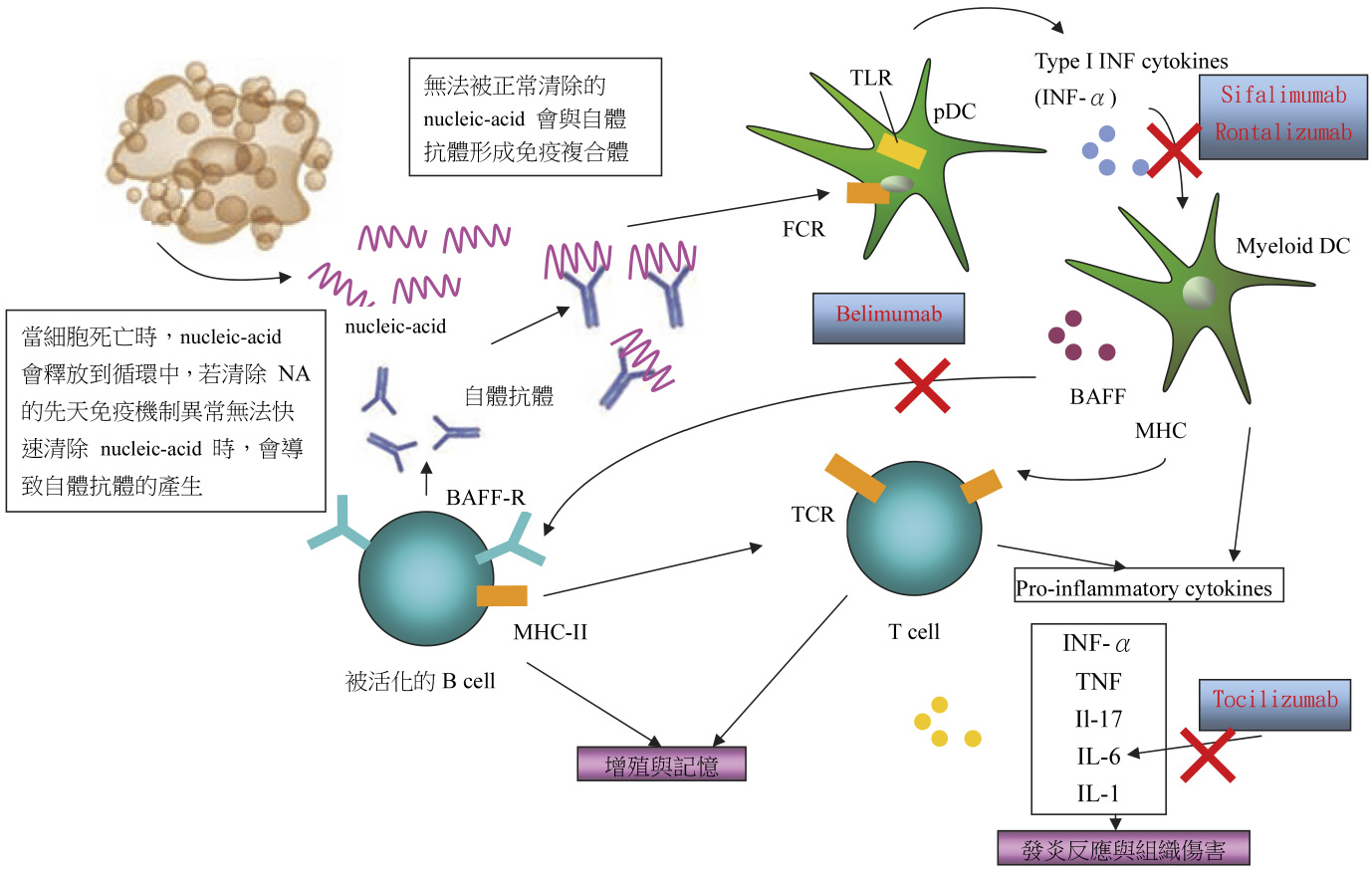
圖一 SLE 致病與治療藥物機轉
(一)Rituximab
Rituximab (RTX) 是一個會結合到 CD20的單株抗體。在多重開放性研究報告顯示,RTX 在嚴重難治的 SLE 與難治的抗磷脂症候群 (anti-phospholipid syndrome) 病患投藥十八個月之後會產生最高的臨床效果。投藥組清楚地顯示 RTX 會改善 SLE 所引起相關的溶血性貧血、血小板低下、關節炎與可能的中樞神經系統的血管炎。最近回顧評估在35個研究中的188位 SLE 病患使用 Rituximab 的效果,有將近90%病患有效。RITUXILUP study 中,在第一天與第十分天分別投予 Rituximab 1 g 與 methylprednisolone 500 mg 且以 mycophenolate mofetil 維持治療。該研究顯示有90%的病患在 rituximab 治療狼瘡腎炎能達到完整的緩解,期望為了安全性而避免使用類固醇7。低劑量的 RTX (每週100 mg) 用於治療狼瘡引起的血小板減少症,高劑量 (375 mg/m2 IV 每週) 用於治療嚴重或難治的 SLE。雖然 RTX 不能當輕度到嚴重程度的 SLE 第一線治療藥物,但對於嚴重與程度疾病有益處。
(二)Belimumab
Belimumab 是完全選擇性標靶的人類單株抗體,用於抑制B淋巴球刺激器 (B-lymphocyte stimulator, BLyS) 而產生自體活性B細胞的凋零8。BLyS 對於B細胞的存活很重要,且研究顯示 SLE 病患中的 BLyS 會有過分表現9,顯示較高濃度的 BLyS 與 SLE 疾病活化有關係。在血清活化的 SLE 病患中,Belimumab 會比對照組有更好的反應且能有意義降低B細胞數量、補體濃度、免疫球蛋白濃度與 anti-dsDNA 濃度。
Belimumab 在兩個大型隨機分配雙盲控制對照組多中心第三期臨床試驗中,BLISS-52與 BLISS-76分別包含865與826位血清性 SLE 病患。Belimumab 比對照組有更好的耐受性、能達到有意義地更好的結果,且能延遲 SLE 第一次疾病的發作,也能有意義地降低類固醇的劑量。Belimumab 是第一個且為目前唯一被 FDA 許可用於難治 SLE 的治療單株抗體。其使用劑量為10 mg/kg 靜脈注射,每兩週投予三個劑量,之後每四週投予一次劑量。半衰期為19.5天。副作用為噁心、嘔吐、易受感染、進行性多灶性白質腦病 (Progressive multifocal leukoencephalopathy) 。
(三)抗 IFN-α單株抗體
在最近幾年 SLE 疾病的免疫致病機轉重要的發展而在已經發展新的治療策略中。Sifalimumab (MedImmune) 是抑制幾個 IFN-α次型態的人類單株抗體。在第一期隨機分配雙盲研究中,發現病患劑量依賴性會降低被誘導的 IFN 的表現10。Rontalizumab (Genentech) 是抗 IFN-α抗體的人類單株抗體。發現超過50%被治療的病患將會由於減少第一型 IFN 原因被誘導,對於未來的試驗產生希望。這兩種抗 IFN-α療法現在已進入第二期隨機分配試驗,治療 SLE 的策略有可能近一步的價值10。
(四)Omalizumab
Omalizumab 是阻斷 IgE 結合到 FcεRI 基因重組人類單株抗體。這種消耗 IgE 策略在治療嚴重過敏性氣喘與過敏性鼻炎有一些療效11。Omalizumab 會阻斷包含 CICs 調節嗜鹼細胞活性,導致被這種B細胞產生的自體抗體減少12。只供皮下注射使用。不得以靜脈注射或肌肉注射的方式投予。生物可用率為62%,整體清除率為2.4-3 mg/kg/day,半衰期為24-26天。副作用為會造成注射部位過敏、關節痛、心肌感染、腦血管疾病、肺栓塞等症狀。
(五)Tocilizumab
Interleukin-6 (IL-6) 是促炎性細胞因子 (proinflammatory cytokine) 的關鍵,tocilizumab 是拮抗 IL-6的α-chain 受體之人類單株抗體,可阻止 IL-6與 IL-6受體結合。Tocilizumab 的安全性與療效在類風溼性關節炎、青少年原發性關節炎的臨床試驗中已經被評估過。而應用於 SLE 治療上,目前為第一期開放性試驗,可利用劑量逐步調升的研究來評估 tocilizumab 在 SLE 病患中的安全性與耐受性與得到可能的療效的初步評估13。在第一期臨床試驗中的 tocilizumab 使用劑量為2-8 mg,兩週一次,投予12週後會使 SLE 的發炎標記與自體抗體濃度降低。副作用為注射部位過敏、肝指數上升、嗜中性白血球降低。
(六)Atacicept 與 Abatacept
Atacicept 是一種重組融合蛋白質,可抑制B細胞刺激器。Atacicept 嘗試用於治療 SLE 病患,該藥會減少B細胞成熟與數目60%。Abatacept 對於 SLE 病患無危及生命的臨床表徵是有益處,且發現在減輕症狀、改善生活品質與減少疾病發作優於對照組14。在第2B階段的多中心雙盲試驗之 ADDRESS II core trial,分別皮下注射投予75 mg 與150 mg atacicept,一週一次連續96週來評估 atacicept 長期使用的安全性與耐受性15,預計在2018年四月將可完成。
伍、討論
SLE 在臨床的表徵與進展多變,這對於臨床醫師來說是一項考驗。藥物治療主要針對疾病發炎與不正常的免疫反應進行壓制,相對著難免伴隨的副作用。最近幾年越來越了解 SLE 的致病機轉,且提供了更新的診斷與更好的標靶藥物的治療。目前已經有各種不同機轉的單株抗體藥物進行臨床試驗,儘管效果與安全性與傳統治療方式無更明顯突出,但是這對於臨床研究來說有更多研究的方向,也許在未來能有作用機轉更專一、效果、安全性更好、投藥發法更為方便、減緩病患病情發作、改善病患的生活品質、提高病患存活率的藥物問世。這對 SLE 病患來說無疑是一項福音。雖然其藥費會更高,但也可提供病患更多較好的選擇。
Novel Therapy of Monoclonal Antibody for Systemic Lupus Erythematosus
Hsin-Hung Chen1, Ya-Chen Lee1, Tien-Yuan Wu2
Department of Pharmacy, Taichung Tzu Chi Hospital, Buddhist Tzu Chi Medical
Foundation1Department of Pharmacology, School of Medicine, Tzu Chi University2
Abstract
Systemic lupus erythematosus (SLE) is a chronic autoimmune disease which cannot be cured up taday. SLE is a multifactorial systemic autoimmune disease affecting multiple organs such as skin, joints, central nervous system, and kidneys. Even know mthough hormonal, environmental, and genetic factors have been associated with SLE, the general pathogenesis of this disease still needs a better understanding. The traditional method of drug therapy for SLE applying corticosteroids may cause a lot of adverse drug reaction. Therefore, the novel drug therapy for SLE are on going, and the new type monoclonal antibodies are also going to clinical trials and launching to the market continuously at the present time.
參考資料:
1. Yelin E, Tonner C, Trupin L, et al: Longitudinal study of the impact of incident organ manifestations and increased disease activity on work loss among persons with systemic lupus erythematosus. Arthritis Care Res (Hoboken) 2012;64:169-75.
2. George C. Tsokos, M.D. Systemic Lupus Erythematosus. The New England Journal of Medicine,365;22, 2011.
3. Liu Z, Davidson A. Taming lupus-a new understanding of pathogenesis is leading to clinical advances. Nat Med 18(6):871-882, 2012.
4. Choi J, Kim ST, Craft J. The pathogenesis of systemic lupus erythematosus-an update. Curr Opin Immunol 24(6):651-657, 2012.
5. Elkon KB, Wiedeman A. Type I IFN system in the development and manifestations of SLE. Curr Opin Rheumatol 24(5):499-505, 2012.
6. Anolik JH. B cell biology and dysfunction in SLE. Bull NYU Hosp Jt Dis 2007;65:182-6.
7. Condon MB, Ashby D, Pepper RJ, Cook HT, Levy JB, Griffith M, Cairns TD, Lightstone L. Prospective observational single-centre cohort study to evaluate the effectiveness of treating lupus nephritis with rituximab and mycophenolate mofetil but no oral steroids. Ann Rheum Dis. 2013; 72:1280-6.
8. Hahn BH. Belimumab for systemic lupus erythematosus. N Engl J Med 2013;368:1528-35.
9. Cancro MP, D’Cruz DP, Khamasht MA. The role of B lymphocyte stimulator (BLyS) in systemic lupus erythematosus. J Clin Invest 2009;119:1066-73.
10. Lauwerys BR, Ducreux J, Houssiau FA. Type I interferon blockade in systemic lupus erythematosus: where do we stand? Rheumatology (Oxford), epub ahead of prrint, Dec. 15, 2013.
11. Incorvaia C, Mauro M, Russello M, Formigoni C, Riario-Sforza GG, Ridolo E. Omalizumab, an anti-immunoglobulin E antibody: state of the art. Drug Des Devel Ther 8:197-207, 2014.
12. Charles N, Rivera J. Basophils and autoreactive IgE in the pathogenesis of systemic lupus erythematosus. Curr Allergy Asthma Rep 11(5):378-387, 2011.
13. Illei GG, Shirota Y, Yarboro CH, Daruwalla J, Tackey E, Takada K, et al: Tocilizumab in systemic lupus erythematosus: Data on safety, preliminary efficacy, and impact on circulating plasma cells from an open-label phase I dosage escalation study. Arthritis Rheum 2010;62:542–552.
14. Merrill JT, Burgos-Vargas R, Westhovens R, Chalmers A, D’Cruz D, Wallace DJ. The efficacy and safety of abatacept in patients with non-life-threatening manifestations of systemic lupus erythematosus: Results of a twelvemonth, multicenter, exploratory, phase IIb, randomized, double-blind, placebo-controlled trial. Arthritis Rheum 2010;62:3077-87.
15. EMD Serono, Long-term Safety and Tolerability of Atacicept (Long-term Follow-Up of Patients Who Participated in ADDRESS II), https://clinicaltrials.gov, July 2015.

