摘要
耳毒性可分為兩大面向:耳蝸毒性 (cochlear toxicity) 會出現耳鳴或聽覺喪失等症狀,有可能永久性失能;前庭毒性 (vestibular toxicity) 則會出現暈眩或失衡症狀,副作用大多於停藥後消失。含鉑化療藥物與 aminoglycosides 是最常見造成耳毒性的藥物。兩種藥物的致病機轉存在些許差異,含鉑化療藥物主要與活性氧化物質的生成有關;aminoglycosides 透過抑制粒線體蛋白質合成與自由基大量生成造成耳毒性。
含鉑化療藥物和 aminoglycosides 的各類藥物風險不一。含鉑化療藥物和 aminoglycosides 的耳毒性風險因子相似,包括給藥途徑、劑量、合併使用藥物、腎功能狀態、基因型。由於耳毒性不易被醫療人員或病人察覺,主動評估與鼓勵病人敘述評估耳毒性症狀十分重要。超高頻聽力測驗 (extended high-frequency (EHF) audiometry) 和變頻耳聲傳射都是能夠協助偵測初期耳毒性的客觀檢查。預防策略以反轉致病機轉的抗氧化劑或自由基清除者為主,但未有任何藥物被證實其療效。各類抗氧化藥物中以 aspirin 和 acetylcysteine 的證據最為完整。藥師需先了解具有耳毒性的藥物種類,熟悉常見症狀與風險因子,適時提供醫療團隊用藥建議,以利提升照護能力。
關鍵字: 耳毒性、含鉑化療藥物、aminoglycosides、ototoxicity、platinum-based anticancer drugs
壹、前言
耳毒性藥物意指藥物使用後,內耳 (inner ear) 組織遭逢暫時性或永久性的傷害,進而造成聽力損害或破壞平衡感1。耳毒性可根據傷害部位細分為耳蝸毒性 (cochlear toxicity) 和前庭毒性 (vestibular toxicity)。耳蝸毒性症狀源自於聽覺系統受損,出現耳鳴 (tinnitus) 或聽覺喪失 (hearing loss) 等現象;前庭毒性症狀則包括暈眩 (vertigo) 及喪失平衡感 (loss of balance)。耳毒性症狀可能在進行治療或治療結束後發生,雙側耳朵會陸續被觀察到。具有耳毒性的藥物包括抗生素 (aminoglycosides、glycopeptide、macrolide、antimalarics)、化療藥物、利尿劑 (furosemide、torsemide、bumetanide) 和解熱鎮痛藥 (salicylates)2。本文針對含鉑化療藥物與 aminoglycosides 的致病機轉、風險因子、分級系統與預防策略進行詳盡介紹。
貳、含鉑化療藥物引起耳毒性的機轉
含鉑化療藥物包括 cisplatin、carboplatin 和 oxaliplatin,三種藥物以 cisplatin 的耳毒性最嚴重。Cisplatin 被廣泛使用於成人與幼兒族群的癌症,包括腦癌、卵巢癌、頭頸癌、神經母細胞瘤…等等。由於並非所有疾病皆能以耳毒性較低的同類藥物進行取代,仍需了解 cisplatin 導致耳毒性的機轉,以利擬定預防策略2。
根據目前研究結果,cisplatin 造成耳毒性主要有三種機轉與路徑:耳蝸內活性氧化物質 (reactive oxygen species) 的生成、nicotinamide adenine dinucleotide phosphate (NADPH) oxidase 異構物活化和transient receptor potential vanilloid 1 channel (TRPV1) 的活化3。此三種機轉最終造成細胞死亡,完全喪失聽力 (圖一)。
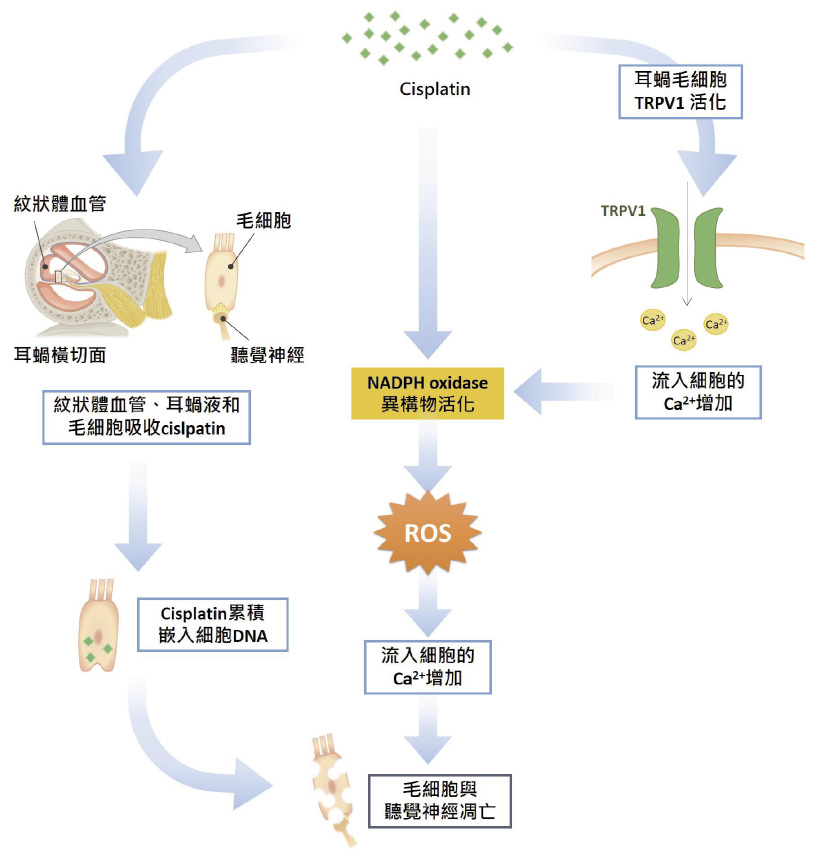
圖一 Cisplatin 造成耳毒性的機轉2
一、 活性氧化物質 (reactive oxygen species) 的生成
全身性的 cisplatin 經由紋狀體血管 (stria vascularis)、耳蝸液 (cochlear fluids) 和毛細胞 (hair cells) 吸收,經由運輸蛋白,穿透血液與內淋巴障壁 (blood-endolymph barriers),進入局部組織。隨著劑量逐漸累積於耳蝸組織,並與細胞內去氧核醣核酸嵌合。活性氧化物質的產量逐漸升高,造成抗氧化酵素生成下降。內生性抗氧化酵素活性降低導致毛細胞、紋狀體血管或聽神經的細胞凋亡3。
二、NADPH oxidase 異構物活化
異構物活化增加活化氧化物質生成,鈣離子流入外毛細胞 (outer hair cell) 的總量增加,造成細胞凋亡3。
三、TRPV1的活化
耳蝸毛細胞的 TRPV1被活化造成流進細胞的鈣離子總量上升,NADPH oxidase 異構物增加活化氧化物質生成3。
參、 Aminoglycosides 引起耳毒性的機轉
Aminoglycosides 造成耳毒性的途徑包括三種機轉:干擾粒線體蛋白質合成、自由基與氧化壓力傷害生成及N-甲基-D-天門冬胺酸 (N-methyl-D-aspartate, NMDA) 受體過度活化4,5。
一、干擾粒線體蛋白質合成
粒線體中的核醣體小次單位和耳毒性最為相關,多個去氧核醣核酸突變減低蛋白質合成總量,暴露於 aminoglycosides 後較易出現毒性6。
二、自由基與氧化壓力傷害生成
研究顯示外毛細胞接觸 aminoglycosides 後,較容易生成自由基造成毒性。自由基的生成逐步增加,將啟動細胞凋亡的級聯機制 (cascade)4。
三、NMDA 受體過度活化
Aminoglycosides 模仿內生性多胺類 (polyamines) 的效果,提升 NMDA 受體功能。鈣離子透過 NMDA 受體大量流入細胞內,亦會造成毛細胞與耳蝸神經纖維的退化4。
肆、藥物引起耳毒性的症狀及風險因子
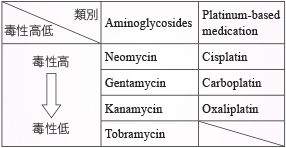
Cisplatin 造成耳毒性的發生率因研究族群不同而有所差異,各研究結果顯示整體耳毒性發生率介於30-50%7;耳毒性定義不同、疾病嚴重度與給藥時間 與劑量不等,aminoglycosides 造成耳毒性的發生率從3.2-47%不等2。Aminoglycosides 用於治療肺結核的耳毒性初期發生率為3.2%,長期 (6-12個月) 治療會造成病人聽力喪失8。Cisplatin 造成的聽力受損在用藥後的數天至數周內出現,雙側耳朵皆會出現症狀。高頻的聽力會先受損,隨著使用期間越長,低頻的聽力也會逐漸喪失。目前已確立的風險因子包括合併使用耳毒性藥物 (例如:aminoglycosides、環狀利尿劑…等)、高累積劑量 (cumulative dose)、治療周期使用較高劑量、使用靜脈推注 (intravenous bolus) 給藥、腦部照射 (cranial irradiation)、中樞神經腫瘤、幼兒 (小於4歲)、男性、含鉑化療藥物的種類、腎功能不全、先天聽力障礙…等2,7,9。癌症治療的週期視疾病特性而定,目前缺乏研究確立 cisplatin 造成耳毒性的閾值劑量或濃度。Cisplatin 的累積劑量每增加100毫克/平方公尺,會增加5-7%的耳毒性發生率7。Carboplatin 的毒性比 cisplatin 較少,但用於嬰兒或給予骨髓破壞式劑量 (myeloablative doses) 的風險會提高;oxaliplatin 導致的耳毒性更為少見 (表一)9。
Aminoglycosides 引起耳毒性的症狀包括永久性聽力喪失與暫時性前庭功能低下。前庭功能低下的表徵包括失衡 (disequilibrium) 和無晃視感 (oscillopsia)5。各類 aminoglycosides 的毒性有所差異,neomycin 的毒性最高,依序為 gentamycin、kanamycin 和 tobramycin (表一)。Streptomycin 和 gentamycin 主要是前庭毒性;amikacin、neomycin 和 kanamycin 則為耳蝸毒性。Tobramycin 同時具有前庭毒性與耳蝸毒性 (圖二)2。其他風險因子包括給藥途徑 (全身性給予或鼓膜 (tympanic membrane) 灌注、基因型5,8、累積劑量、腎功能不全10、給藥頻率、治療期間8、較高的藥物血中濃度2。鼓膜給藥的方式出現較低比例的耳毒性5。然而,聽力喪失與劑量或給藥途徑之間的關係在臨床上很難界定閾值8。
表一 耳毒性比較2
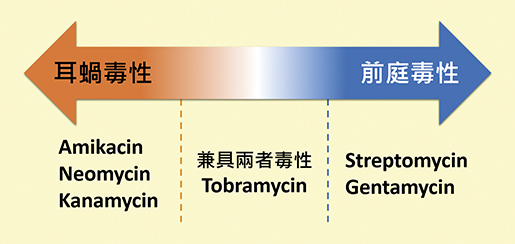
圖二 Aminoglycosides 類抗生素的耳毒性2
伍、耳毒性偵測與評估
藥物引起的耳毒性,大部分先傷害高頻聽力。由於使用耳毒性藥物治療的前後皆未進行聽力評估,容易低估發生率。許多藥物都具有耳毒性,常規性監測耳毒性藥物的作法不切實際。由於含鉑化療藥物和 aminoglycosides 會造成永久性聽力損傷,使用前述藥物應接受聽力檢測2。為了能確立其相關性,美國聽力學院建議開始使用含鉑化療藥物前一周評估病人基本狀況與聽力,接受治療之後前兩年每六個月評估一次,針對聽力喪失越趨嚴重的病人則需要更長時間的監測7。第14版澳洲抗生素治療指引更新使用與監測 aminoglycosides 的注意事項,內容包括量化措施 (提供聽力檢測)、主動床邊測試與病人被動告知監測耳毒性症狀。開始耳毒性藥物治療前,應清楚告知病人藥物治療目的與副作用,提醒病人於治療期間需謹慎留心是否出現類似症狀。若預期治療期間大於5天,建議主動評估耳蝸和前庭功能。耳語聽力測驗 (whisper test) 應用於一般頻率的範圍具有高敏感度,耳毒性藥物常見的高頻聽力受損反而不易偵測。此外,聽力受損可能在治療期間結束後發生,純音聽力檢查 (pure tone audiometry) 和耳聲傳射 (otoacoustic emissions) 等檢查方式可協助了解聽力狀況11。
由於許多學者提出各類評估耳毒性的範疇與分級,Waissbluth S 等人進一步比較各學者提出的耳毒性判定準則。研究結果顯示目前無法整合各準則的內容成為一致性的標準,但 Waissbluth S 等人指出超高頻聽力測驗 (extended high-frequency (EHF) audiometry) 和變頻耳聲傳射 (distortion product otoacoustic emissions, DPOAEs) 皆應列為正式照護項目12。
陸、耳毒性預防方式與結論
降低耳毒性發生的方式主要可分為兩個面向:強化保護機制的路徑和抑制細胞凋亡的路徑13。抗氧化劑或自由基清除者 (free radical scavengers) 被認為具有預防耳毒性的治療優勢。然而,大部分的試驗 (耳蝸毛細胞保護、耳蝸神經元保護及前庭細胞保護) 尚處於動物研究的階段2,5。Cimetidine、amifostine、維他命E等具有抗氧化活性的藥物在動物實驗的階段證實其療效,應用於人體試驗的結果較為侷限2,13。Aspirin 和 acetylcysteine 有較多證據顯示其效果8,13。Aspirin 是第一個經隨機分派試驗證實有效減少聽力喪失的藥物13。Kranzer K 等人以統合分析的方式確立 acetylcysteine 用於預防 aminoglycosides 導致耳毒性的效果,但由於病人族群僅收錄血液透析腹膜透析的患者,外推性較為薄弱14。van As JW 等人探討預防含鉑化療藥物造成癌症兒童患者聽力喪失的藥物使用,由於研究方法具有許多限制,無法證實哪種藥物能有效預防耳毒性15。美國食品藥物管理署迄今也尚未核准任何罹癌幼兒或成人的耳毒性預防藥物9。
由於耳毒性的症狀不明顯,且缺乏常規性監測與評估,容易忽視其對於生活品質或機能的重要性。藥師除了了解具有耳毒性的藥物與可能的症狀之外,也需持續監測用藥期間與劑量的合理性,適時提醒醫療團隊即時評估聽力,避免病人飽受藥物副作用之苦。含鉑化療藥物與 aminoglycosides 具有造成永久性聽力喪失的風險,幼兒與成人皆可能接受此類藥物的治療,不可不慎。此外,由於含鉑的化療藥物與 aminoglycosides 都不完全具有治療的可替換性,轉換藥物使用無法達到相同效果並減少耳毒性。耳毒性預防藥物的使用也受限於證據力薄弱或試驗結尚未結束,不建議做為常規預防耳毒性之用。主動告知病人接受此類治療的潛在風險,並提醒病人接受治療前後需評估聽力狀態,同時兼顧治療的有效性與安全性。
Drug-induced Ototoxicity
Cheng-Chih Wu1,2, Ching-Ling Tai1, Yu-Chin Wang1, Ping-Yu Lee1
Department of Pharmacy, Kaohsiung ChangGung Memorial Hospital1
Department of Pharmacy, Tajen University2
Abstract
Ototoxicity is composed of two facets: cochlear toxicity and vestibular toxicity. Tinnitus and hearing loss are symptoms of cochlear toxicity, which might lead to permanent dysfunction. Manifestations of vestibular toxicity are made of vertigo and loss of balance, which will subside after discontinuing culprit drugs. Platinum-based anticancer drugs and aminoglycosides are common drugs related to ototoxicity. Mechanisms between platinum-based anticancer drugs and aminoglycosides have been existed mild discrepancy. Reactive oxygen species formation is related to platinum-based anticancer drugs, while aminoglycosides is associated with inhibition on mitochondrial protein synthesis and free radical formation.
There is risk difference among those drugs belong to platinum-based anticancer drugs and aminoglycosides. Similar risk factors were shared among those two categories of drugs, including administration route, dosage, combined medication, renal function, and genotypes. It is of great importance to implement active evaluation and encourage patients that delineate the hearing condition, because ototoxicity is rarely recognized by health professionals and patients. Extended high-frequency (EHF) audiometry and distortion product otoacoustic emissions (DPOAEs) should be regarded as objective examination to detect incipient ototoxicity. Anti-oxidants and free radical scavengers which can reverse the mechanism can be candidates as preventive strategies, however, without proven efficacy on separated drug. Aspirin and acetylcysteine possess the most intact evidence among those anti-oxidants. Only when pharmacists are familiar with categories of ototoxic drugs, symptoms, and risk factors related to toxicity can we offer optimal recommendation toward medical team with well-prepared ability on pharmaceutical care.
參考資料:
1.Yorgason JG, Fayad JN, Kalinec F. Understanding drug ototoxicity: molecular insights for prevention and clinical management. Expert Opin Drug Saf. 2006;5(3):383-99.
2. Lanvers-Kaminsky C, Zehnhoff-Dinnesen AA, Parfitt R, et al: Drug-induced ototoxicity: Mechanisms, Pharmacogenetics, and protective strategies. Clin Pharmacol Ther. 2017;101(4):491-500.
3. Paken J, Govender CD, Pillay M, et al: Cisplatin-Associated Ototoxicity: A Review for the Health Professional. J Toxicol. 2016;2016:1809394.
4. Selimoglu E. Aminoglycoside-induced ototoxicity. Current pharmaceutical design. 2007;13:119-26.
5. Guthrie OW. Aminoglycoside induced ototoxicity. Toxicology. 2008;249(2-3):91-6.
6. Huth ME, Ricci AJ, Cheng AG. Mechanisms of aminoglycoside ototoxicity and targets of hair cell protection. Int J Otolaryngol. 2011;2011:937861.
7. Langer T, am Zehnhoff-Dinnesen A, Radtke S, et al: Understanding platinum-induced ototoxicity. Trends Pharmacol Sci. 2013;34(8):458-69.
8. Xie J, Talaska AE, Schacht J. New developments in aminoglycoside therapy and ototoxicity. Hear Res. 2011;281(1-2):28-37.
9. Landier W. Ototoxicity and cancer therapy. Cancer. 2016;122(11):1647-58.
10. Perletti G, Vral A, Patrosso MC, et al: Prevention and modulation of aminoglycoside ototoxicity (Review). Mol Med Rep. 2008;1:3-13.
11. Avent ML, Rogers BA, Cheng AC, et al: Current use of aminoglycosides: indications, pharmacokinetics and monitoring for toxicity. Intern Med J. 2011;41(6):441-9.
12. Waissbluth S, Peleva E, Daniel SJ. Platinum-induced ototoxicity: a review of prevailing ototoxicity criteria. Eur Arch Otorhinolaryngol. 2017;274(3):1187-96.
13. Schacht J, Talaska AE, Rybak LP. Cisplatin and aminoglycoside antibiotics: hearing loss and its prevention. Anat Rec (Hoboken). 2012;295(11):1837-50.
14. Kranzer K, Elamin WF, Cox H, et al: A systematic review and meta-analysis of the efficacy and safety of N-acetylcysteine in preventing aminoglycoside-induced ototoxicity: implications for the treatment of multidrug-resistant TB. Thorax. 2015;70(11):1070-7.
15. van As JW, van den Berg H, van Dalen EC. Medical interventions for the prevention of platinum-induced hearing loss in children with cancer. Cochrane Database Syst Rev. 2016;9:CD009219.
通訊作者:吳承誌/通訊地址:高雄市鳥松區大埤路123號
服務單位:高雄長庚紀念醫院藥劑部藥師/聯絡電話:(O) 07-7317123 ext 6134

