摘要
癌症的發生率居高不下,雖然各種治療不斷往前邁進,但仍因營養不良而導致無法接受完整的處置,且也易造成死亡率增高。靜脈營養可作為無法經口及胃腸道獲得足夠營養患者之營養支持選擇,癌症病人因癌細胞釋放多種激素,改變體內生化反應及生理作用,故對於靜脈營養之處方應該個別設計與考量,如總熱量之需求、碳水化合物之比例、蛋白質之選擇、脂質之選擇、維生素及微量元素的添加,唯有充足的營養支持,才能提供罹患癌症且營養不良者,順利度過抗癌處置,也提升生活品質。
關鍵字: 癌症、營養不良、靜脈營養、Cancer、Malnutrition、Parenteral Nutrition
壹、前言
癌症的發生率居高不下,雖然醫療科技不斷精進,罹癌存活時間不斷拉長,生活品質也逐步提升,但營養失衡及體重下降需要受到更多的關注,其中以惡質病 (cachexia) 為常見原因,約有52-79%的癌症病人有此問題1,其致病機轉包含細胞激素 (TNF-α, IL-1, IL-6, interferon-γ) 活性增加、胃腸功能降低、休息代謝率增加、肌肉蛋白分解上升、肌肉蛋白合成降低2,將造成死亡率及其他共併症的增加、化療之腫瘤反應下降、化療之毒性反應增加等。營養介入是改善此類狀況的良好方式,可分為腸道營養 (enteral nutrition, EN) 及靜脈營養 (parenteral nutrition, PN)。胃腸道功能完整,但無法經口攝食或無法攝入足夠營養素的病人可選用 EN,又稱為管灌餵食 (tube feeding),透過管路將包含蛋白質、碳水化合物、脂肪、維生素及礦物質之液狀食糜混合物灌入病人胃腸道中;癌症病人可能因本身疾病或治療處置後造成的吸收與消化功能降低,當胃腸道功能無法吸收營養時,靜脈營養為營養給予的選擇。
貳、營養支持之評估
一、適應症
對於癌症病人而言,何時開始使用營養支持並無一致的意見,並且存在許多模糊空間,例如歐洲臨床營養與代謝學會 (ESPEN) 及美國靜脈暨腸道營養學會 (ASPEN) 僅對於經口飲食困難者建議進行營養介入3,4;美國胃腸道協會 (AGA) 所進行之系統性回顧及統合性分析,共納入26篇隨機分派之癌症病人使用靜脈營養臨床試驗,包含接受化學治療及放射線治療等族群,雖整體無法增加存活率,但其中15篇研究顯示,適當的營養支持可以增加化療或放療的效益,其相較無營養支持組,降低7%腫瘤體積,且達統計學上顯著差異;但營養介入也會增加40%的併發症,其中包含16%的感染性併發症5。癌症病人之營養介入,雖無法顯著改善癌症病人接受處置後之死亡率,但可有效改善病人的部分生活品質 (包含情緒、呼吸困難、體重減輕、食欲不振及整體生活品質),故仍建議同時符合下列條件之癌症病人,EN 或 PN 可以為適當的選擇:(一)目前明顯的或可預期於未來治療後之營養不良,(二)有可能被治癒或是經治療後有較長的無病期(disease-free period)。
二、癌症病人之生理改變
(一) 營養物質攝取不足 (Inadequate nutritional intake)
營養攝入不足常發生於癌症病人,常見原因包含原發性厭食症 (primary anorexia) 及次發性經口攝食困難,前者由於腫瘤細胞產生如 TNF-alpha 等激素造成中樞神經系統的飽食感,後者則因口腔潰瘍、腸道營養吸收力降低、腹瀉及噁心嘔吐等。營養物質的攝取不足,將導致體重減輕,而癌症病人的體重不足,與癌症死亡率呈現正相關6,7。
(二) 肌肉蛋白耗盡 (Muscle protein depletion)
肌肉蛋白的耗盡是惡質病最顯著的特徵,嚴重地影響生活品質,無論是否脂肪降低,肌肉蛋白的流失與生理功能失調、外科手術後併發症增加、化學治療毒性增加及死亡率增加有顯著關係8。目前評估肌肉蛋白耗盡有以下幾種方法:1.人體計測 (anthropometry) 計算前上肢肌肉區域 (男性 < 32 cm2, 女性 < 18 cm2)、2.雙能量X光吸收儀 (DXA) 測量四肢骨骼肌指數 (男性 < 7.26 kg/m2, 女性 < 5.45 kg/m2)、3.腫瘤學斷層掃描影像 (oncological CT imaging) 測量腰部骨骼肌指數 (男性 < 55 cm2/m2, 女性 < 39 cm2/m2)、4.生物電阻抗分析法 (bioelectrical impedance analysis) 測量全身無脂肪質量指數 (男性 < 14.6 kg/m2, 女性 < 11.4 kg/m2)。
(三) 全身發炎症狀 (Systemic inflammation syndrome)
癌症病人體內存在著程度不一的發炎反應,而這些發炎反應將影響著體內諸多生化代謝路徑9,包含1.蛋白質合成降低、2.胰島素抗性產生及葡萄糖耐受性失調、3.脂質氧化增加。
三、臨床評估
病人自填主觀性整體評估 (patient-generated subjective global assessment, PG-SGA) 是目前廣為使用之癌症病人營養評估工具,包含「病人自評」及「醫療專業評估」。病人自評有四大部分:體重變化、進食狀況、臨床症狀、活動與功能;醫療專業評估四大部分:體重流失、疾病診斷、代謝需求、理學檢查;將所有分數加總,可得營養不良的程度,分數越高代表營養缺乏嚴重,亟需營養支持與介入。
參、靜脈營養使用
一、基本營養需求
很多人認為罹患癌症,就要降低熱量的攝取,以利餓死癌細胞,但這是錯誤的概念,事實上,罹癌的病人更需要給予足夠的熱量與營養,以維持身體的高代謝狀態之生理機能,維持免疫功能、降低感染發生,並且才能夠耐受各種治療所造成的副作用10。2002年 Ireton-Jones C 等人初次於論文中發表了總熱量消耗 (Total Energy Expenditure, TEE) 方程式,一直演變至今 (表一),也應證了癌症病人需要較多熱量以維持耗能,由於高代謝狀態,大多數癌症病人的基礎能量消耗 (Basal Energy Expenditure, BEE) 會比一般人增加,尤其對於胰臟癌及肺癌病人,而對於已接受外科手術及化學藥物治療者,BEE 會略為下降,但尚無針對各類癌症所列之實證能量需求表,必須依個案整體考量與以計算,一般建議癌症病人每天可攝取25-30 kcal/kg 的熱量。
表一 總熱量消耗量計算表
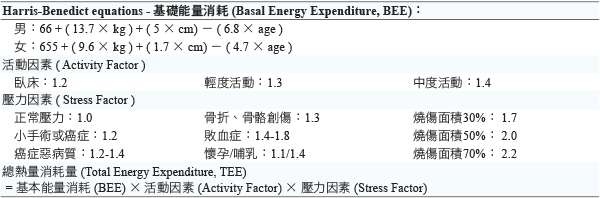
碳水化合物為身體能量主要來源,也是 PN 配方的主要基底,通常使用 dextrose monohydrate,當病人須要限水時,可考慮使用高濃度的葡萄糖水溶液,但須注意癌症病人因全身性發炎反應,導致碳水化合物代謝功能異常,故易伴隨胰島素抗性、葡萄糖利用受阻,但是這類病人對於脂肪的利用幾乎是不變的,甚至些微上升,所以在設計營養配方時,必須考量無法有效利用的葡萄糖,是否會氧化而造成細胞的傷害,在這種情況下,可以考慮增加脂肪碳水化合物比例 (fat-carbohydrate ratio),也就是降低碳水化合物的分量,以脂肪為能量的供應,每日的脂質建議量為0.7-1.9 g/kg (約60-80% BEE);此外,也須注意成人之初使葡萄糖輸注速率 (glucose infusion rate, GIR) 建議為4-7 mg/kg/min,可逐步增加速率,最高可達12 mg/kg/min,若超過此輸注速率,將誘導生理產生 glycogen repletion 及 lipid synthesis,反而導致能量的消耗、攝氧量增加及二氧化碳的產生,此外也可能增加高血糖及肝臟脂肪細胞發炎的可能性。
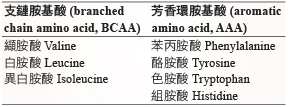
為了降低癌症患者肌肉蛋白的流失,補充蛋白質是必要的,研究顯示每天補充1-1.2 g/kg 的蛋白質,可以增加肌肉合成,是對於癌症病人有益處的11,蛋白質的補充量可提高到每日1.5 -2 g/kg,但是對於急性或慢性腎功能不全者,每日蛋白質補充量分別不宜超過1.0及1.2 g/kg;而選擇富含支鏈胺基酸 (branched chain amino acid, BCAA、表二) 者,能夠比一般胺基酸配方提供癌症病人更多蛋白質的合成;麩醯胺酸 (glutamine) 是一種條件性的必需胺基酸,於代謝壓力及器官受損時,藉由代謝基因表現的調控,能夠促進細胞再生與修復;於接受化學治療或放射治療後的病人,對口腔黏膜炎 (mucositis) 及胃腸道症狀所造成的不適能有意義的改善,但也有部分研究指出,麩醯胺酸恐無法加速重症病人的復原,反而會有意義的增加死亡率12,故對於臨床使用仍未有一致性的結論。
表二 支鏈與芳香環胺基酸
越來越多的研究顯示,癌症與發炎具有一定的相關性,而二十碳五烯酸 (eicosapentaenoic acid , EPA) 屬於 ω-3多元不飽和長鏈脂肪酸,能夠與花生四烯酸 (ω-6 arachidonic acid, AA) 競爭,降低 AA 所產生的發炎反應13;EPA 補充能顯著增加食慾、體重、瘦肉組織及生理功能。於安全性方面,最常見的為輕微地胃腸道不適;每日攝取 EPA 與 DHA 綜合含量小於5 g 或 EPA 含量小於1.8 g 並不會造成成人出血風險,目前仍建議對於接受化療而體重減低或嚴重營養不良者,可適當地補充長鏈 N-3脂肪酸或魚油以促進食慾、增加瘦肉質量及整體體重。
由於癌症病人的食慾不佳與消化功能降低等因素,除了一般營養素攝取不足外,連帶也有維生素與其他微量元素的攝取不足問題,但其靜脈營養添加建議量仍依照每日營養素建議攝取量 (recommended dietary allowances, RDA) 補充即可14,尤其對於需持續使用靜脈營養超過一周者,對於沒有特定病況下,不建議使用高劑量的維生素及微量元素補充劑。雖然部分研究指出,體內維生素D的不足,與癌症的發生及死亡率有關連,例如每日補充600單位以上的維生素 D3可以顯著降低乳癌及大腸癌的發生率,但也有研究指出,過多的維生素D攝取將導致動脈硬化風險增加、肌肉疼痛、罹患高血壓之機率上升,故目前並不支持、也不否定是否需要補充維生素D;另對於高劑量的維生素A及維生素B群,也可能誘發癌症細胞的活性,雖然生化反應的因果關係有待釐清,然尚不建議額外補充高劑量的維生素。
二、靜脈營養的風險
靜脈營養能夠提供現階段或未來可能遭遇營養不良者足夠的熱量與營養素來源,有足夠的熱量及適當的營養,可降低癌症病人的死亡率,以及輔助其能度過化學藥治療及放射線治療,但使用靜脈營養並不是絕對的安全,於使用上仍有注意事項,可簡單區分為代謝性與非代謝性併發症。
(一)代謝性併發症
由於 PN 內含葡萄糖,又為直接注入體內,輸注流速過高容易造成高血糖,尤其對於年長者、糖尿病族群及合併感染症者,故可借由流速調整降低高血糖的發生,血糖應控制在140-180 mg/dL,若血糖值大於400 mg/dL,則建議停止使用 PN;而使用 TPN 一段時間後,則因生理已適應如此葡萄糖輸注,若流速驟減或突然停止使用,則恐誘發低血糖的產生,造成昏迷等症狀,故建議逐步降低流速。
高三酸甘油脂症 (hypertriglyceridemia) 也容易發生於敗血症、腎衰竭、胰臟炎、高脂肪乳劑劑量、corticosteroid 及 heparin 使用者,故也必須密切監控使用者之血脂數值。另外,膽汁鬱積 (cholestasis) 及電解質不平衡也是使用 PN 常見的併發症。
再餵食症候群 (refeeding syndrome) 則是因為長期營養不良,而導致生理上的能量方式使用轉變,故再給予營養介入後,將刺激胰島素的分泌,使鉀、鎂、磷離子等由細胞外轉變到細胞內,故於開始使用 PN 之24小時內建議監測電解質,若發生再餵食症候群,則可降低 PN 流速。
(二)非代謝性併發症
感染症是最常見的非代謝性併發症,由於 PN 富含高營養,且又是直接與靜脈相連,故須做好管路及注射部位的清潔與乾燥,尤其若有沐浴時,須慎防該不為浸濕,護理人員也須每日評估注射部位的狀況,是否有發紅、腫脹、灼熱感、疼痛等情形。此外,靜脈導管的放置也是需要專業的技術,但仍可能有造成如氣胸、血胸、動脈穿刺、空氣栓塞、靜脈栓塞等併發症。
肆、結語
對於營養不良而無法經口或胃腸道獲得足夠營養時,及時的靜脈營養介入是必要的,尤其對於癌症病人,常因為營養不良易導致無法接受完整的癌症治療,且處置後的死亡率也較高;然而癌症病人的營養需求及生理反應與一般人略有不同,對於總熱量需求、碳水化合物、蛋白質、脂質及其他微量元素也須個別考量,唯有充足的營養支持,才能提供罹患癌症且營養不良者,順利度過抗癌處置,也提升生活品質。
Parenteral Nutrition in Cancer Patient with Malnutrition
Hao-Ming Chen1, Min-Jen Tsao2, Yi-jun Lin3, Yi-jun Lin4
Division of Pharmacy1, Department of Surgery2, Department of Nursing3, Division of Nutrition4, Zuoying Branch of Kaohsiung Armed Forces General Hospital
Abstract
The high incidence of cancer, and various treatments continue to move forward, but malnutrition is still a big challenge for care givers and patients, that is a reason will lead to withdraw a complete treatment and increase mortality. Parenteral nutrition support can give malnourished patients who can’t take sufficient nutrition from oral and enteral. Because biochemistry and physiology change on cancer patient, we need individualize to consider and design prescription regiment, including total energy expenditure, carbohydrate, protein, fat, vitamin and trace element. Completely accept treatment of chemotherapy/radiotherapy/surgery, only if we provide enough nutrition to malnourished cancer patients, but also can improve quality of life.
參考資料:
1.Hopkinson JB, Wright DN, McDonald JW, Corner JL. The prevalence of concern about weight loss and change in eating habits in people with advanced cancer. Journal of pain and symptom management 2006;32:322-31.
2. Dinarello CA. Proinflammatory cytokines. Chest 2000;118:503-8.
3. Singer P, Berger MM, Van den Berghe G, et al: ESPEN Guidelines on Parenteral Nutrition: intensive care. Clinical nutrition (Edinburgh, Scotland) 2009;28:387-400.
4. August DA, Huhmann MB. A.S.P.E.N. clinical guidelines: nutrition support therapy during adult anticancer treatment and in hematopoietic cell transplantation. JPEN Journal of parenteral and enteral nutrition 2009;33:472-500.
5. Koretz RL, Lipman TO, Klein S. AGA technical review on parenteral nutrition. Gastroenterology 2001;121:970-1001.
6. Bozzetti F, Gavazzi C, Miceli R, et al: Perioperative total parenteral nutrition in malnourished, gastrointestinal cancer patients: a randomized, clinical trial. JPEN Journal of parenteral and enteral nutrition 2000;24:7-14.
7. Gregg JR, Cookson MS, Phillips S, et al: Effect of preoperative nutritional deficiency on mortality after radical cystectomy for bladder cancer. The Journal of urology 2011;185:90-6.
8. Naito T, Okayama T, Aoyama T, et al: Skeletal muscle depletion during chemotherapy has a large impact on physical function in elderly Japanese patients with advanced non-small-cell lung cancer. BMC cancer 2017;17:571.
9. McMillan DC. Systemic inflammation, nutritional status and survival in patients with cancer. Current opinion in clinical nutrition and metabolic care 2009;12:223-6.
10. Arends J, Baracos V, Bertz H, et al: ESPEN expert group recommendations for action against cancer-related malnutrition. Clinical nutrition (Edinburgh, Scotland) 2017;36:1187-96.
11. Barrera R. Nutritional support in cancer patients. JPEN Journal of parenteral and enteral nutrition 2002;26:S63-71.
12. Kuhn KS, Muscaritoli M, Wischmeyer P, Stehle P. Glutamine as indispensable nutrient in oncology: experimental and clinical evidence. European journal of nutrition 2010;49:197-210.
13. Faber J, Berkhout M, Fiedler U, et al: Rapid EPA and DHA incorporation and reduced PGE2 levels after one week intervention with a medical food in cancer patients receiving radiotherapy, a randomized trial. Clinical nutrition (Edinburgh, Scotland) 2013;32:338-45.
14. Biesalski HK, Bischoff SC, Boehles HJ, Muehlhoefer A. Water, electrolytes, vitamins and trace elements - Guidelines on Parenteral Nutrition, Chapter 7. German medical science : GMS e-journal 2009;7:Doc21.
通訊作者:陳浩銘/通訊地址:高雄市左營區軍校路553號
服務單位:國軍高雄總醫院左營分院臨床藥劑科藥師/聯絡電話:(O) 07-5887104

