摘要
幽門螺旋桿菌是引起慢性胃炎、消化性潰瘍疾病的常見原因,甚至最終會導致胃癌。美國胃腸病學院所建議之幽門螺旋桿菌感染第一線治療方法為標準三合療法:每日服用二次氫離子幫浦阻斷劑、clarithromycin 及 amoxicillin。文獻回顧發現有兩篇研究在比較每日服用多次與每日服用二次 amoxicillin 對幽門螺旋桿菌除菌率的結果不一致。本文認為以藥效-藥物動力學來看,amoxicillin 屬於時間依賴型抗生素,且 amoxicillin 在血中的半衰期短,每日服用多次 amoxicillin 理論上會比每日服用二次 amoxicillin 在藥物體內濃度高於最低抑菌濃度以上時間的總和會更長,抗菌效力會更好,除菌率會更佳。對於未來的研究設計,本文建議應檢測 amoxicillin 的血中濃度、amoxicillin 胃液中濃度及胃液 pH 值,並進一步對照臨床效果 (除菌率) 與藥物體內濃度高於最低抑菌濃度以上時間的總和是否有正相關。
關鍵字:amoxicillin、幽門螺旋桿菌、除菌率、Helicobacter pylori、eradication rate
壹、背景與目的
幽門螺旋桿菌 (Helicobacter pylori, H. pylori) 能高度適應胃中環境,存活於胃粘膜層內或之下。幽門螺旋桿菌引起的慢性發炎會以不同程度打亂胃酸分泌生理,導致慢性胃炎。胃分泌的改變及胃組織損傷,會導致消化性潰瘍疾病;而慢性胃炎會進展到慢性萎縮性胃炎、胃黏膜腸上皮化生 (Gastric intestinal metaplasia),最終導致胃癌1。
估計全球有近50%的人口被幽門螺旋桿菌感染2。與工業化國家相比,發展中國家的感染率更高,尤其在年輕的族群中。在發展中國家 (如墨西哥),大多數兒童在10歲之前被感染,成人患病率在50歲之前達到80%以上3,4。在已開發國家 (如美國),兒童感染較不常見,但在成年期變得更加普遍,幽門螺旋桿菌的血清學證據很少在10歲之前發現,但在18至30歲之間增加到10%,而在60歲以上的人中則增加到50%3。
目前美國胃腸病學院所建議之幽門螺旋桿菌感染第一線治療方法為標準三合療法:氫離子幫浦阻斷劑 (proton pump inhibitor, PPI)、clarithromycin 和 amoxicillin (或 metronidazole)5。用法為每日服用二次 PPI,每次服用標準或雙倍劑量;每日服用二次 clarithromycin,每次500 mg;每日服用二次 amoxicillin,每次1000 mg (或每日服用三次 metronidazole,每次500 mg),療程為7-14天5。
根據美國胃腸病學院建議,每日服用二次 amoxicillin,每次1000 mg 為常用的用法,但以藥效-藥物動力學來看,amoxicillin 屬於時間依賴型抗生素,且 amoxicillin 在血中的半衰期短 (t1/2 = 1.5 hr),每日服用多次 amoxicillin 理論上會比每日服用二次 amoxicillin 藥物體內濃度高於最低抑菌濃度 (MIC, minimum inhibitory concentration) 以上的時間的總和 (total length of percent time above MIC, %time above MIC) 更長,抗菌效力更好,除菌率 (eradication rate) 更佳。
影響幽門螺旋桿菌除菌率的可能因素有以下幾點:
一、抗生素之抗藥性
幽門螺旋桿菌的治療會同時併用多種抗生素,因此抗生素之抗藥性對除菌率成敗的影響很大。一篇2010年的統合分析研究中指出,幽門螺旋桿菌對 clarithromycin 有抗藥性的病人的幽門螺旋桿菌除菌率遠低於幽門螺旋桿菌對 clarithromycin 有敏感性的病人 (22% vs 90%)6,一篇臺灣東部地區 (花蓮) 的流行病學研究發現, 幽門螺旋桿菌對 metronidazole、clarithromycin、amoxicillin 的抗藥菌株比率分別為51.9%、13.5%及36.1%。有至少兩種以上抗藥菌珠的比率為33.8%,同時有 metronidazole 及 amoxicillin 的抗藥菌株的比率為18.1%7。
二、PPI 的代謝速率
幽門螺旋桿菌藥物療法中使用 PPI 的其中一個主要目的是使胃內的 pH 值上升,增加抗生素對幽門螺旋桿菌的敏感度。PPI 由於主要由肝臟酵素 CYP2C19代謝,而具不同基因型 CYP2C19者對於 PPI 的代謝速度會有不同,理論上「代謝速率快基因型」者因 PPI 可持續作用之時間較短,PPI 血中濃度會較低8,胃液 pH 值較低8,除菌率較差9。
三、病人服藥順從性
抗生素能夠達到抗菌效果的關鍵因素是按時服藥,把全部療程服用完畢,因此如何提高病人的服藥意願及服藥順從性,顯得相當重要。在幽門螺旋桿菌療程中影響病人服藥順從性可能的原因有二:(一)每日服藥次數 (二)藥物不良反應事件。每日服藥次數增加,可能降低服藥的意願,使得服藥順從性降低;每日服藥次數增加,也可能造成藥物不良反應事件增加,使得服藥順從性降低10。
近年有兩篇研究比較每日服用多次與每日服用二次 amoxicillin 對幽門螺旋桿菌除菌率的結果不一致,可能是因為沒有同時控制所有的影響因子 (抗生素之抗藥性、PPI 的代謝速率、病人服藥順從性等),本文欲更進一步討論並給予研究之建議。
貳、文獻回顧
Kim SY, et al. (2008) 在韓國醫院的隨機分派研究10,納入2005年6月至2006年4月診斷有幽門螺旋桿菌感染的186位門診病人,使用標準三合療法治療,隨機分派分成兩組比較:一組為 amoxicillin 1000 mg BID 組 (n = 93),另一組為 amoxicillin 500 mg QID 組 (n = 93)。比較結果發現,使用意圖治療分析法 (intention-to-treat analysis, ITT analysis)(把所有受試者納入),除菌率1000 mg BID 組91.4 %高於500 mg QID 組89.2%,但統計上無顯著差異 (p = 0.620 > 0.05);若使用符合計畫書分析 (per-protocol analysis, PP analysis)(只納入服藥順從性佳者),除菌率1000 mg BID 組92.1%高於500 mg QID 組90.8%,統計上也無顯著差異 (p = 0.752 > 0.05)。
此篇研究亦有分析服藥順從性及藥物不良事件:在服藥順從性分析結果中發現,每日服藥次數少的1000 mg BID 組95.7% 高於每日服藥次數多的500 mg QID 組93.5%,但統計上無顯著差異 (p = 0.516 > 0.05)。每日服藥次數增加,也可能造成藥物不良反應事件增加,此研究在藥物不良反應事件分析中,每日服藥次數多的500 mg QID 組39.8%高於每日服藥次數少的1000 mg BID 組30.1%,但統計上無顯著差異 (p = 0.166 > 0.05);副作用數量和服藥順從性之間也沒有關係 (p = 0.938 > 0.05)。此篇研究作者認為1000 mg BID 組與500 mg QID 組在幽門螺旋桿菌除菌率、服藥順從性及藥物不良事件皆無顯著差異的情況下,每日服藥次數少,可使病人服藥更加方便舒適。
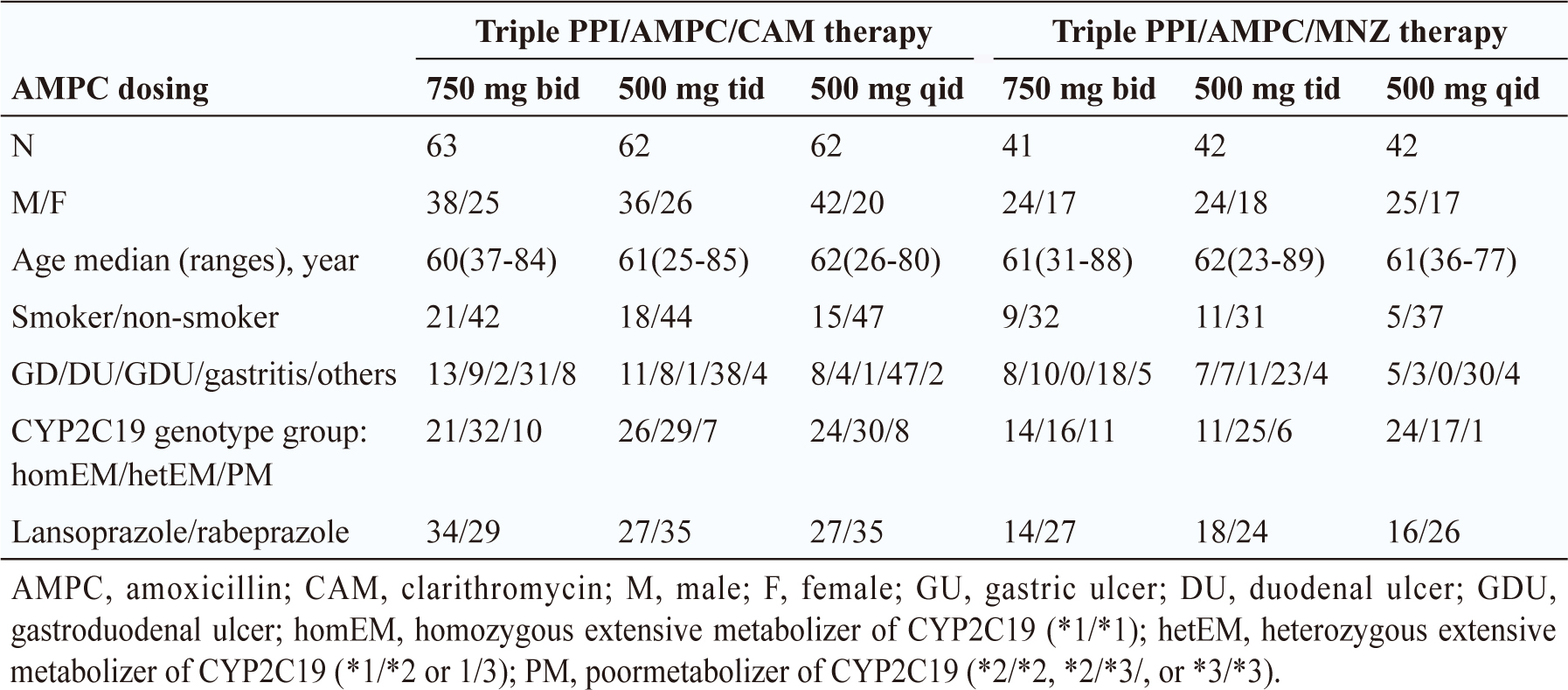
另外一篇 Furuta T, et al. (2014) 在日本醫院的隨機分派、非盲的前瞻性研究11,納入2003年4月至2005年10月診斷有幽門螺旋桿菌感染的312位病人,先檢測幽門螺旋桿菌對 clarithromycin 的敏感性,分為 clarithromycin-sensitive 組 (使用 triple PPI/amoxicillin/clarithromycin therapy, n = 187) 和 clarithromycin-resistance 組 (使用 triple PPI/amoxicillin/metronidazole therapy, n = 125) 兩大組,驗出幽門螺旋桿菌對 clarithromycin 有抗藥性者,會將 clarithromycin 換成 metronidazole 使用。這兩大組再各別隨機分派分成三個不同劑量頻次組比較:amoxicillin 750 mg BID 組 (日劑量1500 mg)、amoxicillin 500 mg TID 組 (日劑量1500 mg) 及 amoxicillin 500 mg QID 組 (日劑量2000 mg)(表一)。
表一 Furuta T, et al. (2014) 日本醫院研究的分組基本資料
為了減少因 PPI 代謝後的作用時間不同而影響到各組之間除菌率的差異。本篇研究在「CYP2C19代謝速率快基因型」者使用較高的 PPI 劑量,因代謝速率快者 PPI 可持續作用之時間較短,使得除菌效果會較差;而「CYP2C19代謝速率慢基因型」者則使用較低的 PPI 劑量。
結果顯示 clarithromycin-sensitive 組 (n = 187) 使用 ITT 分 析,除菌率750 mg BID 組77.8%、500 mg TID 組93.5%、500 mg QID 組91.9%,組別間統計上有顯著差異的有500 mg QID 組 vs 750 mg BID 組 (p < 0.05) 及 500 mg TID 組 vs 750 mg BID 組 (p < 0.05)。但500 mg QID 組 vs 500 mg TID 組 (p ≧ 0.05) 並沒有達到統計上的顯著差異。
另一大組 clarithromycin-resistance 組 (n = 125) 使用 ITT 分析,除菌率750 mg BID 組80.5%、500 mg TID 組90.5%、500 mg QID 組95.2%,同樣組別間統計上有顯著差異的有500 mg QID 組 vs 750 mg BID 組 (p < 0.05) 及500 mg TID 組 vs 750 mg BID 組 (p < 0.05)。但500 mg QID 組 vs 500 mg TID 組 (p ≧ 0.05) 並沒有達到統計上的顯著差異。
此篇研究結果顯示:同日劑量下 (1500 mg),500 mg TID 組比750 mg BID 組除菌率佳 (ITT 分析:93.5% vs 77.8%),且有達到統計上的顯著差異 (p < 0.05),表示每日服用三次比每日服用二次除菌效果好;類推每日服用四次會比每日服用三次好,但結果每日服用四次卻沒有比每日服用三次好:500 mg QID 組沒有比500 mg TID 組除菌率佳 (ITT 分析:91.9% vs 93.5%),且沒有達到統計上的顯著差異(p ≧ 0.05)。因此筆者的推論是:一、每日服用三次已達最佳除菌效果;二、500 mg QID 組及500 mg TID 組的日劑量不同 (2000 mg/day vs 1500 mg/day),所以此兩個劑量頻次組不太具可比性。
參、建議檢測 amoxicillin 在體內的濃度
由上述文獻回顧發現 amoxicillin 對幽門螺旋桿菌除菌率的結果不一致,可能是因為沒有同時控制所有的影響因子 (抗生素之抗藥性、PPI 的代謝速率、病人服藥順從性等),本文認為雖然藥物治療是直接看臨床效果 (幽門螺旋桿菌除菌率),但抗生素劑量產生的血清濃度 (藥物動力學,pharmacokinetic, PK) 及分佈至受感染部位抗生素濃度 (藥物效力學, pharmacodynamic, PD) 皆會影響抗生素發揮抗菌效力。故本文認為應該要一併檢測相關生化指標,檢測 amoxicillin 在體內的濃度:amoxicillin 的血中濃度、amoxicillin 胃液中濃度及胃液 pH 值,並進一步對照臨床效果 (除菌率) 與藥物體內濃度高於最低抑菌濃度以上時間的總和是否有正相關,或是另有影響因素。
一、Amoxicillin 體內濃度:血液中濃度
Amoxicillin 屬於時間依賴型抗生素,抗菌效力主要看藥物體內濃度高於最低抑菌濃度以上時間的總和 (%time above MIC),amoxicillin 在血中的半衰期短 (t1/2 = 1.5 hr),亦有學者指出多次服用 amoxicillin 可以增加%time above MIC,amoxicillin 500 mg QID的%time above MIC 應會比 amoxicillin 1000 mg BID 的%time above MIC 長 (圖一),檢驗 amoxicillin 給藥後在血液中的濃度應為最直觀的作法。
圖一 Amoxicillin 不同的給藥方案 (dosing scheme) 與 MIC 的關係12:500 mg QID 比1000 mg BID 的%time above MIC (total length of percent time above MIC) 長
二、Amoxicillin 體內濃度:胃液中濃度
除了檢測 amoxicillin 的血中濃度,應該還要更進一步檢測 amoxicillin 胃液中濃度。幽門螺旋桿菌是主要存活於胃粘膜層內或之下,因此受感染部位 (組織) 的抗生素濃度,比起血中的抗生素濃度,更是決定是否能夠控制感染的關鍵。
Nakamura M, et al. (2003) 比較血漿、胃黏膜及胃液中的抗生素濃度13。在服藥第7天檢測給藥後2小時的濃度:發現使用高劑量 amoxicillin (1000 mg BID) 者的胃液中濃度 (840.3 ± 802.3μg/mL) > 血漿中濃度 (3.6 ± 3.7μg/mL);使用低劑量 amoxicillin (750 mg BID) 者的胃液中濃度 (924.2 ± 900.0μg/mL) > 血漿中濃度 (1.9 ± 2.6 μg/mL),胃液中濃度比血漿中濃度高出許多。而在給藥後6小時的濃度:使用高劑量 amoxicillin (1000 mg BID) 者的胃液中濃度 (7.5 ± 7.7 μg/mL) > 血漿中濃度 (4.0 ± 3.2 μg/mL);使用低劑量 amoxicillin (750 mg BID) 者的胃液中濃度 (1.8 ± 1.7 μg/mL) < 血漿中濃度 (2.9 ± 1.8μg/mL),給藥後6小時胃液中濃度雖然明顯降下來,但不論是胃液中抗生素濃度還是血漿中抗生素濃度,都超過 amoxicillin 的 MIC 值 (0.03 μg/mL, 標準情況下)。
此篇研究闡明 amoxicillin 給藥後的胃液中濃度比血漿中濃度高 (特別是給藥後2小時),並且不論給予高劑量或低劑量 amoxicillin 都可超過最小抑菌濃度,皆有足夠的%time above MIC,治療效果都足夠。但此篇研究只有檢測給藥後2小時和給藥後6小時的濃度,沒有檢測給藥後12小時的濃度,所以還是不能直接推論給藥後12小時有足夠的%time above MIC。筆者認為應該要把所有變因 (血中濃度、胃液中濃度、影響半衰期的胃液中 pH 值等) 都加進來,進一步檢測給藥後12小時的濃度,才能確定給藥後12小時有足夠的%time above MIC,待日後研究進一步探究。
三、Amoxicillin 體內濃度:胃液 pH 值的影響
當胃液 pH 值由5.5升高至6.0時,amoxicillin 之 MIC90 (抑制90%病原菌的最低抑菌濃度)可自0.5 μg/mL 降至0.25 μg/mL;當胃液 pH 值由5.5升高至7.5時,amoxicillin 之 MIC90可自0.5 μg/mL 降至0.06 μg/mL14,MIC90數值越低,代表可達到 MIC 所需的濃度越低,%time above MIC 可以越長。檢測 amoxicillin 胃液中濃度及胃液 pH 值的變化,可以得知 amoxicillin 胃液中濃度有無受到胃液 pH 值改變的影響。
Erah PO, et al. (1997) 比較抗生素在緩衝水溶液 (pH 2.0)、胃液 (pH 2.0) 及胃液 (pH 7.0) 的半衰期15。Amoxicillin 原本在血中的半衰期很短 (t1/2 = 1.5 hr),但在緩衝水溶液 (pH 2.0)、胃液 (pH 2.0) 及胃液 (pH 7.0) 的半衰期分別為19.0 ± 0.2 hr、15.2 ± 0.3 hr、> 68 hr。可以得知 pH 值會改變 amoxicillin 胃液中的半衰期: 且胃液中 pH 值越高、在胃液中的半衰期越長,高於 amoxicillin 在血中的半衰期。
肆、結論
未來如果要再進行相關研究比較每日服用多次與每日服用二次 amoxicillin 對幽門螺旋桿菌除菌率,本文認為除了需同時控制所有的影響因子 (抗生素之抗藥性、PPI 的代謝速率、病人服藥順從性等),也應一併檢測 amoxicillin 在體內的濃度:amoxicillin 的血中濃度、amoxicillin 胃液中濃度及胃液 pH 值,並進一步對照臨床效果 (除菌率) 與藥物體內濃度高於最低抑菌濃度以上時間的總和是否有正相關。
Study Suggestion of Helicobacter pylori Eradication Rates Versus Amoxicillin's Dosing Scheme
Yi-Yen Chen, Po-Min Shu, Chi-Ting
Tseng
Department of Pharmacy, Taipei City Hospital
Yangming Branch
Abstract
Helicobacter pylori is the common reason to cause chronic gastritis, peptic ulcer disease, and eventually gastric carcinoma. The first-line treatment for Helicobacter pylori infection recommended by American College of Gastroenterology is “Triple proton pump inhibitor/clarithromycin/amoxicillin therapy”, twice-daily of proton pump inhibitor, clarithromycin, and amoxicillin. The results of two studies about the effect of multiple-times-daily amoxicillin on eradication rates of Helicobacter pylori stay inconsistent. However, in the perspective of pharmacodynamics-pharmacokinetics, amoxicillin is a time-dependent antibiotic which has a short half-life. In theory, multiple-times-daily amoxicillin can reach longer total length of percent time above minimum inhibitory concentration than twice-daily amoxicillin, which contributes to better antibacterial effect and higher eradication rate. It is suggested to measure amoxicillin concentrations in plasma, gastric juice and the pH vales in gastric juice. Therefore, we would like to know whether the relationship between clinical effects (eradication rate) and total length of percent time above minimum inhibitory concentration in vivo is positively correlated.
參考資料:
1. Crowe SE: Helicobacter infection, chronic inflammation, and the development of malignancy. Curr Opin Gastroenterol. 2005; 21(1): 32-8.
2. Hooi JKY, Lai WY, Ng WK, et al: Global Prevalence of Helicobacter pylori Infection: Systematic Review and Meta-Analysis. Gastroenterology. 2017; 153(2): 420-429.
3. Pounder RE, Ng D: The prevalence of Helicobacter pylori infection in different countries. Aliment Pharmacol Ther. 1995; 9(Suppl 2): 33-9.
4. Torres J, Leal-Herrera Y, Perez-Perez G, et al: A community-based seroepidemiologic study of Helicobacter pylori infection in Mexico. J Infect Dis. 1998 ;178(4):1089-94.
5. Chey WD, Leontiadis GI, Howden CW, Moss SF: ACG Clinical Guideline: Treatment of Helicobacter pylori Infection. Am J Gastroenterol. 2017; 112(2): 212-239. doi: 10.1038/ajg.2016.563.
6. Luther J , Higgins PD , Schoenfeld PS, et al: Empiric quadruple vs. triple therapy for primary treatment of Helicobacter pylori infection: Systematic review and meta-analysis of effi cacy and tolerability . Am J Gastroenterol 2010 ; 105 : 65-73.
7. Hu CT, Wu CC, Lin CY, Cheng CC, Su SC, Tseng YH, Lin NT: Resistance rate to antibiotics of Helicobacter pylori isolates in eastern Taiwan. J Gastroenterol Hepatol. 2007 May;22(5):720-3.
8. Furuta T, Ohashi K, Kosuge K, et al: CYP2C19 genotype status and effect of omeprazole on intragastric pH in humans. Clin Pharmacol Ther. 1999 May;65(5):552-61.
9. Furuta T, Shirai N, Takashima M, et al: Effect of genotypic differences in CYP2C19 on cure rates for Helicobacter pylori infection by triple therapy with a proton pump inhibitor, amoxicillin, and clarithromycin. Clin Pharmacol Ther. 2001 Mar;69(3):158-68.
10. Kim SY, Lee SW, Jung SW, et al: Comparative study of Helicobacter pylori eradication rates of twice-versus four-times-daily amoxicillin administered with proton pump inhibitor and clarithromycin: a randomized study. Helicobacter. 2008; 13(4): 282-7.
11. Furuta T, Sugimoto M, Yamade M, et al: Effect of dosing schemes of amoxicillin on eradication rates of Helicobacter pylori with amoxicillin-based triple therapy. J Clin Pharmacol. 2014; 54(3): 258-66.
12. Furuta T, Graham DY.: Pharmacologic aspects of eradication therapy for Helicobacter pylori Infection. Gastroenterol Clin North Am. 2010 Sep;39(3):465-80.
13. Nakamura M, Spiller RC, Barrett DA, et al: Gastric juice, gastric tissue and blood antibiotic concentrations following omeprazole, amoxicillin and clarithromycin triple therapy. Helicobacter. 2003 Aug;8(4):294-9.
14. 林俊谷,許秉毅,曾暉華:幽門螺旋桿菌除菌治療之新進展。內科學誌;2010年;第二十一卷四期:252-257頁。
15. Erah PO, Goddard AF, Barrett DA, Shaw PN, Spiller RC: The stability of amoxycillin, clarithromycin and metronidazole in gastric juice: relevance to the treatment of Helicobacter pylori infection. J Antimicrob Chemother. 1997 Jan;39(1):5-12.
通訊作者:曾啓庭/通訊地址:台北市士林區雨聲街105號
服務單位:臺北市立聯合醫院陽明院區藥劑科藥師/聯絡電話:(O) 02-28353456 ext 6123