C型肝炎全口服新藥簡介
戴德森醫療財團法人嘉義基督教醫院藥劑部藥師 洪瑄佑、林慧娟
摘要
臺灣自2017年1月起,衛生福利部中央健康保險署依「C 型肝炎全口服新藥健保給付執行計畫」給付新型直接抗病毒(direct-acting antiviral, DAA)藥物,目標全面性根除C型肝炎病毒(Hepatits C virus, HCV),避免日後肝硬化和肝癌所衍生之社會、醫療資源的耗費。
至今已開放給付九個DAA藥物,依給付順序為daklinza、sunvepra、viekirax、exviera、zepatier、harvoni、sovaldi、maviret、epclusa,台灣初上市藥物daklinza、sunvepra、viekirax、exviera 只能治療單一基因型HCV genotype 1a,1b,而後新藥不斷開發,治癒的基因型涵蓋越來越廣,現今 maviret、epclusa已能治療HCV全基因型(pan-genotype)。
關鍵字:直接作用抗病毒藥物 (Direct-acting antiviral agent, DAA)、C型肝炎、HCV
壹、前言
C型肝炎病毒(Hepatits C virus, HCV) 傳染途徑主要藉著血液再經由皮膚或黏膜進入體內而傳染1,急性C肝病毒感染後有70%到80%的人會變成為慢性C肝病毒感染,HCV感染後發生肝硬化前,約有20到25年的停滯時間,較嚴重的如末期肝病end stage liver disease(ESLD)和肝癌hepatocellular carcinom(HCC)可能發生在初感染後第30到40年2。
在臺灣,成年人口中約有4%是慢性C型肝炎患者,約40-70萬人3,過去調查顯示臺灣C型肝炎盛行率有區域差異,C型肝炎個案多集中在中南部沿海地區,依據國內研究調查顯示,愛滋病毒(Human immunodeficiency virus,HIV) 感染者中,靜脈注射藥成癮者合併感染C型肝炎的盛行率高達90%以上1。
貳、 C肝炎全口服新藥藥品給付規定
C肝炎全口服新藥給付始於2017年1月24日,初參加「全民健康保險加強慢性B型及C型肝炎治療計畫」成人慢性HCV患者,須符合下列條件:(1) 超過六個月的Anti-HCV陽性或HCV RNA呈陽性、(2)無肝功能代償不全之病毒基因型、(3)經由肝組織切片或肝臟纖維化掃描或FIB-4證實,等同METAVIR system≧F3,(4)超音波診斷為肝硬化併食道或胃靜脈曲張,或肝硬化併脾腫大;醫師每次開藥以4週為限,若4週後未能下降> 2 log 病毒量(下降<100倍)者,視為治療無效,應停止治療,給付不超過6週 4;病人於初始用藥前、每次回診用藥前,應具備完整藥品交互作用評估,且個案僅能選用一種藥物治療,不可同時併用其他DAAs藥物,給付以一個療程為限,完整療程以同一位醫師、於同家醫事服務機構完成照護3。
口服新藥不斷推陳出新,除了擴大治療HCV基因型、療程週數縮短,更降低藥物交互作用及增加服藥順從性,2019年1月1日曾放寬給付條件,不再設限肝纖維化,只要確認感染慢性C肝,均可納為給付對象5;但於2019年9月18日修訂版本,自108年9月20日起至108年12月31日止之新收個案,須符合 「經由肝組織切片或肝臟纖維化掃描或FIB-4證實,等同METAVIR system纖維化≧F3;超音波診斷為肝硬化併食道或胃靜脈曲張,或肝硬化併脾腫大」3。
最新C型肝炎全口服新藥藥品給付規定(2019年12月31日修訂版本)7,一旦確認感染慢性HCV,即可給付DAAs藥物給予治療,個案依然只能選一種藥物治療,不可併用其他DAAs藥物,並由同一位醫師、同家醫療機構完成所有療程及照護,新版執行計畫中提及「daklinza + sunvepra」治療組合, 2019年9月20日以後不得收取新個案3,亦於2020年3月1日停止給付該藥品所有療程6。
參、 DAA藥理機轉
C型肝炎病毒屬正向單股核糖核酸(RNA)病毒,其基因體(Genome) 可切割成結構蛋白與非結構蛋白,DAA藥物主要作用在HCV非結構蛋白NS3A、NS4A、NS5A、NS5B上,干擾病毒RNA複製過程,其中NS3/4A蛋白酶抑製劑,機轉為阻斷病毒酶活化位,這類藥物名通常以previr結尾(-previr),藥物有asunaprevir、grazoprevir、paritaprevir/ritonavir、glecaprevir;NS5A抑制劑,機轉為阻止複製複合體、病毒粒子組裝和釋放,這類藥物名通常以asvir結尾(-asvir),藥物有daclatasvir、ombitasvir、elbasvir、ledipasvir、pibrentasvir、velpatasvir;NS5B核苷酸抑製劑、NS5B非核苷酸抑製劑,作用在異位點,機轉為改變三維立體結構,影響病毒基因體複製,這類藥物名通常以buvir結尾(-buvir),藥物有sofosbuvir、dasabuvir (圖一)8。
圖一 DAA於HCV作用位置8
肆、 C型肝炎全口服藥物簡介
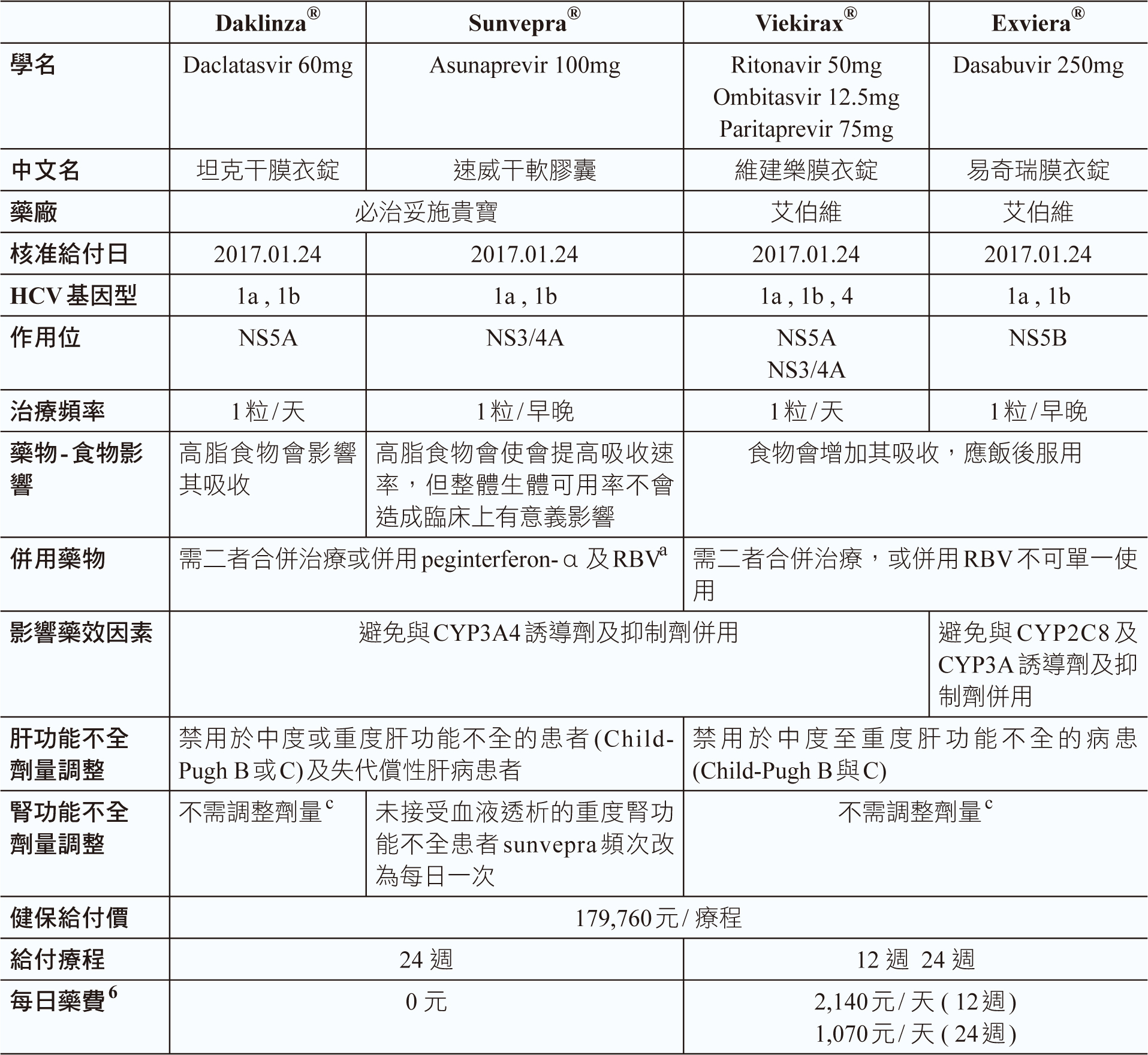
台灣自2017年起,衛生福利部中央健康保險署陸續開放給付DAA藥物治療HCV,DAA藥物交互作用繁複可能影響藥效,故於病人開始用藥前、每次回診用藥前,須完整評估藥品交互作用,於2017年1月24日最先核准給付藥物為Daklinza® (每錠含daclatasvir 60mg)、Sunvepra® (每錠含asunaprevir 100mg), daclatasvir和asunaprevir主要由CYP3A的作用受質經CYP3A4進行代謝,應避免與其誘導劑及抑制劑併用;Viekirax® (每錠含ombitasvir 12.5mg、paritaprevir 75mg、ritonavir 50mg),ritonavir並非抗HCV的活性藥物,為CYP3A抑制劑,會增加 CYP3A受質 paritaprevir的全身性曝露量Ritonavir為CYP3A抑制劑; Exviera® (每錠含dasabuvir 250mg),經CYP2C8及CYP3A代謝,應避免與影響藥物同時服用;daklinza需與sunvepra、viekirax與exviera併用,不可單一使用,治療標的同為HCV genotype 1a、1b型感染,藥物食物併服亦會影響吸收。
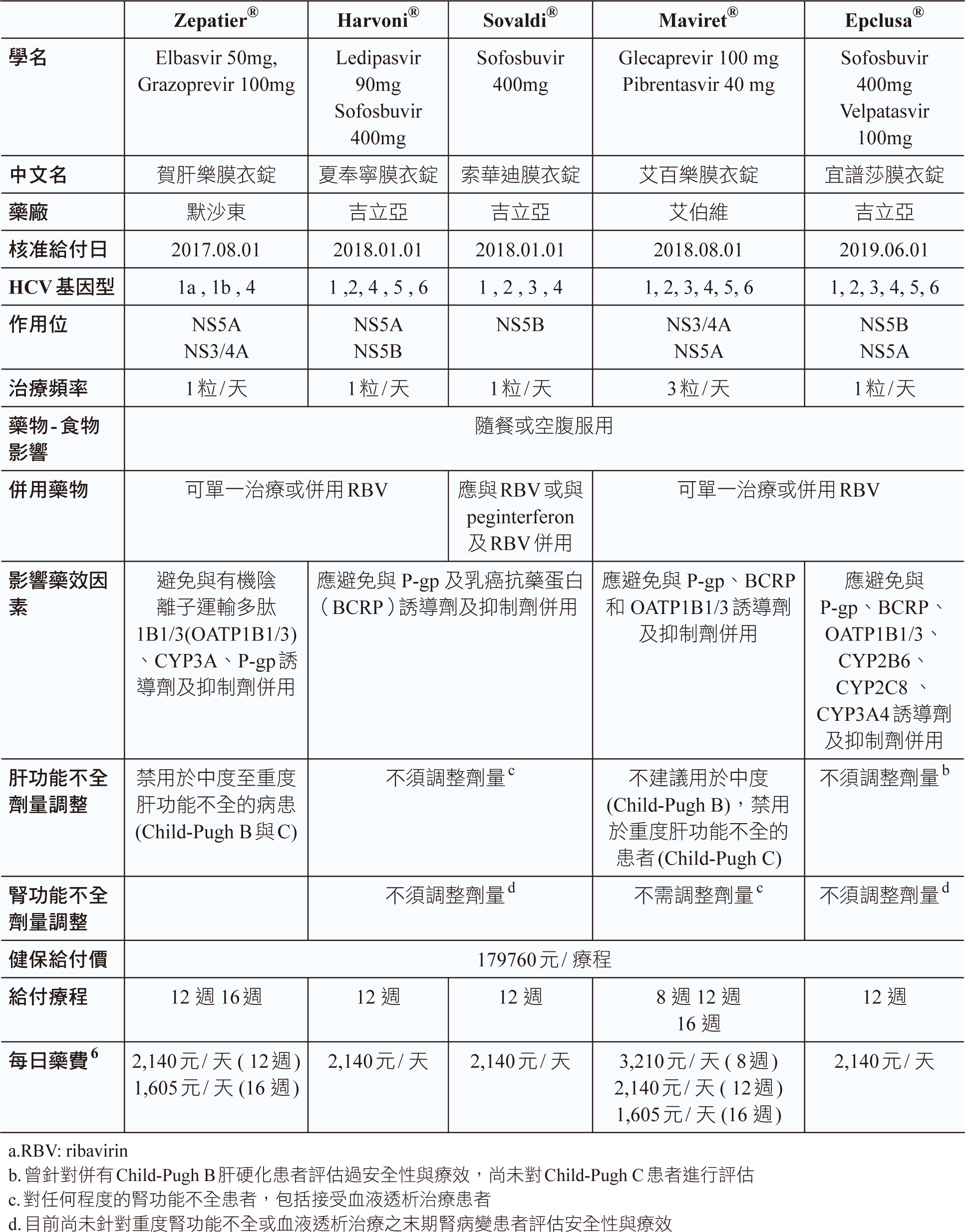
2017年8月後新核准的藥物可治療的基因型更廣,服藥頻率降低,只需每日服用一次,且吸收不受食物併服影響,可隨餐或空腹服用,同年8月1日給付Zepatier®(每錠含elbasvir50mg、grazoprevir100mg) 可治療HCV genotype 1a、1b、4之感染,grazofprevir是有機陰離子運輸多肽(organic anion transporting polypeptide, OATP) 運輸蛋白的作用受質,grazofprevir、efavirenz皆是CYP3A與P-醣蛋白(P-glycoprotein, P-gp)的作用受質。
2018年1月1日,給付Harvoni® (每錠含ledipasvir 90mg、sofosbuvir 400mg)治療HCV genotype 1、4、5、6之感染, Sovaldi®(每錠含sofosbuvir 400mg)治療HCV genotype 1、2、3、4型之感染, ledipasvir 與 sofosbuvir 皆為藥物運輸蛋白P-gp 及乳癌抗藥蛋白(breast cancer resistance protein, BCRP)的作用受質,應避免與其誘導劑及抑制劑併用。
2018年8月1日,健保給付Maviret® (每錠含glecaprevir 100mg、pibrentasvir 40mg),為第一個治療HCV genotype 1、2、3、4、5、或6 (全基因型)藥物,治療療程更縮短至8週,只是每次需服藥三粒,glecaprevir和pibrentasvir是P-gp和BCRP的受質,glecaprevir是OATP1B1/3的受質。
最新健保給付藥物Epclusa® (每錠含sofosbuvir 400mg、velpatasvir 100mg),給付始於2019年6月1日,與maviret相同為可針對HCV全基因型感染9,velpatasvir乃是藥物運輸蛋白P-gp、BCRP、OATP 1B1 及1B3 的抑制劑及作用受質,將epclusa 與屬於這些運輸蛋白之作用受質的藥物併用可能會升高這些藥物的暴露量。sofosbuvir與velpatasvir皆為藥物運輸蛋白P-gp與BCRP的作用受質。velpatasvir也是藥物運輸蛋白OATP1B 的作用受質,與同為作用受質的藥物併用,可能會升高這些藥物的暴露量。
於肝功能不全病人,除harvoni和sovaldi對輕度、中度或重度肝功能不全(Child-Pugh A、B或C級)皆不須調整劑量外,其他藥物皆只能用於輕度肝功能不全(Child-Pugh A級),不建議用於中度至重度肝功能不全的病患(Child-Pugh B與C);於腎功能不全病人,除sunvepra對未接受血液透析治療的重度腎功能不全患者須調整劑量,及harvoni目前尚未針對重度腎功能不全或血液透析治療之末期腎病變患者評估安全性與療效之外,其他藥物於不同程度腎功能不全患者皆不須調整劑量9。
C型肝炎全口服新藥完整治療療程,健保總給付額為199920元,依據投予藥物治療療程來均分每日藥費,目前給付療程分8、12、16、24週四種,每日給付額分別為3,210元、2,140元、1,605元、1,070元 (表一) 6。
表一 DAA藥物及藥品支付價格9
伍、 目前健保給付治療療程
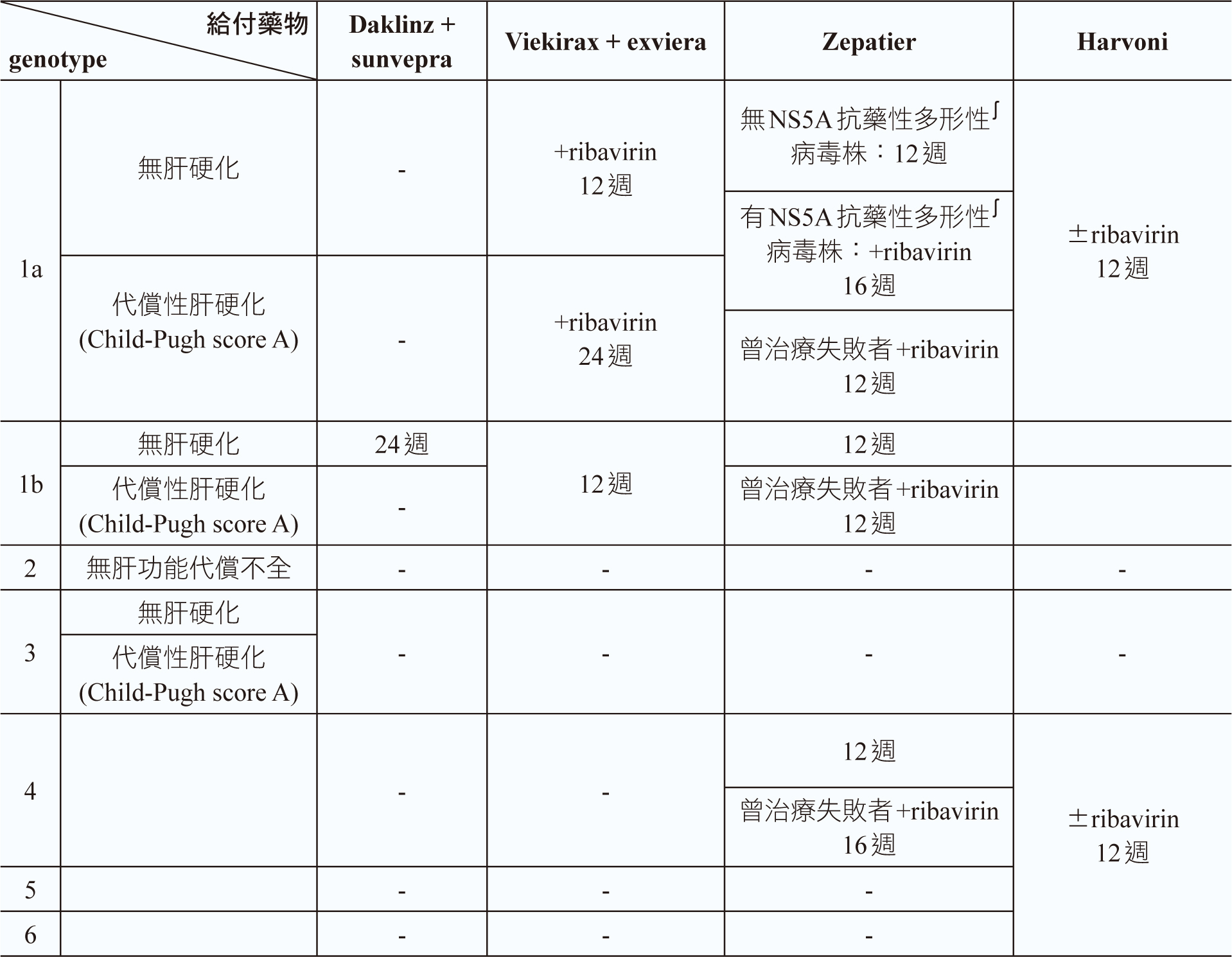
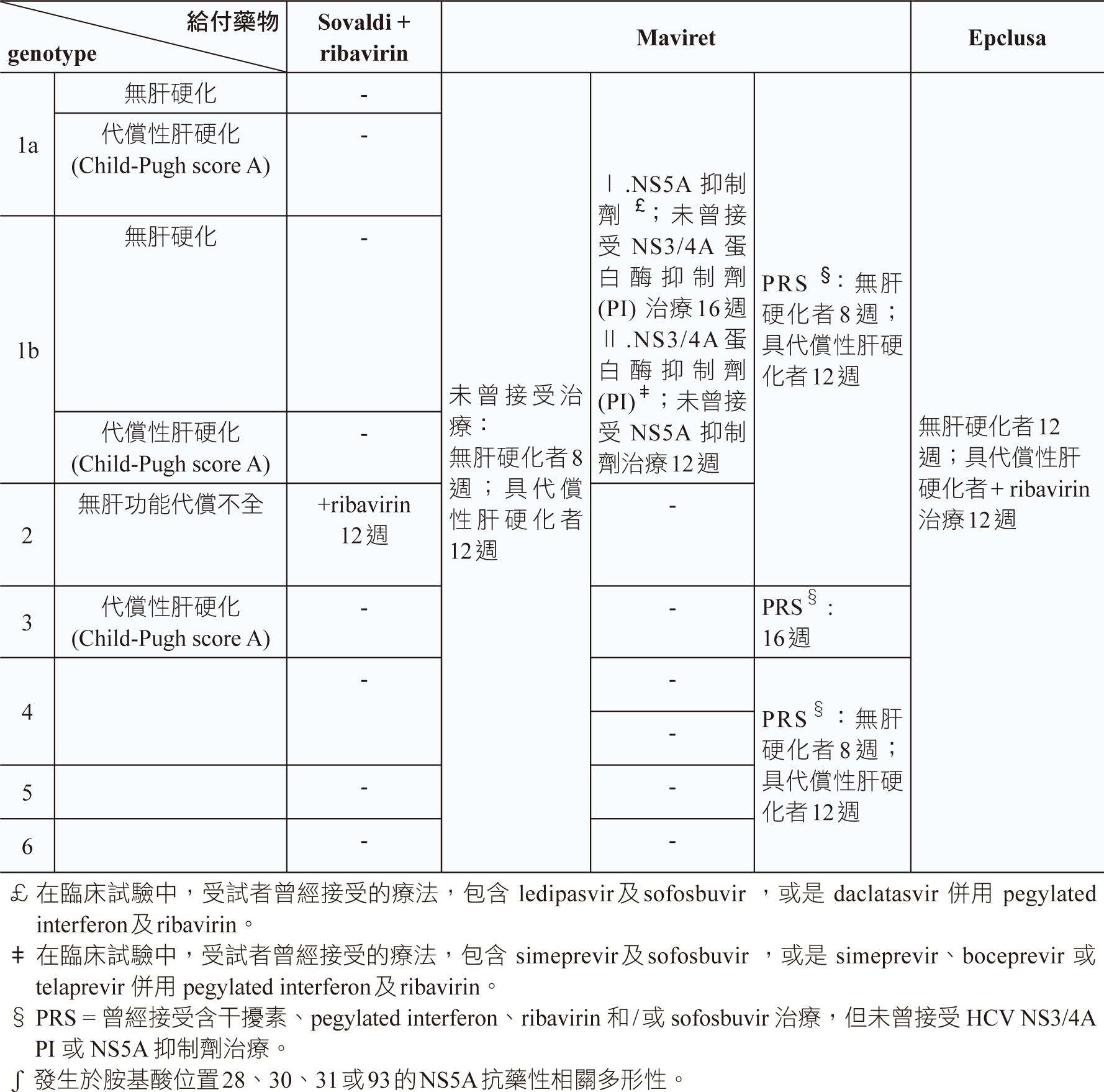
依目前「C型肝炎口服新藥健保給付執行計畫」治療組合有6:daklinz + sunvepra治療genotype 1b,24週療程;viekirax + exviera治療genotype 1b,無肝硬化或具代償性肝硬化12週療程;viekirax + exviera + ribavirin治療genotype 1a,無肝硬化12週療程,viekirax + exviera + ribavirin治療genotype 1a,代償性肝硬化24週療程;zepatier ± ribavirin治療genotype 1a,無抗藥性病毒,12週療程,zepatier ± ribavirin治療genotype 1a,有抗藥性病毒,16週療程;zepatier ± ribavirin治療genotype 1b,12週療程;zepatier治療genotype 4,12週療程;zepatier + ribavirin治療前曾使用interferon/ ribavirin/蛋白酶抑制劑(protease inhibitor)合併治療失敗者16週療程;harvoni ± ribavirin治療genotype 1、4、5或6,12週療程;sovaldi + ribavirin治療genotype 2,12週療程;maviret治療genotype 1、2、3、4、5或6病人,未曾接受過治療且無肝硬化者,8週療程,具代償性肝硬化(child-pugh score a)者,12週療程;maviret治療genotype 1、2、4、5或6,曾接受interferon或pegylated interferon治療,或sofosbuvir及ribavirin合併藥物治療病人,無肝硬化者8週療程,具代償性肝硬化(child-pugh score A)者,12週療程;maviret治療genotype 3,曾接受interferon或pegylated interferon治療,或sofosbuvir及ribavirin合併藥物治療,無肝硬化或具代償性肝硬化(child-pugh score A)者,16週療程;maviret治療genotype 1,曾接受ns3/4a蛋白酶抑制劑治療,但未曾接受ns5a抑制劑治療病人,12週療程;maviret治療genotype 1,曾接受ns5a抑制劑治療,但未曾接受ns3/4a蛋白酶抑制劑治療者,16週療程等;epclusa治療genotype 1、2、3、4、5或6,未曾與曾經接受治療,未併有肝硬化患者,12週療程;epclusa + ribavirin治療未曾與曾經接受治療且併有失代償性肝硬化的患者,12週療程 (表二) 5。
表二 C 肝炎口服新藥健保給付療程5
陸、 結論
DAA藥物的選擇考量包括:病人的HCV基因型、過去C肝藥物治療史、是否具有NS5A抗藥性多形性病毒株、肝腎功能、以及共病症治療藥物的交互作用評估等,目前「C 型肝炎全口服新藥健保給付執行計畫」藥品治療組合共16組醫令代碼,依處方天數申報藥費,「Daklinza + Sunvepra」治療組合,2020年3月1日健保停止給付該藥品治療組合6,日後HCV治療藥物將以後期上市藥品為主流。
Introduction of direct-acting antiviral agent for hepatitis C
Hsuan-Yu Hung, Hui-Chuan Lin
Department of Pharmacy, Ditmanson Medical Foundation Chi-Yi Christian Hospital
Abstract
Since January 2017, the Coverage of oral drug treatments for Hepatitis C in the National Health Insurance is approved in Taiwan, the new therapeutic drug:direct-acting antiviral (DAA) agent : daklinza, sunvepra, viekirax, exviera, zepatier, harvoni, sovaldi, maviret and epclusa. Major focused HCV genotypes from genotype 1a,1b to pen-genotype.
After oral drug treatments for hepatitis C entered the Taiwanese market, the goal is to eradicate hepatitis C virus and avoid the consumption of social and medical resources derived from cirrhosis and liver cancer in the future.
參考資料:
1. 衛生福利部疾病管制署 2016:傳染病防治工作手冊。
2. Lingala S, Ghany MG. Natural History of Hepatitis C. Gastroenterol Clin North Am. 2015;44:717-34.
3. 衛生福利部疾病管制署:C型肝炎全口服新藥健保給付執行計畫。引見於 十一月28, 2019.
4. 衛生福利部中央健康保險署:C型肝炎全口服新藥藥品給付規定。引見於 五月12, 2018.
5. 衛生福利部中央健康保險署:C型肝炎全口服新藥藥品給付規定。引見於 十一月28, 2019.
6. 衛生福利部中央健康保險署:C型肝炎全口服新藥健保給付執行計畫。引見於 三月23, 2020.
7. 衛生福利部中央健康保險署:C型肝炎全口服新藥藥品給付規定。引見於 三月23, 2020.
8. PeralesC, QuerJ, GregoriJ, et al: Resistance of Hepatitis C Virus to Inhibitors: Complexity and Clinical Implications. Viruses. 2015;7(11):5746–5766.
9. 衛生福利部中央健康保險署:健保用藥品項查詢.。取自http://www.nhi.gov.tw/QueryN/Query1.aspx.
通訊作者:洪瑄佑/通訊地址:嘉義市東區忠孝路539號 藥劑部
服務單位:戴德森醫療財團法人嘉義基督教醫院藥劑部/聯絡電話:(O) 05-2765041 ext
5131