疑似Pembrolizumab及Olaparib
引起間質性肺炎案例報告
鄭詩穎、王爾瑩、孫國倫、陳必立
台北醫學大學附設醫院藥劑部
摘要
藥物引發之間質性肺炎(interstitial lung disease,ILD)是癌症治療的一大挑戰。隨著標靶藥物及免疫檢查點藥物(immune checkpoint inhibitors,ICIs)問世,這些新興抗腫瘤藥物引發之間質性肺炎也逐漸受到重視。本文討論之案例描述一子宮內膜癌併有肺轉移之35歲女性,在使用olaparib之4周後出現呼吸困難症狀,懷疑疾病進展來院檢查,經正子電腦斷層掃描(positron emission tomography/computed tomography,PET/CT)診斷為治療導致之間質性肺炎,在經驗性抗生素及高劑量類固醇治療後快速緩解。在開始olaparib治療前,此案例曾接受多線的化療及包含pembrolizumab在內之ICIs,就藥物使用次數及時序性來看,pembrolizumab與此不良反應有高度相關性。
兩個藥物所導致之ILD中,其臨床症狀大都以乾咳及呼吸困難表現,但發生之嚴重度及時間則略有差異:ICIs多導致非嚴重不良反應,發生時間可能為用藥後數天至數年;olaparib目前已知的案例並無傾向哪種嚴重度,其發生時間則落在開始用藥6周左右。當診斷為藥物導致之ILD,須立即停止懷疑藥物,並給予高劑量類固醇及支持性療法。重新使用懷疑藥品在一般情況並不建議嘗試,除非沒有替代藥物可以選擇,且必須謹慎評估其風險效益。
關鍵字: 間質性肺炎、Interstitial lung disease、Immune checkpoint inhibitor、Pembrolizumab、Olaparib
壹、前言
癌症治療近年除傳統化療藥物,標靶藥物及免疫檢查點抑制劑(immune checkpoint inhibitors,ICIs)的使用也日益廣泛,治療期間出現的少見副作用也逐漸被發現。藥物引發之間質性肺炎(interstitial lung disease,ILD)是癌症治療的一大挑戰,不僅會造成治療中斷,更使治療死亡率上升。間質性肺炎為ICIs所造成之免疫相關副作用之一,其發生率甚至較化療藥物來得高1,由於發生時間從用藥後數天至數年間皆有可能,使診斷變得困難。另一藥物olaparib為一PARP(poly ADP-ribose polymerase)抑制劑,可用於治療乳腺癌基因(breast cancer gene,BRCA)突變之乳癌及婦科癌症,在臨床試驗鮮少有肺毒性紀錄,上市後相繼有案例報告。本文討論一個疑似因pembrolizumab及olaparib造成間質性肺炎之案例回顧。
貳、案例簡述
本案例為一35歲子宮內膜癌女性,身高163 cm,體重68 kg。無抽菸歷史,過去病史為多發性關節炎及B肝帶原,長期接受hydroxycholoroquine、laflunomide以及entecavir等藥物治療。2019年3月診斷為子宮內膜癌併有子宮頸侵犯及外腸骨淋巴結轉移,分期為第三期(cT2N1M0,stage IIIC)。經歷手術根除性子宮切除及兩側骨盆淋巴腺切除,於2019年5月30日接受cisplatin同步放化療(3 cycles)接續paclitaxel-cisplatin化學治療(3 cycles)。2020年5月發現肺部轉移,接受放療及藥物治療,請參照表一,而後因疾病進展,於7月29日將藥物改為olaparib。
表一 轉移後癌症治療用藥
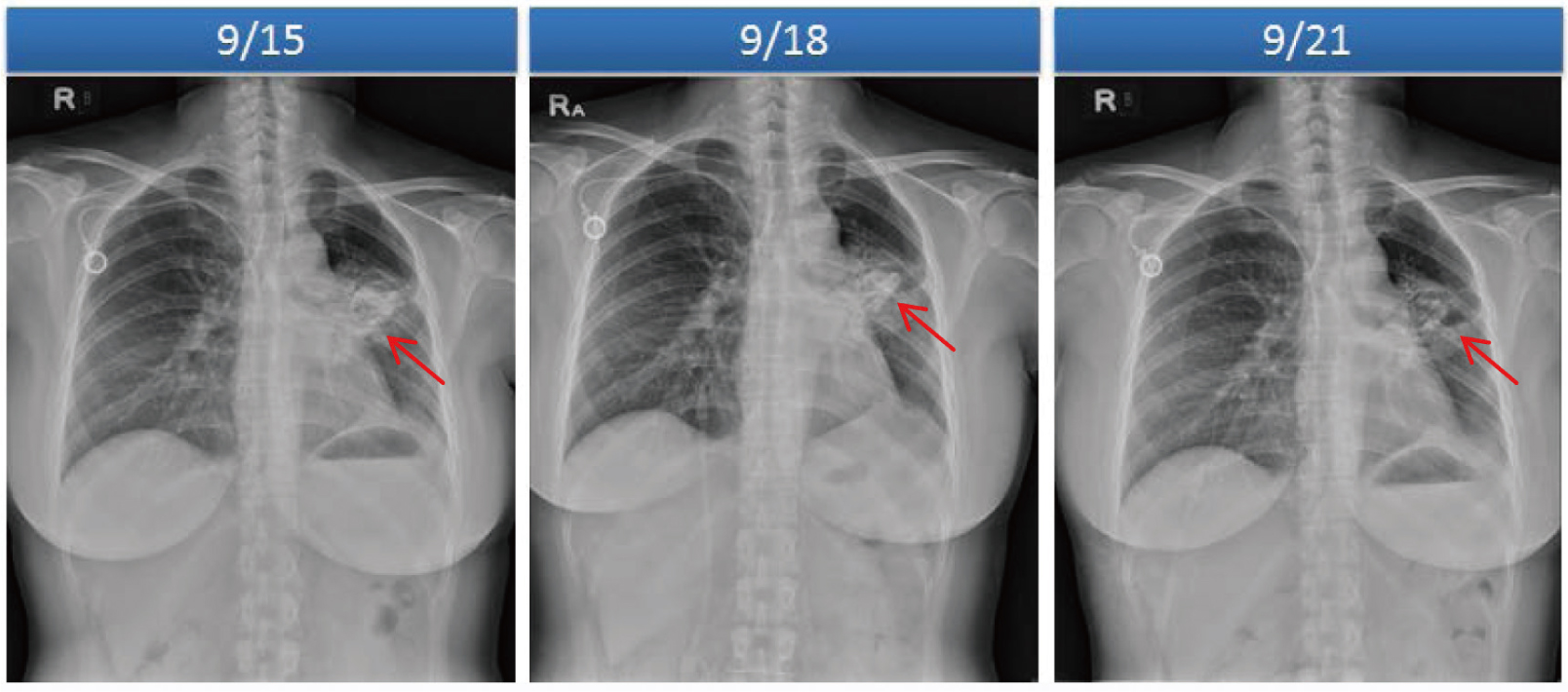
開始olaparib治療約4週後,病患出現呼吸困難情況,懷疑肺部轉移惡化。8月28日停用olaparib,前往本院諮詢第二意見。安排PET/CT檢查並於9月15日入院接受治療。入院當日意識清醒,呼吸喘伴有咳血,血氧正常(SpO2:97,room air),血壓114/79mmHg,心跳每分鐘118下,呼吸每分鐘24下,體溫36.4℃,血紅素11.9g/dL,其餘實驗診斷數值皆為正常。9月9日完成之PET/CT檢查顯示,肺雙側有氟18去氧葡萄糖(F-18-2-Fluoro-2-deoxy-D-glucose,F-18 FDG)攝取增加現象(圖一),以左下肺最嚴重,懷疑為治療造成之間質性肺炎。開始使用methylprednisolone (2mg/kg/day)及經驗性抗生素amoxicillin-clavulanic acid(1.2g Q8H)。9月18日胸部X光顯示肺部浸潤改善,因此繼續前述治療。於9月21日追蹤胸部X光又有進一步改善(圖二),臨床症狀有很大進步,將類固醇改為口服prednisolone(10mg BID),出院於門診追蹤。於9月29日調降prednisolone劑量至10mg QD,10月20日停用,停藥後影像檢查及臨床皆無惡化。因間質性肺炎完全緩解,影像報告發現新的腹股溝淋巴結腫大,於10月27日開始下一線治療(bevacizumab-atezolizumab),目前均無不良反應發生。住院期間之治療請見表二。
圖一 PET/CT
圖二 X光
表二 住院期間用藥清單
經評估不良反應發生之時間與時序性,可能性最高的兩個藥物為pembrolizumab及olaparib。
參、文獻回顧
一、Pembrolizumab
腫瘤細胞可藉由表現免疫檢查點受體programmed cell death-ligan 1(PD-L1或PDL1)與T細胞上之programmed cell death 1(PD-1或PD1)結合,達到抑制免疫系統活化來逃離免疫系統。ICIs的使用可重新活化免疫系統以達到攻擊癌細胞的目的。目前已上市之ICIs可分為anti-PD-1、anti-PD-L1及cytotoxic T lymphocyte antigen protein 4(CTLA-4或CTLA4)等三大類,pembrolizumab則屬於anti-PD-1。
這類藥品被觀察到造成各種免疫相關之副作用,特稱為免疫相關不良反應(immune-related adverse event,irAE)。一篇刊載於JAMA的meta-analysis,分析了轉移性固態腫瘤中使用anti-PD-1之臨床試驗中間質性肺炎的發生率:單用anti-PD-1組別之發生率為2.7%,併用其他藥品之組別,其發生率則上升到6.9%,其中肺癌及腎細胞癌不論在哪一組皆有較高的發生率2。另一篇觀察性研究收錄了1,826個使用ICIs的癌症病人,其間質性肺炎之發生率及死亡率分別為3.5%及9.4%,與過去臨床試驗中的數據相符。研究中觀察到,間質性肺炎的發生時間從2周到27.4個月皆有可能,但約有四成的人在用藥開始的前2個月就出現症狀3。這些研究中並沒有辨認出其他風險因子,但提到其他如抽菸、肺部疾病及胸部放射性治療可能是需要注意的族群。
二、Olaparib
Olaparib為一PARP抑制劑,核准於治療體細胞BRCA突變之乳癌及不論BRCA突變與否之卵巢癌。PARPs在體內負責修復複製錯誤或損傷之DNA,如在BRCA基因有缺陷的腫瘤細胞中抑制PARP的功能,就會使受損的DNA無法修復,造成DNA缺損累積,進而促使腫瘤細胞凋亡。
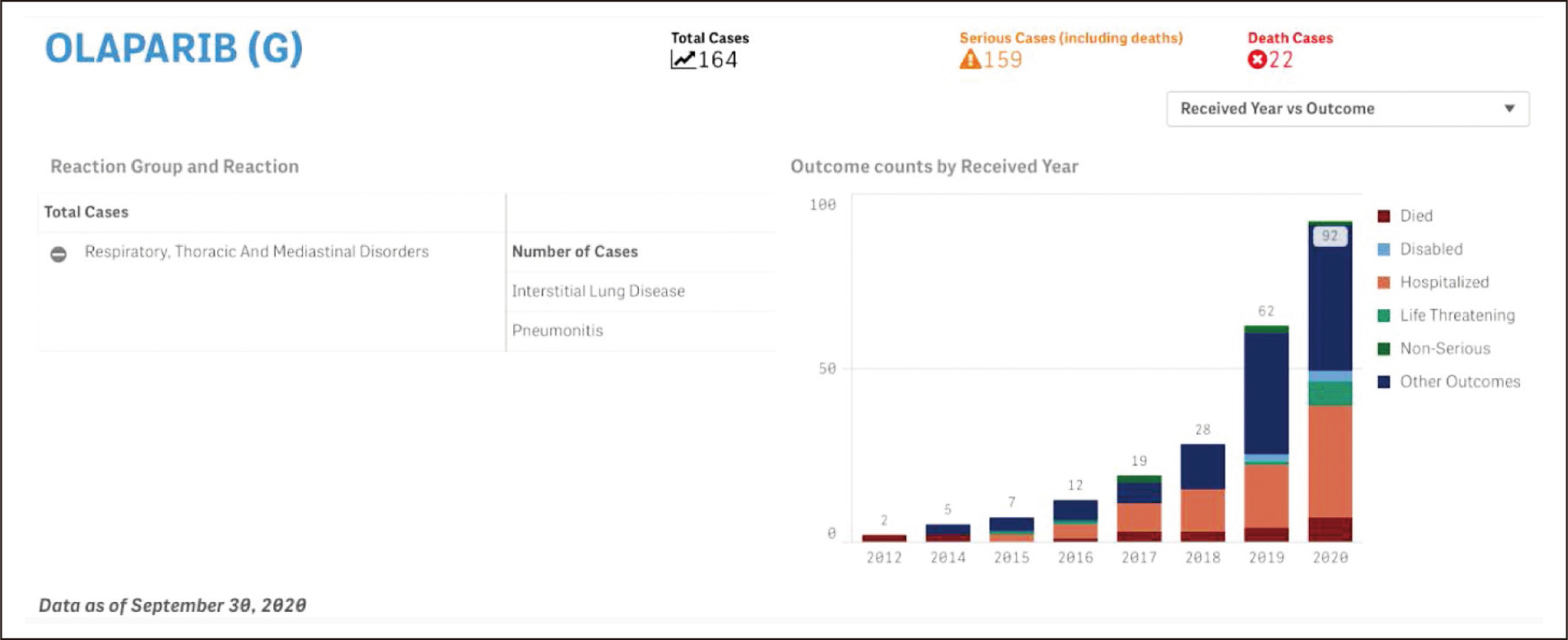
臨床試驗中鮮少通報關於olaparib之肺部不良反應,而dyspnea也只在小於1%之病人中出現。回顧過去文獻,有2篇olaparib造成間質性肺炎之案例報告:第一個案例為比利時的Grisay等人描述一71歲卵巢癌患者,在開始接受olaparib治療後4週出現呼吸短促症狀,2週後至醫院發現雙肺浸潤及血氧下降等情形,停藥給予抗生素無效後經高劑量類固醇(methylprednisolone,500mg TID)治療,在3天內得到症狀改善4。另一案例為日本的Suzuki等人描述一34歲肺及腦轉移之乳癌患者,於開始接受olaparib治療後6週後發生間質性肺炎,在停藥並給予類固醇後緩解5。搜尋美國FDA不良反應通報系統(FDA Adverse Event Reporting System,FAERS),自2012年來共有227件疑似olaparib造成interstitial lung disease或pneumonitis之通報案例(圖三),且近兩年之通報案件占68%,有逐年上升的趨勢。
圖三 FAERS通報olaparib與肺炎相關之案例
三、藥物引發間質性肺炎之診斷和處置
(一)診斷
藥物引發之間質性肺炎其臨床表現包含乾咳、呼吸困難,偶爾會伴隨發燒等症狀。由於目前缺乏特異性較高的檢驗方式,診斷藥物引發之間質性肺炎依然以排除其他可能因素為主。影像學方面,許多臨床上有間質性肺炎症狀的病人在胸部X光檢查為正常,CT則可以有效辨別肺部組織變化,在判別間質性肺炎上扮演重要角色。其他如支氣管肺泡灌洗(broncho-alveolar lavage,BAL)或肺部切片可用來輔助診斷間質性肺炎,但並無足夠證據支持作為其常規檢查6。
(二)處置
對於藥物引發之間質性肺炎,首要處理為停止懷疑藥物,並視臨床症狀給予類固醇以降低發炎反應,但針對是否可再度使用該藥品(rechallenge)或是類固醇之劑量,目前並無統一規範。
根據一篇系統性回顧,一般藥物所導致之間質性肺炎所使用之類固醇治療劑量及持續時間有很大的差異,可依據影像學及臨床症狀之嚴重度決定6。對於ICI所導致之間質性肺炎,係屬於這類藥品的irAE之一,已有臨床指引可參考其處置:以美國國家癌症資源網(National Comprehensive Cancer Network,NCCN)於2020年所發布的irAE指引為例7,當中度(grade 2)之pneumonitis發生時,須先停止ICIs之使用,並給予高劑量類固醇(prednisone/methylprednisolone 1-2mg/kg/day);如為重度以上(grade 3-4),除永久停用ICIs並給予高劑量類固醇外,在48小時內症狀未改善之患者需合併其他免疫抑制劑如infleximab或mycophenolate等共同治療。
四、懷疑藥物之rechallenge
目前針對此議題只有零星案例報告。這些案例所發生之間質性肺炎大多為輕症,且多集中在與酪胺酸激酶抑制劑及ICIs導致之間質性肺炎上。Ohnishi等人曾描述27例發生imatinib造成間質性肺炎之案例中,11人重新給予imatinib,有4人再次出現間質性肺炎症狀8。Nitawaki等人則提出2例使用osimertinib後所發生之間質性肺炎,在類固醇治療後rechallenge成功9。ICIs所引發之間質性肺炎也有部分成功案例:Naidoo等人所做之大型回溯性研究中,提到43個使用anti-PD-1或anti-PD-L1發生間質性肺炎後,12人嘗試再次投藥,有3人發生間質性肺炎復發10。關於ICIs之rechallenge,一篇回溯性研究發現會導致較高的irAE發生率,但其中有20%的病人在rechallenge後所發生的irAE與原先不同11。這或許代表發生ICIs引發的pneumonitis族群,在重新給藥時並不一定會有pneumonitis復發的狀況。
重新使用懷疑藥品在一般情況並不建議嘗試,除非沒有替代藥物可以選擇,且必須謹慎評估其風險效益。如果經評估其好處遠大於可能造成間質性肺炎復發的風險,美國癌症免疫治療學會(Society for Immunotherapy of Cancer,SITC)建議,針對ICIs所造成pneumonitis之rechallenge,可考慮在症狀完全緩解之grade 2或少數已知ICIs對其有臨床效益的grade 3病人中嘗試12。
肆、案例討論
本案例在olaparib治療期間出現呼吸困難,懷疑為肺轉移惡化檢查後發現為治療導致的間質性肺炎。排除長期用藥,就時序性來說屬olaparib的可能性最高。但考量到藥物引起的間質性肺炎其發生時間可從數天到數月不等,如果有使用ICIs之病人甚至需要往前回溯一年以上。
在這之前,此案例在半年內曾接受多線癌症藥物治療。在此案例中,其他可能導致間質性肺炎的藥物包括atezolizumab(表三)、gemcitabine(表四)、docetaxel(表五)、pembrolizumab(表六)及olaparib(表七),其Narajo scale評估結果之對照表如表八。要依據用藥時間完全排除任何一個藥品幾乎不可能,我們以時序及藥物使用次數,將atezolizumab、gemcitabine及docetaxel列為可能性較低之藥品。
表三 Naranjo scale:atezolizumab
表四 Naranjo scale:gemcitabine
表五 Naranjo scale:docetaxel
表六 Naranjo scale:pembrolizumab
表七 Naranjo scale:olaparib
表八 藥物不良反應之Naranjo scale
本案例曾在不良反應發生約3個多月前使用一次atezolizumab,就時序性無法排除其可能性,但就上述觀察性研究中,大部分ICIs造成之間質性肺炎其發生時間約在2個月左右3,其可能性較近期使用的pembrolizumab低。
過去文獻中gemcitabine及docetaxel造成之間質性肺炎分為早發性及遲發性,早發性多發生在第一次接受藥物的數天內,遲發性則發生在開始數個療程後13。本案例僅於不良反應發生之6周前接受一次療程,時序性上較不符合,因此予以排除。
就時序性及過去報告,在此案例中olaparib及pembrolizumab是最有可能造成間質性肺炎之藥品,因此將本不良反應評為疑似olaparib及pembrolizumab造成之間質性肺炎。
伍、結論
隨著癌症治療進步,標靶藥物如ICIs類之免疫藥物之使用機會提升,也連帶使間質性肺炎這類少見但可能致命之副作用被發現的機率提高。癌症末期病人由於治療需要,很容易轉換或同時併用多種藥物,且藥物引起之間質性肺炎發生時間可能從用藥後數天至數年,因此要明確判斷是何種藥物造成實屬不易。當懷疑是藥物造成的間質性肺炎須提供快速排除感染等可能因素,並馬上停用懷疑藥物再合併類固醇治療。在症狀恢復後,如欲決定是否重新投與該藥物前必須謹慎評估其風險效益,包括間質性肺炎發生時之嚴重度、有無替代藥品等。本文所討論案例的臨床現況,希望可以藉回顧此案例讓日後遇到類似情況時,能多一個思考方向。
Case Report of Suspected Pembrolizumab and Olaparib Induced Interstitial Lung Disease
Shih-Ying Cheng, Er-Ying Wang, Kuo-Lun Sun,
Chia-Yu Lin, Bi-Li Chen
Department of Pharmacy, Taipei Medical
University Hospital
Abstract
Management of drug-induced interstitial lung disease (ILD) remains a big challenge during cancer treatment. After target therapy and immune checkpoint inhibitors (ICIs) having been approved in cancer treatment, drug related ILD was widely discussed among these novel antineoplastic agents. We reported a case of 35-year-old ovarian cancer patient with lung metastasis, who developed symptom of dyspnea after starting olaparib 4 weeks. PET/CT was done and treatment related ILD was suspected. She received multi-line cancer treatment of chemotherapy and ICI including pembrolizumab. Based on duration of drug exposure and cause-and-effect relationship of ILD, pembrolizumab and olaparib held the highest causality.
Common symptoms of ILD induced by olaparib or pembrolizumab in the literature included cough and dyspnea. But the onset time and severity was different between two drugs: ICIs usually carried mild severity while olaparib didn’t have a preference. The possible onset time of ICI induced ILD ranged from days to years, while olaparib induced ILD occurred 6 weeks after therapy. When drug induced ILD is suspected, we should discontinue the suspected drugs. Treatment with steroids and supportive care are also recommended. Drug rechallenge is not generally recommended, except second treatment choice is unavailable and risk-benefit has been weighted carefully.
參考資料:
1. Su Q, Zhu EC, Wu JB, et al. Risk of Pneumonitis and Pneumonia Associated With Immune Checkpoint Inhibitors for Solid Tumors: A Systematic Review and Meta-Analysis. Front Immunol. 2019;10:108.
2. Nishino M, Giobbie-Hurder A, Hatabu H, et al. Incidence of Programmed Cell Death 1 Inhibitor-Related Pneumonitis in Patients With Advanced Cancer: A Systematic Review and Meta-analysis. JAMA Oncol. 2016;2(12):1607-1616.
3. Delaunay M, Cadranel J, Lusque A, et al. Immune-checkpoint inhibitors associated with interstitial lung disease in cancer patients. Eur Respir J. 2017;50(2):1700050.
4. Grisay G, Percy C, Pierrard J, et al. A rare but life-threatening pneumopathy induced by Olaparib: From a clinical case to a review of literature. J Transl Sci. 2019;2:1-3.
5. Suzuki H, Oshino T, Hagio K, et al. Interstitial Pneumonia Caused by Olaparib during Treatment of Breast Cancer-A Case Report. Gan To Kagaku Ryoho. 2020;47(9):1351-1353.
6. Skeoch S, Weatherley N, Swift AJ, et al. Drug-Induced Interstitial Lung Disease: A Systematic Review. J Clin Med. 2018;7(10):356.
7. https://www.nccn.org/professionals/physician_gls/pdf/immunotherapy.pdf
8. Izumiyama N, Noguchi K, Takahashi H, et al. Successful reintroduction of mesylate imatinib after pneumonitis in two patients with gastrointestinal stromal tumor (GIST). Nihon Kokyuki Gakkai Zasshi. 2009;47(10):918-23.
9. Nitawaki T, Sakata Y, Kawamura K, et al. Case report: continued treatment with alectinib is possible for patients with lung adenocarcinoma with drug-induced interstitial lung disease. BMC Pulm Med. 2017;17(1):173.
10. Naidoo J, Wang X, Woo KM, et al. Pneumonitis in Patients Treated With Anti-Programmed Death-1/Programmed Death Ligand 1 Therapy. J Clin Oncol. 2017;35(7):709-717.
11. Pollack MH, Betof A, Dearden H, et al. Safety of resuming anti-PD-1 in patients with immune-related adverse events (irAEs) during combined anti-CTLA-4 and anti-PD1 in metastatic melanoma. Ann Oncol. 2018;29(1):250-255.
12. Puzanov I, Diab A, Abdallah K, et al. Managing toxicities associated with immune checkpoint inhibitors: consensus recommendations from the Society for Immunotherapy of Cancer (SITC) Toxicity Management Working Group. J Immunother Cancer. 2017;5(1):95.
13. Hamada T, Yasunaga H, Nakai Y, Isayama H, Matsui H, Fushimi K, Koike K. Interstitial lung disease associated with gemcitabine: A Japanese retrospective cohort study. Respirology. 2016;21(2):338-43.
通訊作者:鄭詩穎/通訊地址:台北市信義區吳興街252號
服務單位:臺北醫學大學附設醫院藥劑部/聯絡電話:(O) 02-27372181 ext 8435