膽道癌之精準醫療
鄭吉元1、蔡慈貞1,2、張文震3
1林口長庚紀念醫院藥劑部、2新生醫護管理專科學校、3林口長庚紀念醫院腫瘤科
摘要
膽道癌亦稱為膽管癌,是屬於預後差的癌症。病人從診斷到死亡通常不到兩年,全球的5年存活率只有10%。對於無法切除、晚期膽道癌的傳統治療是第一線給予化療藥gemcitabine併用cisplatin,但其成效不佳。近年來,隨著次世代基因定序檢測技術的創新發展,精準醫療成為癌症治療的新主流。膽道癌的基因異常包括突變、基因異常融合和拷貝數異常。由於膽道癌的腫瘤異質性大,腫瘤微環境因素以及複雜的分子生物學,使得至今只有pemigatinib核准上市,用來治療FGFR2基因融合的膽道癌患者。目前突破性的藥物有FGFR2抑制劑TAS120、PI3K/AKT/mTOR抑制劑copanlisib、MEK抑制劑selumetinib併用化療藥gemcitabine和IDH1抑制劑ivosidenib,以及MSI-H患者可給予免疫檢查點抑制劑。
關鍵字: 膽道癌、精準醫療、cholangiocarcinoma、bile duct cancer、precision medicine
壹、前言
膽道癌 (cholangiocarcinoma, CCA) 亦稱為膽管癌 (bile duct cancer),是屬於預後差的癌症。病人從診斷到死亡通常不到兩年,全球的5年存活率只有10%1。CCA根據發生的位置,可分為肝內膽管癌 (iCCA) 及肝外膽管癌 (eCCA),而eCCA又可分為肝門膽管癌 (pCCA) 及遠端膽管癌 (dCCA)。iCCA佔CCA的5~10%,pCCA 60~70%,dCCA 20~30%1。
對於無法切除、晚期CCA的傳統治療是第一線給予化療藥gemcitabine併用cisplatin,但其成效不佳1,2。因此,CCA的治療十分需要突破性的藥物。近年來,因為次世代基因定序技術的應用,增進我們對癌症分子生物學及其異常基因的瞭解,也開啟了針對異常基因之標靶藥物的研發。「精準醫療」乃是利用個人基因型或是基因表現及臨床資料資訊,選擇最適合個人使用之藥物、治療方法或預防方式,以期達到藥品最大療效與最小的副作用3。本文將探討CCA之精準醫療現況。
貳、膽道癌的分子生物學分類
根據CCA腫瘤組織出現的異常基因和臨床特徵可將CCA分為4群,見表一2。其中IDH1、IDH2、FGFR2、BAP1常出現在iCCA,而HER2、TP53則常出現在eCCA2。FGFR2基因異常融合 (FGFR2 fusion) 者,其預後最好2。基因縮寫的全名請見表二。
表一 膽道癌的分子生物學分類2
表二 基因縮寫的全名 (按照字母排列)
參、膽道癌的異常基因及試驗中的標靶藥物
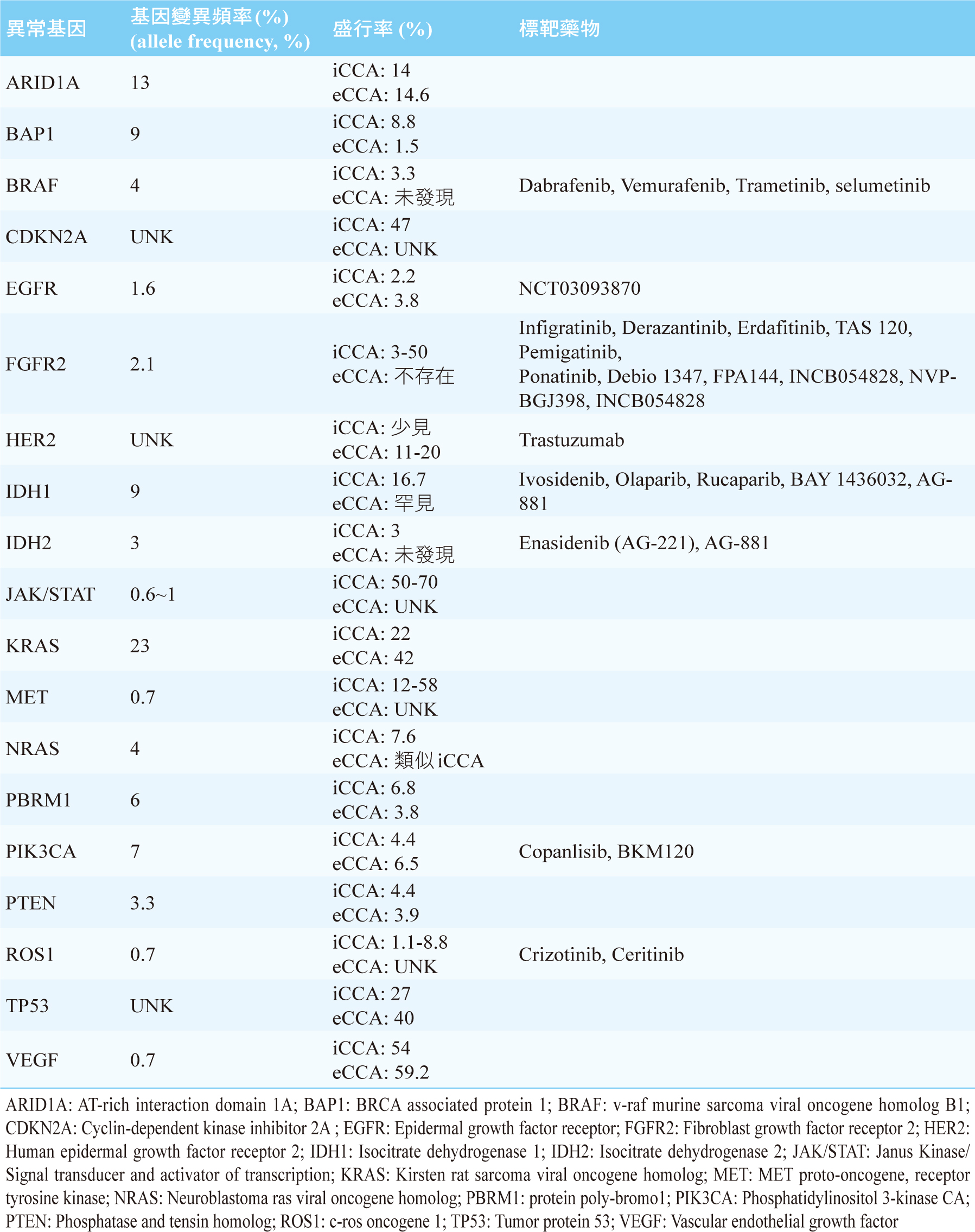
CCA的基因異常包括突變、基因異常融合和拷貝數異常放大,因而導致DNA修補、細胞週期調控、受體酪胺酸激酶訊息傳遞以及表觀遺傳學調控出現問題。有關CCA的異常基因及試驗中的標靶藥物,見表三1,2,4,5,6。
表三 膽道癌的異常基因及試驗中的標靶藥物1,2,4,5,6
一、FGFR2基因融合
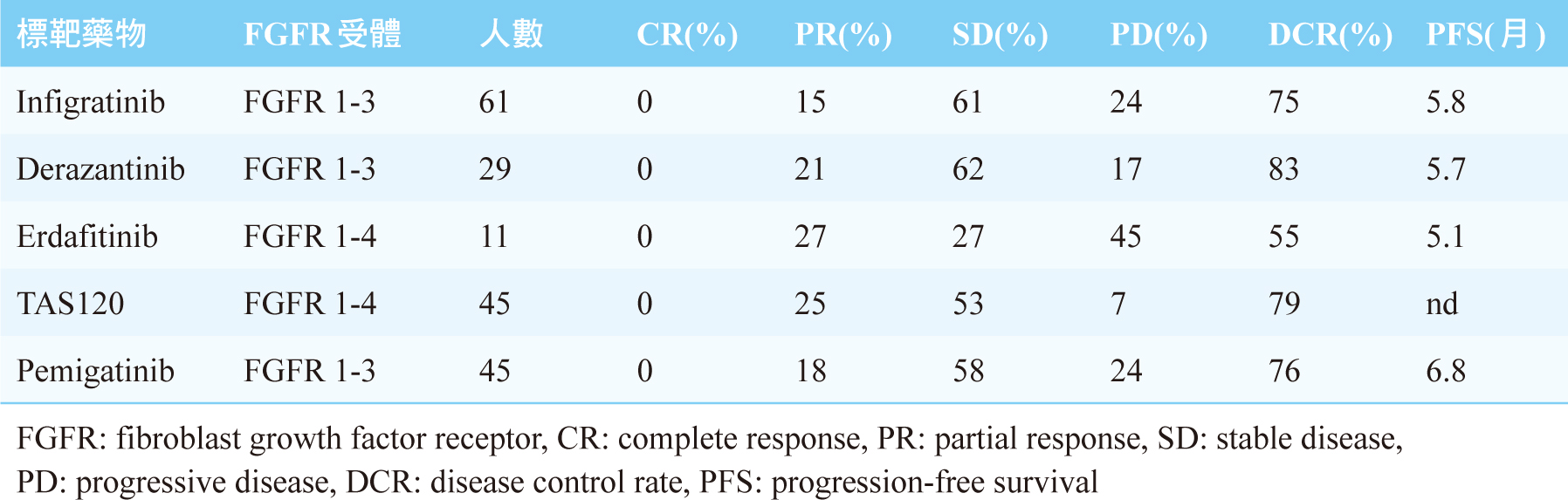
FGFR2基因融合 (FGFR2-BICCI, FGFR2-AHCYL1, FGFR2-TACC3, FGFR2-KIAA1598) 和iCCA的進展有密切的關係,針對此異常基因之小分子標靶藥物的臨床試驗結果,見表四2。初步結果顯示,疾病控制率 (DCR) 可達80%,無疾病惡化存活期 (PFS) 約6個月2。在治療CCA的標靶藥物中,FGFR抑制劑是相當具有潛力的藥物。2020年4月17日,美國FDA核准pemigatinib用來治療FGFR2基因融合的CCA患者。
表四 針對FGFR路徑之小分子標靶藥物的臨床試驗結果2
二、EGFR和HER2過度表現
EGFR過度表現罕見於CCA,而HER2過度表現則常發生在eCCA,盛行率為11~20%1,4。EGFR抑制劑erlotinib併用化療藥gemcitabine及cisplatin用於治療CCA的第三期研究結果顯示,相較於gemcitabine併用cisplatin組,額外加入erlotinib並沒有在PFS和整體存活期 (OS) 上看到成效1。單用HER2抑制劑trastuzumab治療CCA無效1。目前,正在進行中的第一期研究有trastuzumab併用RAS激酶抑制劑tipifarnib1。
三、VEGFR過度表現
CCA患者一半以上會呈現VEGFR過度表現1。然而,其基因變異頻率低1,表示此異常並不是主導基因。針對VEGF訊息傳遞路徑的標靶藥物bevacizumab、sorafenib、vandetanib、regorafenib、ramucirumab治療CCA的臨床試驗結果都不理想1。
四、RAS/RAF/MEK/ERK訊息傳遞路徑異常活化
CCA常見KRAS突變,目前尚無有效藥物來對付。BRAF突變只發生在iCCA,發生率只有3.3%1。使用BRAF抑制劑vemurafenib的合併療法來治療CCA有成功的個案報告1。目前,使用BRAF抑制劑治療CCA有第一、二期臨床試驗正在進行中1。研究發現,使用針對MEK的標靶藥物來治療CCA是具有前途的策略。MEK抑制劑selumetinib、trametinib都有看到成效。目前,正在進行中的第二期研究有selumetinib併用gemcitabine與單用gemcitabine的比較1。
五、PI3K/AKT/mTOR訊息傳遞路徑異常活化
PIK3CA此基因會轉譯成PI3K、PTEN突變會導致PI3K/AKT/mTOR訊息傳遞路徑異常。現階段,分別針對PI3K、AKT、mTOR皆有標靶藥物,如PI3K抑制劑copanlisib和BKM120、AKT抑制劑MK2206、mTOR抑制劑everolimus, 用於治療CCA的臨床試驗正在進行中1。
六、IDH1 / IDH2突變
IDH此酵素和細胞內葡萄糖代謝有關。IDH基因突變會引起細胞的葡萄糖代謝異常,導致DNA過度甲基化、細胞異常增生、血管生成1。IDH突變幾乎只出現在iCAA1。IDH1抑制劑ivosidenib (AG-120) 治療帶有IDH1突變之CCA患者的第一期研究結果顯示PR和DCR分別為6%和56%1。Ivosidenib之第三期臨床試驗ClarIDHy,這是一隨機雙盲針對具有IDH1突變者給予ivosidenib,對照組是安慰劑;結果發現ivosidenib組的PFS為2.7個月,安慰組為1.4個月 (HR 0.37, p<0.001);ivosidenib組的PR 2.4%、DCR 53.2%,安慰組的PR 0%、DCR 27.9%7,顯示ivosidenib有不錯的療效。目前ivosidenib被核准的適應症為治療帶有IDH1突變之急性骨髓性白血病 (AML) 患者8。此外,IDH2抑制劑enasidenib (AG-221) 和同時可以抑制IDH1和IDH2之泛IDH (pan-IDH) 抑制劑AG-881也都正在進行臨床試驗,用來治療CCA1。
七、染色質重塑相關基因的突變
染色質重塑是一種超越基因的機制,乃是利用修飾染色質方式來控制基因的活性。CCA患者可能會被檢測出染色質重塑相關基因的突變,這些基因包括ARID1A、ARID1B、ARID2、PBRM1、BAP1、SMARCA2、SMARCA4、SMARCAD11,4。針對染色質重塑相關基因突變的標靶藥物,使用DNA甲基轉移酶抑制劑decitabine和azacitidine以及組織蛋白脫乙醯酶抑制劑vorinostat、valproic acid、romidepsin和panobinostat是具有潛力的藥物1,4。
八、MSI-H
CCA患者若是屬於高度微衛星不穩定 (microsatellite instability-high, MSI-H) 者,可給予免疫檢查點抑制劑pembrolizumab9。
肆、結論
隨著人類基因的解碼,醫學已進入精準醫療時代。由於CCA的腫瘤異質性大,腫瘤微環境因素以及複雜的分子生物學,使得至今只有pemigatinib核准上市,用來治療FGFR2基因融合的CCA患者。換言之,CCA的精準醫療尚有一大段路要走。目前突破性的藥物有FGFR2抑制劑、PI3K/AKT/mTOR抑制劑以及IDH抑制劑。未來希望藉由對CCA基因表現有更多的瞭解、更多嶄新的標靶藥物研發以及依據不同的CCA基因型進行更多的個別臨床試驗,使得CCA之精準醫療可以更上一層樓。
Precision Medicine in Cholangiocarcinoma
Chi-Yuan Cheng1, Tzu-Cheng Tsai1,2, Wen-Cheng
Chang3
1Department of Pharmacy, Chang Gung Memorial
Hospital, Linkou
2Department of Long Term Care, Hsin Sheng Junior
College of Medical Care and Management
3Department of Oncology, Chang Gung Memorial
Hospital, Linkou
Abstract
Cholangiocarcinoma (CCA), also known as bile duct cancer, is a cancer with poor prognosis. Median survival of CCA is less than 2 years from the time of the diagnosis, and the global five-year survival is only 10%. First-line therapy with chemotherapeutic agents of gemcitabine plus cisplatin has been traditionally used in unresectable, advanced CCA. In recent years, precision medicine has become the new mainstream of cancer treatment because of innovative advent of next-generation sequencing technology. A number of genetic alterations, including mutations, gene fusions and copy number variations are found in CCA. Owing to the wide heterogeneity of the tumor, the tumor microenvironment factors and the complexity of tumor biology of CCA, only pemigatinib was approved for the treatment of CCA patients with FGFR2 fusion till now. Currently, the FGFR2 inhibitors such as TAS120, the PI3K/AKT/mTOR inhibitors such as copanlisib, the MEK inhibitors such as selumetinib plus chemotherapy with gemcitabine, and the IDH1 inhibitor with ivosidenib are the promising drugs in the management of CCA, and the immune checkpoint inhibitors may be administered for MSI-H patients.
參考資料:
1. Simile MM, Bagella P, Vidili G, et al: Targeted therapies in cholangiocarcinoma: Emerging evidence from clinical trials. Medicina 2019;55:42.
2. Mahipala A, Tellab SH, Kommalapatib A, et al: FGFR2 genomic aberrations: Achilles heel in the management of advanced cholangiocarcinoma. Cancer Treat Rev 2019;78:1-7.
3. 臺灣醫學會,閻雲,個人化醫療:基因學於臨床應用之整合。Available from: http://www.fma.org.tw/2015/bio-1.html Accessed Feb 24, 2020.
4. Pellino A, Loupakis F, Cadamuro M, et al: Precision medicine in cholangiocarcinoma. Transl Gastroenterol Hepatol 2018;3:40.
5. Simbolo M, Vicentini C, Ruzzenente A, et al: Genetic alterations analysis in prognostic stratified groups identified TP53 and ARID1A as poor clinical performance markers in intrahepatic cholangiocarcinoma. Sci Rep 2018;8:7119.
6. Rimassa L, Personeni N, Aghemo A, et al: The immune milieu of cholangiocarcinoma: From molecular pathogenesis to precision medicine. J Autoimmun 2019;100:17-26.
7. Abou-Alfa GK, Macarulla Mercade T, Javle M, et al: ClarIDHy: A global, phase III, randomized, double-blind study of ivosidenib vs placebo in patients with advanced cholangiocarcinoma with an isocitrate dehydrogenase 1 (IDH1) mutation. ESMO Congress 2019. Abstract LBA10_PR. Presented September 30, 2019.
8. Development history and FDA approval process for ivosidenib. Available from: https://www.drugs.com/history/tibsovo.html Accessed Feb 24, 2020.
9. NCCN Guideline: Hepatobiliary cancer (Version 4. 2019) Available from: https://www.nccn.org/professionals/physician_gls/pdf/hepatobiliary.pdf Accessed Feb 24, 2020
通訊作者:鄭吉元/通訊地址:桃園市龜山區復興街五號林口長庚醫院病理大樓6樓化療藥局
服務單位:林口長庚紀念醫院藥劑部/聯絡電話:(O) 03-3281200 ext 2915