摘要
肝性腦病變是肝硬化病人常見的併發症之一,由於病人肝臟解毒能力的下降,毒素的蓄積加上誘發因子,造成病人腦部病變,呈現意識紊亂的症狀。肝性腦病變的病因複雜,治療的結果關係於病人是否需要肝臟移植,醫療人員在診斷及治療上是一大挑戰。世界腸胃道協會依照病人肝功能損壞的情形將肝性腦病變分為三型,type A是急性肝衰竭病人,type B是門脈分流病人,type C是肝硬化病人。Type B及type C是慢性表現。本篇文章介紹type C肝性腦病變的致病機轉以及治療方法,以提供醫療人員作為參考。
關鍵字: 肝性腦病變、hepatic encephalopathy、肝硬化、liver cirrhosis
壹、前言
肝性腦病變(hepatic encephalopathy, HE)屬於嚴重進行性神經精神不正常及運動功能失調的疾病,隨著肝功能的好壞而具有可逆性,輕微者會有認知及運動功能上的改變,嚴重者恐會昏迷甚至死亡。患有肝硬化者有30%至45%機會併發肝性腦病變,門脈系統分流者則有10%至50%機會發生肝性腦病變1。
世界腸胃道協會依照病人肝功能損壞的情形將肝性腦病變分為三型,type A是急性肝衰竭病人,臨床呈現癲癇、肢體僵硬、昏迷,可能導致死亡。Type B及type C是慢性表現,症狀可能是偶發的或是持續進行2。偶發性的HE最為常見,意識的改變程度會隨著血氨值及肝功能的惡化情形而影響。對於偶發性的HE可給予治療或支持性療法,病人可以回復到正常的意識。
貳、病理機轉3
肝性腦病變的病因是多重因素影響的,包括氨(ammonia)的神經毒性、內生性benzodiazepine增加、星狀體細胞腫大、不正常的神經傳導物質。目前的研究結果仍堅信血氨值的升高導致大腦水腫是肝性腦病變的主要病因。HE的致病機轉曾經有不同的假說被提出,分別描述於下。
一、氨假說
氨是由蛋白質、胺基酸及氮基物質如glutamine、purines、pyrimidines 等分解產生的;這些物質可能來自於腸道、肌肉及腎臟(圖一),最主要是來自腸道;正常情況下,大部分的氨在肝臟會經由尿素循環轉換成尿素及glutamine;glutamine 也會在腎臟分解生成氨,參與尿素合成;患者因有門脈高壓及肝硬化產生側枝循環,腸道的氨繞過肝臟而分流至循環,導致血中的氨值增高;另外患者腸蠕動減慢,導致氨在腸道的產生增加,而且患者肌肉塊減少有營養不良的問題間接影響肌肉移除氨的能力。血中氨增加導致氨通過血腦屏障,氨是一種神經毒素會抑制細胞氯離子通道,因而中樞神經系統受到抑制。
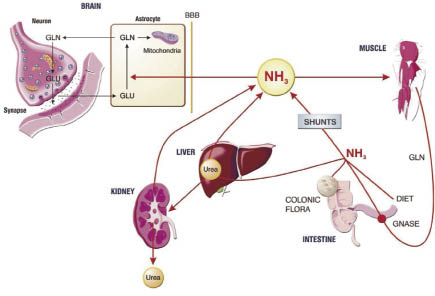
圖一 氨的生成來源圖
二、γ-aminobutyricacid(GABA)/Benzodiazepine(BD)假說
GABA是抑制性的神經傳導物質,腦中GABA濃度增加,就會促使GABA開啟在許多突觸後神經元細胞膜上的氯離子通道,因此降低神經細胞的興奮性。內生性的BD與GABA在腦部是同一接受器,在HE發現內生性的BD會增加GABA的傳遞並導致中樞抑制。
三、偽神經傳導物質假說4
肝衰竭時支鏈胺基酸(BCAA)如valine、leucine及isoleucine濃度減少,而芳香族胺基酸(AAA)如tyrosine、phenylalanine及tryptophan濃度增加;過多的AAA在腦部會被代謝成偽神經傳導物質,因為其分子結構類似真正的神經傳導物,故會替代真正的神經傳導物而抑制訊息的傳遞,如tryptophan可轉換為serotonin,而serotonin是控制睡眠/醒覺循環的物質。另外octopamine 含量增加,可代替真正神經傳導物質如norepinephrine及dopamine。
四、Manganese假說
Manganese正常是經由肝臟、膽道排泄出去,過多的Manganese 穿過腦部與dopamine接受器相競爭;HE的患者在基底神經節發現Manganese 的濃度增加。
參、臨床特徵與診斷
藉由腦電波圖、神經影像及血氨值的測得可篩選出HE。臨床表徵如:患者的記憶力、注意力及反應速度都會受到影響,可能會發生人格改變、睡眠型態改變(日夜顛倒)、肌肉協調缺失如asterixis俗稱肝性撲動(flapping tremor)、單調語音、肝臭味(fetor hepaticus)、面無表情、運用不能(apraxia)、深部肌腱反射異常(表一),HE的臨床表徵範圍相當廣泛,但沒有一種症狀是屬於特異性的臨床症狀。對於肝硬化病人,HE的預後情形將作為未來是否肝臟移植的評估方式之一。HE的診斷以下列作為依據:(1)病人是否有肝臟疾病或門脈分流。(2)藉由檢查了解病人是否神經或認知上的受損。(3)排除其他的腦病變。(4)辨認並矯正誘發因子(表二)。
表一 肝性腦病變的臨床特徵
1)單調語音、面無表情 |
2)運用不能 |
3)深部肌腱反射異常 |
4)肌肉協調缺失 |
5)運動障礙 |
6)過度換氣 |
7)癲癇 |
8)昏迷 |
表二 肝性腦病變的誘發因子
1.增加含氮負荷 (1)腸胃道出血 (2)過量的蛋白質攝取 (3)氮血症 (4)便祕 |
2.電解質不平衡 (1)低血鈉 (2)低血鉀 (3)代謝性鹼中毒/酸中毒 (4)缺氧 (5)低血容量 |
3.藥物 (1)麻醉劑 (2)鎮定劑 |
4.其他 (1)感染 (2)手術 (3)其他肝臟疾病 (4)門靜脈分流 |
HE的分級表示了治療及預後的重要性,由West Haven Criteria(表三)及Glasgow Coma Scale作為HE嚴重度分級的依據。臨床上常用神經影像學來排除潛在的可能腦病變因素以及是否大腦水腫。腦部核磁共振是用以了解病人是否門脈分流而沒有內因性的肝臟疾病,若在基底核發現有鎂離子的蓄積,則表示病人門脈分流。血氨值的高低與HE的嚴重度是密切相關的,高血氨是因病人肝硬化,尿素循環失調。然而由靜脈測的血氨值與大腦水腫風險並沒有一致性。
表三 肝性腦病變的分級
Grade 0: 未出現行為異常、未呈現肌肉不協調的症狀 |
Grade 1: 認知缺乏、注意力縮短、睡眠失調、心境改變、可能肌肉不協調 |
Grade 2: 嗜睡、定向障礙、短期記憶缺失、簡單計算能力受損、行為不正常、說話不清、 肌肉不協調 |
Grade 3: 嗜眠症、意識紊亂、陣攣、眼球振顫、肌肉僵硬 |
Grade 4: 昏迷、沒有語言視覺及說話反應 |
慢性HE的治療包括排除其他的腦病變、辨認與矯正誘發因子,支持性療法如:矯正電解質不平衡、水分維持、氣道的暢通。基於HE的主要病因是腸道環境所成的高血氨,因此目前治療仍以減少腸道環境生成氨及增加氨的排除為主要治療。
一、非吸收性雙醣類藥物Lactulose
Lactulose目前仍是治療HE的首選藥物。Lactulose的滲透性瀉下作用有助於含氮廢物的排除,然而其真正的機轉是在腸道中被細菌分解成短鏈的脂肪酸而降低腸道的pH值,使非離子的ammonia帶正電而成離子型的ammonium,因此減少ammonia在腸道的吸收。Lactulose可以口服或鼻胃管方式給藥(表四),而對於第三和第四級HE患者,或是病人併發肝壞死、腹膜炎,以及不能耐受鼻胃管給藥的病人,灌腸給與lactulose是可以考慮的。然而lactulose常見的副作用有腹部脹氣及腹瀉,若病人呈現嚴重的腹瀉情形,應適時的減量或停止給藥,否則電解質的流失可能會誘發HE的惡化。
二、抗生素治療
抗生素的治療目的是減少腸道菌叢生成ammonia,常用的抗生素包括:neomycin、metronidazole及vancomycin。雖然口服給予這些抗生素,只有極少量會透過全身循環,然而在長期的使用之下,因為劑量的蓄積會有毒性的產生,如neomycin和vancomycin導致聽力受損及腎臟功能傷害,metronidazole則有神經毒性。
Rifaximin是由rifamycin半合成而來的巨環類抗生素,臨床研究發現每日給予1200毫克的劑量可有效改善HE,且僅有不到0.4%的腸胃道吸收率,對於肝腎功能不良的病人不需調整劑量6。目前許多資料證實rifaximin和lactulose及neomycin一樣有效改善HE,而且安全性和耐受性確較高,然而在藥物經濟學上的考量,同樣的單一療法,rifaximin 所需醫療費用是最高的,因此目前rifaximin僅保留用於對於lactulose耐受不良的HE病人7。
表四 非吸收性雙醣類藥物及抗生素在肝性腦病變的使用劑量
1. Lactulose (10 g/15 mL) (1) 口服/鼻胃管:每天2至4次投與30毫升、劑量的調整以每天排2至3次的軟便為主。 (2) 灌腸:300毫升的lactulose+700毫升的食鹽水,每隔4至6小時投予。 |
2. Neomycin:口服/鼻胃管4-12 g/d divided every 8 hour |
3. Rifaximin:口服1200 mg/d divided every 8 hour |
三、降氨藥物(ammonia - reducing agent)
增加氨的代謝是降低高血氨的另一個方法,由腸道生成的氨主要透過肝臟中的尿素循環(urea cycle)代謝。L-ornithine-L-aspartate,簡稱LOLA,係利用ornithine及aspartate這兩個參與尿素循環的胺基酸,加速尿素循環的進行進而降低血氨。研究發現每天4小時靜脈輸注20克的LOLA,7天後可改善HE。
Sodium benzoate及Sodium phenylbutyrate則分別與生成氨的前驅物質glycine及glutamine結合,將過多的含氮物質由尿液排除而降低血氨。鋅(zinc)則是尿素循環進行中所必需的輔酶,因此鋅的補充也有助於尿素循環的進行而降低血氨。
四、GABA拮抗劑8
由於HE患者內生性的benzodiazepines增加,增加抑制性神經傳導物質 GABA的傳遞,導致中樞抑制。利用benzodiazepine接受體的拮抗劑flumazenil可以改善患者的中樞抑制症狀。在13個雙盲隨機分派的臨床試驗中,綜合分析研究發現,flumazenil有意義地短期改善HE,但是對於HE的復發及存活率並沒有影響,也因此flumazenil臨床上不建議常規的使用。
五、支鏈胺基酸與飲食限制
肝衰竭病人由於體內支鏈胺基酸減少,芳香族胺基酸增加,因此補充支鏈胺基酸可以降低芳香族胺基酸與支鏈胺基酸的比值,進而改善HE。蛋白質攝取的限量為每天每公斤0.8至1.5克。慢性HE患者若偶爾不能耐受蛋白質,可轉換成植物性蛋白質或補充支鏈胺基酸。
伍、肝性腦病變的預後
慢性HE大部分是可逆的,若沒有在72小時內治療改善,則表示有進行性的誘發因子或其他腦病變的因子,其他的治療應該納入考慮,並評估病人是否有輕微的腸胃道出血或是過量的含氮飲食攝取。持續性的HE與肝臟功能的惡化或門脈分流有關。突發性HE及持續性HE病人,其存活率較低,應審慎評估肝臟移植的必要性。
陸、總結
HE是肝硬化常見的併發症,辨識與矯正誘發因子仍然是治療的基石,而及時地介入治療可降低發病率及死亡率。非吸收性的雙醣類藥物及抗生素治療可改善HE,然而對於嚴重的HE,肝臟移植仍然是最成功的治療方式。
參考資料:
1. Poordad FF. Review article: the burden of hepatic encephalopathy.Aliment Pharmacol Ther 2006; 25(1): 3-9.
2. Ference P, Lockwood A,Mullen K, et al:Hepatic encephalopathy definition,nomenclature,diagnosis,and qualification. Hepatology 2002; 35: 716-21.
3. Juan Co’ rdoba, M. D., and Beatriz Mı’nguez, M.D.: Hepatic Encephalopathy. SEMINARS IN LIVER DISEASE 2008; 28: 20-80.
4. Cornelis H. C. Dejong, Marcel C. G. van de Poll et al: Aromatic Amino Acid Metabolism during Liver Failure. J. Nutr. 2007; 137: 1579S-1585S.
5. Yasemen Eroglu, William J. Byrne: Hepatic Encephalopathy. Emerg Med Clin N Am 2009; 27: 401-414.
6. Davide Festi Amanda Vestito Management of Hepatic Encephalopathy: Focus on Antibiotic Therapy. Digestion 2006; 73: 94-101.
7. Rachel Tavares de Melo, Lisa Charneski, and Olga Hilas Rifaximin for the treatment of hepatic encephalopathy. Am J Health-Syst Pharm 2008; 65: 818-822.
8. GOULENOK Flumazenil vs. placebo in hepatic encephalopathy in patients with cirrhosis: a meta-analysis. Aliment Pharmacol Ther 2002;16: 361-372.
Hepatic Encephalopathy
PChing-Fen Lee
Department of pharmacy, Chang Gung Memorial Hospital - Linko Branch
Abstract
Hepatic encephalopathy(HE)is common in patients with advanced liver disease, and it is characterized by neuropsychiatric abnormalities and cognitive impairments. The world Congresses of Gastroenterology (WCOG) proposed classification of HE into 3 types based on the pattern and severity of neurologic abnormalities. Type A HE is associated with acute liver failure, type B with portosystemic bypass without intrinsic liver disease, and type C with liver cirrhosis. This article focuses on type C HE and introduces its pathophysiology and treatment.

