摘要
卵巢過度刺激症候群是使用受孕藥,如促性腺素、人類絨毛膜促性腺激素所引起的併發症。在臨床上,卵巢過度刺激症候群是依臨床症狀的嚴重性和檢驗數值分為三個等級;在病理學上,卵巢過度刺激症候群是一種複雜的反應。首先,助孕藥(如人類絨毛膜促性腺激素等)誘導多個濾泡發展變成多個卵巢囊腫,之後這些卵巢囊腫擴大和增加微血管的通透性,導致血管內液體流出血管外轉移到第三腔室(如腹腔),同時血管內液體減少導致腎臟灌流變少。在最嚴重的病例中,病人可能會腎臟衰竭、低容積休克和死亡。
一系列的研究發現,許多血管新生因子和血管活性激酶,如血管內皮生長因子(VEGF)、白細胞介素-6,8(interleukin-6,8)、腫瘤壞死因子- α(TNF-α)、血管收縮素II 都可能參與卵巢過度刺激症候群的成因和併發症。在這裡我們除回顧文獻探討卵巢過度刺激症候群病理生理學機轉,並進一步討論臨床上的治療和預防的方式。了解卵巢過度刺激症候群可能機轉、臨床預防及治療可協助藥師在不孕治療上多發揮角色。
關鍵字: 卵巢過度刺激症候群、血管內皮生長因子、人類絨毛膜促性腺激素、ovarian hyperstimulation syndrome, human chorionic gonadotropin, vascular endothelial growth factor
壹、前言
關於不孕症的治療,常用人類絨毛膜促性腺激素(human chorionic gonadotropin, hCG)協助不孕症婦女受孕,誘導卵成熟並助卵排出,但hCG也會誘導卵巢過度刺激症候群(ovarian hyperstimulation syndrome, OHSS)產生。OHSS常見症狀可由最輕微的症狀(如腹部不適、噁心、嘔吐)至嚴重可能致死的症狀(如休克、栓塞)。根據報導約有0.5 - 5%接受hCG治療的病患會出現嚴重的OHSS,而大部分病人只需密切監測臨床及檢驗數值是否惡化並無積極治療模式。以下分別針對病理生理學、危險因子、臨床分類與表現、治療方式與預防方式分別敘述1,3。
貳、病理生理學
目前尚無詳盡完整機轉解釋OHSS成因及併發症機轉。一般認為可能病因與外在投與促性腺素(gonadotropin)、內生性黃體刺激素(LH)激增或濾泡刺激素(FSH)受體突變有關。臨床上大部分OHSS常發現在接受外在hCG或促性腺激素的婦女身上而少見於以clomiphene和促性腺激素釋放素(GnRH)治療的病人,因此懷疑與外在投與促性腺素有相關性。另一方面,在卵巢接受外來的促性腺素刺激時,若停用hCG則OHSS會減少發生;反之,若懷孕已發生,隨著內生性hCG升高,持續刺激卵巢,則OHSS的期間可能拉長,且症狀較嚴重。另有研究顯示血管內皮生長因子(vascular endothelial growth factor, VEGF)在OHSS症狀中扮演重要角色。粒層黃體素細胞(granulosa-lutein cell)被hCG刺激後,會產生大量的VEGF-mRNA和VEGFR-2mRNA, 如圖一所示;之後大量的VEGF釋放並結合在卵巢血管內皮系統上的VEGF receptor2上,藉由vascular endothelial (VE)- cadherin參與,引起肌動纖維的改變,使內皮細胞接合處放鬆,導致血管通透性增加,如圖二所示。血管的通透性增加,使得血管內液體移出血管外滲漏至如腹腔等其他腔室,導致腹水、和胸膜滲液(pleural effusion),進而造成呼吸困難。而富含蛋白質的體液外滲,產生血液濃縮(hemoconcentration)現象,血管內血液容積減少,使腎臟灌流量減少,造成寡尿或無尿;另一方面,血液濃縮,血液黏稠度增加,也增加了栓塞的風險2,3。Lysophosphatidic acid (LPA)在粒層黃體素細胞是白細胞介素-8(IL-8)和白細胞(IL-6)重要的調節器;LPA誘導 IL-8和 IL-6增加單層內皮細胞的通透性,不過 IL-8和 IL-6在 OHSS導致血管通透性過高,仍難以解釋,而腫瘤壞死因子-α(TNG-α)和血管收縮素Ⅱ,在OHSS影響的原因仍不清楚,需要更進一步澄清。
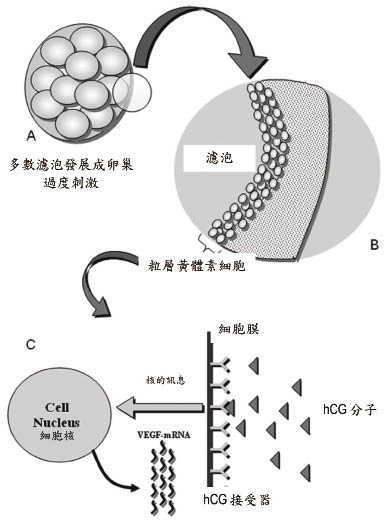
圖一 卵巢過度刺激的病理生理學7
(濾泡上的粒層黃體素細胞被hCG刺激,產生大量的VEGF)
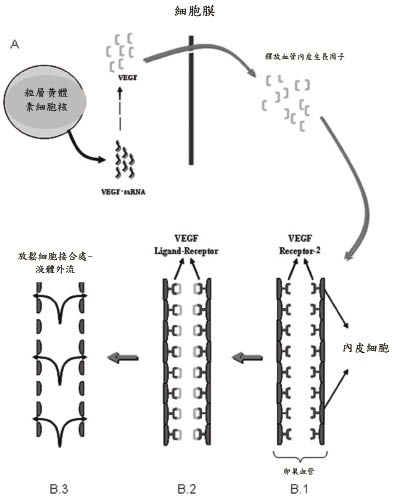
圖二 卵巢過度刺激的病理生理學7
(VEGF結合在VEGFR-2產生液體外流)
叁、危險因子
目前已知的危險因子包含年輕、體重過輕、多囊性卵巢症候群(polycystic ovary syndrome, PCOS)、投與較高劑量的促性腺素、血中雌二醇濃度值較高或上升快速等。年齡<35歲,可能是促性腺素的接受器數目較多,有較多的濾泡反應。若存在的因子越多,則發展成OHSS的風險就越高4。
肆、臨床分類與表現
臨床上,依所產生的症狀及檢驗數值可分為三級5;第一級為輕度卵巢過度刺激症候群(Grade I, mild hyperstimulation),此時病人並無明顯的臨床症狀,藉由儀器檢查可發現卵巢腫大。第二級為中度卵巢過度刺激症候群(Grade II, moderate hyperstimulation),此時病人有可觸之的卵巢腫大,由超音波檢查可發現少量腹水,病人臨床上伴隨胃腸道症狀(腹部不適、噁心、嘔吐、腹瀉等),尿中雌性素(estrogen)>150 µg/24hr。第三級為重度卵巢過度刺激症候群(Grade III, severe hyperstimulation),此時卵巢可能腫大超過12公分,伴有腹水、電解質不平衡(低血鈉、高血鉀)、血液濃縮等併發症;有些嚴重的病人可能會出現休克、栓塞、腎功能受損等現象。
伍、治療方式
依病患症狀之嚴重度分為門診病人及住院病人分別敘述其治療方式。
一、門診病人
若OHSS症狀輕微病人,可維持在門診追蹤觀察,教導病患OHSS相關訊息及衛教,如病患有疼痛情形,可考慮給予口服止痛藥。若OHSS症狀有惡化時,可考慮給予止吐劑及較強止痛藥,定期理學檢查並持續以超音波追蹤(確認腹水是否增加、卵巢有無變大)。
對於門診追蹤的病人,可建議病人下列事項;1. 每天攝取的口服液應該維持不要少於1000 mL/天,可提供電解質補充的飲料較佳;2. 避免費力的身體活動(可能造成卵巢扭轉或破裂出血),維持適當輕量運動,避免久臥在床(減少血栓的危險性);3. 每天定期量體重、腹圍、小便的頻率及體積;若體重增加(每天≧0.9公斤)或尿量減少,應回診接受近一步理學檢查、抽血檢驗及超音波追蹤,必要時需住院觀察及治療;4.有以下情形時則需考慮住院:嚴重腹痛、難治的眩暈和嘔吐、寡尿或無尿,大量腹水、呼吸困難和呼吸急促、低血壓、嚴重的電解質不平衡、血液濃縮、肝功能不正常。
二、住院病人
只有極少數病人嚴重到需要住院;病情嚴重的OHSS病人其生化及血液檢驗數據通常可發現的現象包括血液濃縮(血比容>45%)、白血球增多(白血球>15000 103/µL)、電解質不平衡(例如血鈉<135 meq/L,血鉀>5 meq/L)、肌酸酐清除率減少(肌酸酐清除率<50 mL/min或血中肌酸酐濃度>1.2 mg/dL)。住院病人除定期生命跡象檢測、理學檢查、超音波追蹤、抽血檢查外,亦應安排胸部X光和心臟超音波檢查以確認有無胸腔滲液或心包膜滲液的現象,血氧定測以確認肺功能等。
住院期間治療方式主要有下列幾項;1.體液補充;快速補充水分例如給予生理食鹽水靜脈輸注500-1000 mL後再調整輸注速率維持適量尿液排出約在>20-30 mL/h以改善其血液濃縮的問題,但同時需注意之後可能加重腹水累積的情形;若是血管通透性明顯增加的嚴重OHSS病人,可加入血漿製劑如白蛋白給予靜脈輸注50-100 g超過4h,若有需要4-12小時後可再投與4。2.腔室放液穿刺術;腹水是引起疼痛、肺功能減弱表現出如呼吸急促、缺氧、水胸症等症狀的主要原因,此時體液補充仍可能無法回復寡尿或無尿等現象。其處置方式可藉由超音波的引導下,經腹部或經陰道施行穿刺術抽出腹水,減輕病人症狀。若為維持病患腎及肺功能,有時可考慮施行持續多次的腔室放液穿刺術予以治療3,4。3.其他併發症治療;栓塞是OHSS中具生命威脅的嚴重併發症,可能與血液濃縮,高的雌性素有關。建議的藥物治療包括給予預防性的肝素,對於體液補充及腔室放液穿刺術仍無法有效治療的腎臟衰竭症狀時,可給予低劑量的dopamine(0.18 mg/kg/hr),因為dopamine可擴大腎血管,增加腎血流;亦可考慮短期的透析治療。另外必須嚴加監控高血鉀及其引發酸鹼不平衡及心臟方面症狀並依症狀治療之。倘若發現有卵巢扭轉或破裂出血,需立即進行剖腹手術,處理這類危及生命之併發症,通常病人從症狀開始到最後症狀完全緩解,大約10-14天4。
陸、預防方式
目前OHSS最好的預防方法是停用hCG,避免卵巢的過度刺激。防止OHSS發生的關鍵是誘導排卵治療的經驗和確認OHSS的危險因子包括血清雌二醇值快速上升或濃度超過2500 pd/mL及出現多數中等大小的濾泡等。如在未投予hCG之前,OHSS症狀已出現的病人,可取消給予hCG以減少卵巢強烈刺激的程度4。
最近一篇統合分析的文章指出,當雌二醇值明顯升高或有OHSS的先前徵兆的病人,預防性的給予Albumin 25% 20-50 g,可減少OHSS風險4。針對高危險群的病人,若減少胎兒胚胎植入的數目至一個,亦可降低OHSS的發生率。新研究嘗試用LH或GnRH取代hCG,一方面刺激排卵產生,一方面防止VEGF的大量產生,此研究顯示以GnRH取代hCG去觸發排卵,沒有類似hCG具有延長黃體期的作用,雖然可能使植入率和受孕率都明顯下降,但可降低OHSS的發生6。
結構上LH和hCG具有相同的α subunit 和不同的β subunit,是屬於heterodiameric glycoproteins,皆可作用於LH receptor,但hCG的半衰期約2-3天,LH的半衰期約3-5小時1。藉由用基因重組的LH(recombinant LH, rLH),仍可維持等同於hCG的誘導卵成熟能力,又降低OHSS的發生。The European Recombinant LH study group於2001年曾投出報告認為使用15000 IU rLH和5000 IU hCG比較,其誘導卵成熟的效能相當1,7;而另有一篇研究提出當使用rLH 15000IU~30000IU,病人之OHSS發生率比使用hCG低,但並無大型前瞻性臨床試驗佐證所以目前仍需更多的努力和研究來提供這方面的證據7。
近年來發現多巴胺(dopamine)或多巴胺第二型接受器(dopamine receptor 2)促效藥可經由內皮細胞的多巴胺第二型接受器抑制VEGFR-2,降低血管通透性和血管生成。因此有實驗嘗試於不孕症治療開始投與hCG起,每日給予口服cabergoline(0.5 mg/day)連續9天,其結果顯示腹水、血液濃縮和OHSS現象及症狀都明顯減少,但因此實驗中病人數目太少,因此需要進一步的研究確定cabergoline在OHSS的效果1。
柒、結論
大部分的OHSS屬輕度的,嚴重的OHSS發生率小於5%。輕度的病人,須注意腹圍,體重的變化,並教導病人OHSS相關訊息;若OHSS症狀持續惡化,則應住院治療並進一步追蹤相關變化。如有需要則補充體液避免血液濃縮並配合腔室放液穿刺術消除腹水。臨床上的治療首重預防嚴重之OHSS發生,目前仍以停用hCG為最好的預防方式;但已有很多研究嘗試給予LH、rLH或GnRH,取代hCG誘發排卵減少OHSS發生率,或併用多巴胺促效劑(如cabergoline)降低血管通透性,來預防OHSS的併發症,但仍需更多研究來佐證。現今隨著醫藥分業實施,藥師地位提升,責任也加重:民眾常就近詢問藥師各種醫療問題;了解OHSS可能機轉、臨床預防及治療,不只提供病人相關衛教及諮詢,亦保障病人用藥安全。
參考資料:
1. Chen SU, Chen CD, Yang YS. Ovarian hyperstimulation syndrome (OHSS): new strategies of prevention and treatment. J Formos Med Assoc.2008 Jul; 107(7): 509-12.
2. Kaiser UB. The pathogenesis of the ovarian hyperstimulation syndrome. N Engl J Med. 2003 Aug 21; 349(8): 729-32.
3. Yildizhan R, Adali E, Kolusari A, Kurdoglu M, Ozgokce C, Adali F. Ovarian Hyperstimulation Syndrome with pleural effusion: a case report. Cases J. 2008 Nov 18; 1(1): 323.
4. Practice Committee of American Society for Reproductive Medicine. Ovarian hyperstimulation syndrome. Fertil Steril. 2008 Nov; 90(5 Suppl): S188-93.
5. Marie M. Budev, DO, MPH; Alejandro C. Arroliga, MD; Tommaso Falcone, MD. Ovarian hyperstimulation syndrome. Crit Car Med. 2005; 33(10): S301-306.
6. Sismanoglu A, Tekin HI, Erden HF, Ciray NH, Ulug U, Bahceci M. Ovulation triggering with GnRH agonist vs. hCG in the same egg donor population undergoing donor oocyte cycles with GnRH antagonist: a prospective randomized cross-over trial. J Assist Reprod Genet. 2009 May; 26(5) :251-6. Epub 2009 Jul 23.
7. Soares SR, Gómez R, Simón C, García-Velasco JA, Pellicer A. Targeting the vascular endothelial growth factor system to prevent ovarian hyperstimulation syndrome. Hum Reprod Update. 2008 Jul-Aug; 14(4): 321-33. Epub 2008 Apr 2.
8. Hsieh YY, Chang CC, Tsai HD. Comparisons of different dosages of gonadotropin-releasing hormone (GnRH) antagonist, short-acting form and single, half-dose, long-acting form of GnRH agonist during controlled ovarian hyperstimulation and in vitro fertilization. Taiwan J Obstet Gynecol.2008 Mar; 47(1): 66-74.
Review of Treatment and Prevention of Ovarian Hyperstimulation Syndrome
Chih-Neng Kang, Cheng-Ying Yu
Department of Pharmacy, Kaohsiung Medical University Hospital,
Kaohsiung Medical University, Kaohsiung, Taiwan
Abstract
Ovarian hyperstimulation syndrome (OHSS) is a complication from certain fertility medication, like gonadotropin or human chorionic gonadotropin (hCG). Clinically, OHSS is classified into three grades by the severity of clinical symptoms and laboratory findings. In pathophysiology, OHSS results from a series of complex reactions. Firstly, fertility medications induce multifollicular development to become multiple ovarian cysts. Those ovarian cysts enlarge with increased capillary permeability. Thus results in not only fluid shift form intravascular space to the third space (like abdominal cavity) but also renal inflow decreasing. In the most severe cases, patients may be in renal failure, hypovolemic shock, and resulting in death.
A series of studies have shown that several angiogenic and vasoactive cytokines, including vascular endothelial growth factor (VEGF), interleukin-6,8 (IL-6,8), tumor necrosis factor-α (TNF-α) and angiotension II are attributing pathogenetic factors for OHSS development and its complications.
In this review, we describe the possible pathways about OHSS and its prevention and treatment to help pharmacist to deal with infertility therapy in clinical practice.

