摘要
藥品係知識經濟產品,知識看不見,而看不見的危險最危險,因此知識經濟產品應從產品安全的思維轉型為知識風險的預防。本文闡述(1)系統生物學的整合評估是當代實証藥學的主流思維;(2)外源物與身體間的夥伴關係及風險;(3)品質、安全及療效是預防知識經濟產品風險的準則;(4)藥物、食品等生技產品知識切割的非科學性;(5)藥品、中草藥及健康食品切割管理的盲點及與流行病學的因果關係;(6)國際協合組織從用藥安全到用藥安全體系環境建構的歷史演進及思維邏輯;(7)用藥安全應從產品安全 (pharmacovigilance) 轉型到環境建構 (pharmacovigilance planning)。
關鍵字: 用藥安全的環境建構、實証藥學、用藥風險、中草藥、健康食品、用藥盛行率
壹、前言
當代藥學的主流思維是以實證為基礎,以服務病人為依歸 (臨床藥學定義)。本文以用藥安全為題,收集文獻報告,分析公共資訊,論述(1)系統生物學的整合評估是實證藥學的基礎;(2)藥物、食品等外源物與身體間的夥伴關係及潛藏風險;(3)產品經濟思維下外源物知識切割的非科學性及造成的用藥安全盲點;(4)藥品、中草藥及健康食品切割管理與流行病學的因果關係;(5)國際協合組織從用藥安全到用藥安全體系環境建構的歷史演進及思維邏輯的宣示和指引;(6)用藥安全需從產品經濟進化到知識經濟的風險思維;以及(7)預防用藥的系統性風險,應從產品管理轉型到環境建構 (pharmacovigilance planning)。
貳、方法
本研究以「ADME or transporters or metabolism and xenobiotics」、「xenobiotics-host interaction」、「xenobiotics and hepatotoxicity or nephrotoxicity」等關鍵詞探索藥/食品外源物與身體間夥伴關係的文獻報告;以「drugs or xenobiotics or herbal or complementary or alternative or traditional Chinese medicine or nutraceuticals and interaction」等關鍵詞探索藥/食品併用的科學報告;以「risk management and pharmacovigilance planning and pharmacoepidemiology」等關鍵詞探索用藥安全體系建構的文獻報告。文獻檢索資料庫包括2000年至2011年PubMed database (http://www.ncbi.nlm.nih.gov/pubmed/)、SCOPUS database (http://www.scopus.com/home.url)。台灣地區的用藥概況則以「藥品使用」、「藥事法規」、「用藥安全」、「藥物流行病學」等關鍵詞檢索全民健康保險資料庫、中華民國腎臟基金會、中華民國衛生署藥政管理及藥物不良反應相關網站,取得統計資料。
參、結果
一、系統生物學
外源物質 (xenobiotics) 在生物體需經歷吸收、分佈、代謝和排泄 (ADME),因此與身體之夥伴關係的整合式評估,是決定外源物有效與安全性的準則 (圖一)。隨著系統生物學的發展,各種傳輸蛋白 (transporters) 生物訊息的報告1-3,讓外源物與身體相互作用的機制越來越清楚4-7,成為解釋藥物動力學的基礎8-9,協助解釋外源物的潛在性安全威脅10-12,也證明了身體是決定外源物可否成為藥品的關鍵指標 (圖二) 13-14。
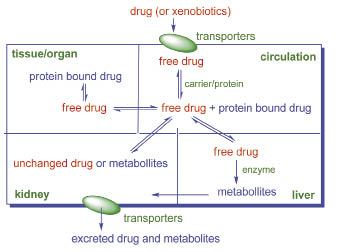
圖一 生物系統處理外源物的機制
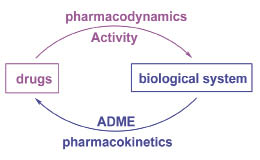
圖二 ADME是決定藥物風險及效益的關鍵指標
二、 系統生物學在用藥評估上的重要性 (risk-benefit assessment)
從新藥開發的演進觀之,早期採三階段串聯式研發策略,以化學設計及藥效評估 (pharmacodynamics) 為主軸,藥物動力學 (pharmacokinetics) 在開發末期才介入,因此失敗機率極高 (圖三a) 15。當代新藥開發策略則著重於增效減毒 (PD/PK optimization),藥效及藥物動力學同步參與研發,以縮短開發時程 (圖三b) 16。隨著生物訊息的揭露,近代研究更以ADME等系統生物學機制做為藥物設計的利基 (圖三c) 17-18。另外,新藥與食物或其他藥物的交互作用是影響新藥上市、競爭力及存續的關鍵因素,為提高成功率及降低投資,交互作用亦成為早期新藥開發必做的系統生物學研究19-22。
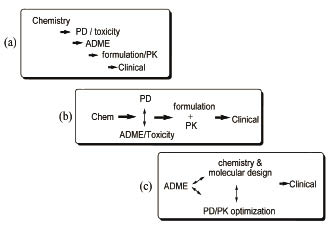
圖三 新藥開發策略三階段的演進從(a)化學設計、藥效、藥動學串聯式研發,到(b)藥效與藥動學同步參與研發,再到(c)ADME系統生物學參與早期新藥設計。
三、中西醫學的用藥理論殊途同歸
以現代藥學來詮釋中醫用藥,「藥食同源」不論外源物,風險為唯一考量;「辨證論治」以生物體系的動力學做為評估藥效的基礎;「君臣佐使」則以配方讓外源物在體內之藥效/藥動表現最優化 (formulation for PD/PK optimization,圖四)。藥不分東西,當代的台灣知識界強調「西藥是單方,中藥是複方」,依產品把中藥、西藥、食品做知識切割及分治,扭曲了中醫人本 (風險評估) 而且科學 (效益評估) 的正統思維。
![]()
圖四 中醫用藥理論「君臣佐使」與現代藥學藥效/藥動表現最優化之思維殊途同歸。
四、 外源物在體內的交互作用及中西藥併用的盲點
多重藥物使用 (polypharmacy) 逐漸成為現代人藥粧食品養生的流行病學。除了西藥之外,使用傳統替代療法藥物 (CAM) 的人口不斷增長,以老人及心血管疾病、疼痛、癌症、肥胖等慢性病患最普遍23-28。相當比例的患者就診時並不告知醫師是否同時使用CAM,因此用藥安全存在盲點,安全監視之標準作業程序有其局限性。已有非常多的科學與流行病學研究報告指出中西藥併用的風險29-35,在喜用中藥的東方社會,更值得關注36。
五、用藥觀念的演變與國際趨勢
先進國家對於用藥,在概念上有階段性的演變,從早期的產品思維 (phase I, II and III clinical trial),演變到藥品不良反應報告以監測風險 (phase IV, Pharmacovigilance Specification)。由於個別藥品的監測有信息支離破碎的盲點,因此以美國、歐盟、日本為主體的藥物法規平台組織 (International Conference of Harmonization,ICH) 在2005年產生Pharmacovigilance Planning (PVP) 的概念37-39。國際醫學組織理事會 (the Council for International Organizations of Medical Sciences (CIOMS) 和ICH並在2005年公布 PVP指引 (Topic ICH E2E Guidance),落實以預防及降低風險為主軸的體系管理思維。該指引主要在識別有許可證藥物的使用風險以及建立風險評估方法 (例如藥物基因體學、流行病學研究等,圖五)40-41。
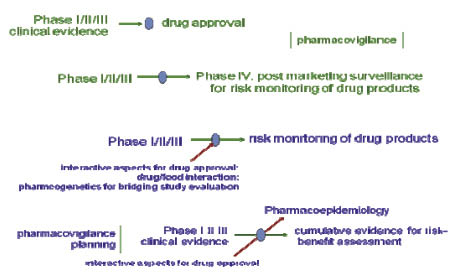
圖五 先進國家針對用藥從產品安全到風險管理再到預防風險環境建構的思維演變
PVP的思維邏輯正式宣告藥品從產品 (medicine) 轉型到用藥 (medication) 的系統生物學思維,再進一步轉型到用藥安全體系的環境建構 (system building for safe medication),是先進國家在用藥的整體思維上,從產品管理到體系管理的歷史演進中極為重要的里程碑。唯該指引並未包含傳統藥物,難以評估病人使用中藥或沒有許可證的藥用產品產生的不明風險,很難在中藥或植物性產品盛行的台灣社會達到預防或降低風險的目標。
六、藥物流行病學在台灣
在台灣集合式的醫療體系下,醫院處方釋出率極低 (0.4%,圖六) 42,人民多重及過度用藥 (表一)43,但藥品不良反應的通報率卻只有美國的1/10 (0.0025% vs 0.024%) 44。在缺乏分散用藥風險,而且藥事服務不患寡而患不均的醫療體系下,病人處於高用藥量與醫院藥師高調劑量的雙重風險之中 (表二) 44-45。
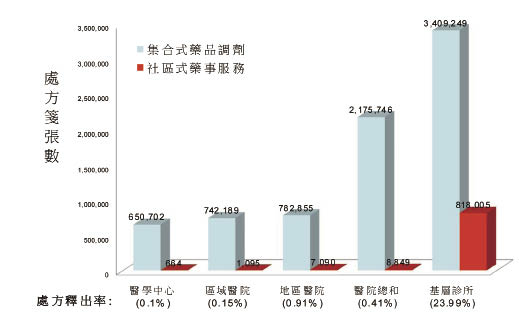
圖六 台灣地區處方籤釋出統計(資料來源:2010年健保資料庫)
表一 台灣民眾健保用藥統計(2010年健保資料庫)
台灣 |
OECD國家 |
|
每人每年看診數(次) |
15. 2 |
5. 9 |
每張處方籤藥品品項數 |
4. 2 |
1. 9 |
健保藥品支出佔率(%) |
25 |
~15 |
表二 台灣民眾藥事服務場域分布統計(2010年健保資料庫)
處方籤數 |
藥師數 |
藥師每日調劑量 |
|
醫學中心 |
31,172,000 |
725 |
154 |
區域醫院 |
34,368,000 |
880 |
139 |
地區醫院 |
35,137,000 |
770 |
160 |
診所 |
217,052,000 |
8,404 |
91 |
藥局 |
31,290,000 |
3,348 |
33 |
中西藥併用是另一個多重用藥的問題。大部分先進國家將草藥歸為食品,不發給藥品許可證46-48,台灣則將中藥歸為藥品管理。體制內,中西藥切割的雙軌登記制度讓中、西藥的使用產生管理的灰色地帶。西藥許可證隨著優良製造規範(GMP)的實施而急速下降,中藥許可證卻以另外一套制度切割管理而急速增長 (表三)。一項報告顯示,台灣有許可證的中藥產品中,50%含有多於9種成分藥材,60%有許可證的中藥產品未明列藥材成分49。體制外,未申請藥品許可證的中藥及健康食品卻宣稱藥效。根據財團法人藥害救濟基金會與藥師公會全國聯合會於 2004年進行的台灣地區廣告監測調查,有線電視台的非法廣告佔了12% (183 /1591),以食品 (41%) 及中藥 (15%) 為大宗,電台的非法廣告佔了53%,以中藥(53%) 及食品 (31%) 為大宗,大部分的違規廣告均為缺乏證據卻宣稱療效 (圖七) 50。
表三 台灣中西藥許可證統計
西藥許可證 |
中藥許可證 |
|||
年 |
處方藥 |
指示藥 |
處方藥 |
指示藥 |
1995 |
14718 |
7152 |
2394 |
4663 |
1995年合計 |
21,870 |
7,075 |
||
2006 |
4235 |
1385 |
4663 |
6444 |
2006年合計 |
5,620 |
11,107 |
||
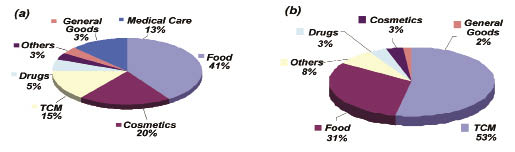
圖七 2004年有線電視台(a)及電台(b)非法廣告統計
研究顯示藥品及草藥療法與慢性腎臟病有關51-55。台灣的末期腎臟疾病 (ESRD) 盛行率在世界排名第一56-57,ESRD盛行人口比例從1991年的1/2999,到2006年的1/498,線性外插估計到2030年將為1/232 (圖八)。
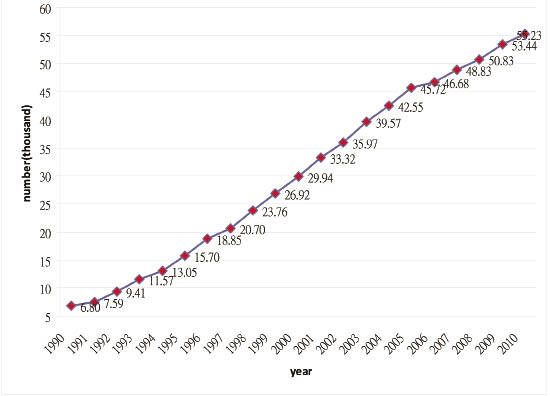
圖八 台灣末期腎臟疾病患者統計(資料來源:2010年中華民國腎臟基金會)
肆、討論
台灣存在著兩個用藥安全的根本問題:(1) 向福利制度傾斜的全民健康保險不可避免的引誘人民多重及過度用藥;(2) 藥品一國多制,加上養生食品的盛行,造成外源物在身體產生不可預期的風險。以績效及利潤為主的產品經濟社會,將中藥、西藥、健康食品做知識切割,不僅不科學,也違背「藥食同源」的人本精神,更與現代社會崇尚健康、預防風險、消費者保護及人權訴求的發展背道而馳 (圖九)。
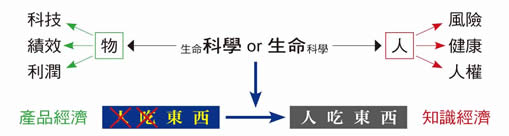
圖九 藥物知識經濟的人本思維示意圖
進步社會的人民需要有有尊嚴的消費環境。在切割式管理的社會中,知識切割是製造人民不安全用藥的根源。藥品係知識經濟產品,知識看不見,而看不見的危險最危險。現代實證藥學以系統生物學的整合分析做為風險與效益評估的依據,並不因藥物的來源不同 (合成,動物,植物或生物技術產品) 而有不同標準及管理。國際協合會議組織在用藥概念上的階段性演變,也已從產品管理 (註冊、上市、製造、物流) 演變到用藥安全的環境建構,預防風險的人本思維值得台灣借鏡。
有有尊嚴的消費社會,才有有尊嚴的專業。藥劑師服務藥品,做好優良藥事規範(GPP),並不表示人民用藥就很安全,因為藥劑師服務不到之處,正是人民用藥不安全的地方,因此先進國家為臨床藥學下的定義是「以實證藥學知識服務病人」。台灣在宅經濟社會的發展進程中,各行各業以客製化的思維提供人民優質的生活內涵,然而醫藥專業相對落後,到目前為止仍然看不到醫療的宅經濟。以藥學為例,具有研讀系統生物學能力的藥師,在職場跼限於服務藥品,與臨床藥師的角色相去太遠,而不具研讀系統生物學能力的產品促銷者,直接服務人民。有實証藥學訓練的藥師如何介入用藥安全體系之環境建構,建立臨床藥學的專業本質,應是台灣重要的醫療課題。
伍、結論
以用藥安全環境建構 (PVP) 達到預防及降低風險,已是國際趨勢。落實PVP是所有用藥關係人 (藥品供應商、專業人士、病人、消費者,第三方付費人,決策者) 需思考的議題,而以教育者的社會責任為最。只有落實「藥品不分來源,品質、安全、有效為唯一標準」,台灣在用藥環境上才有機會邁入進步國家之林。
誌謝
本研究報告由衛生署食品藥物管理局所支持(grant no. 99TFDA-P-065),謹此致謝。
參考資料:
1. Ayrton, A. & Morgan, P.: Role of transport proteins in drug discovery and evelopment: pharmaceutical perspective. Xenobiotica, 2008; Vol.38, No.7-8, pp. 676-708.
2. Calcagno, A. M., Kim, I. W., Wu, C. P., Shukla, S. & Ambudkar, S. V.: ABC drug transporters as molecular targets for the prevention of multidrug resistance and drug-drug interactions. Current Drug Delivery, 2007; Vol.4, No.4, pp. 324-333.
3. Yuan, H., Li, X., Wu, J., Li, J., Qu, X., Xu, W. & Tang, W.: Strategies to overcome or circumvent P-Glycoprotein mediated multidrug resistance. Current Medicinal Chemistry, 2008; Vol.15, No.5, pp. 470476.
4. Brandsch, M., Knütter, I. & Bosse-Doenecke E.: Pharmaceutical and pharmacological importance of peptide transporters. J. Pharm. Pharmacol., 2008; Vol.60, No.5, pp. 543-585.
5. Oostendorp, R. L., Beijnen, J. H. & Schellens, J. H. M. : The biological and clinical role of drug transporters at the intestinal barrier. Cancer Treatment Reviews, 2009; Vol.35, No.2, pp. 137147.
6. Rubio Aliaga, I. & Daniel, H.: Peptide transporters and their roles in physiological processes and drug disposition. Xenobiotica, 2008; Vol.38, No.78, pp. 10221042.
7. Zhou, S. F. (2008). Structure, function and regulation of Pglycoprotein and its clinical relevance in drug disposition. Xenobiotica, Vol.38, No.78, pp. 802832.
8. Tsintis, P. & La Mache, E.: CIOMS and ICH initiatives in pharmacovigilance and risk management: overview and implications. Drug Saf., 2004; Vol.27, No.8, pp. 509517.
9. Wang CL, Wang HP, Biological Transporters as Targets for New Drug Design ,Exp Clin Medicine, 2009, 1, 32-8.
10. Lombardo, F. & Waters, N. J.: Drug design from the ADME/PK perspective: Does chemical intuition suffice in multifaceted drug discovery? Current Topics in Medicinal Chemistry, 2011; Vol.11, No.4, pp. 331333.
11. Ekins, S., Honeycutt, J. D. & Metz, J. T.: Evolving molecules using multi-objective optimization: Applying to ADME/Tox. Drug Discovery Today, 2010; Vol.15, No.11-12, pp. 451-460.
12. Yang, C. Y., Chao, P. D. L., Hou. Y. C., Tsai, S. Y., Wen, K. C. & Hsiu, S. L.: Marked decrease of cyclosporin bioavailability caused by coadministration of ginkgo and onion in rats. Food Chem. Toxicol., 2006; Vol.44, No.9, pp. 15721578.
13. Eddershaw, P. J., Beresford, A. P. & Bayliss, M. K. : ADME/PK as part of a rational approach to drug discovery. Drug Discovery Today, 2000; Vol.5, No.9, pp. 409-414.
14. RuizGarcia, A., Bermejo, M., Moss, A. & Casabo, V. G.: Pharmacokinetics in drug discovery. Journal of Pharmaceutical Sciences, 2008; Vol.97, No.2, pp. 654690.
15. Nassar, A. E. F., Kamel, A. M. & Clarimont, C.: Improving the decision making process in the structural modification of drug candidates: Enhancing metabolic stability. Drug Discovery Today, 2004; Vol.9, No.23, pp. 10201028.
16. Nassar, A. E. F., Kamel, A. M. & Clarimont, C. : Improving the decision making process in structural modification of drug candidates: Reducing toxicity. Drug Discovery Today, 2004; Vol.9, No.24, pp. 10551064.
17. Dingemanse, J. & Appel-Dingemanse, S. : Integrated pharmacokinetics and pharmacodynamics in drug development. Clinical Pharmacokinetics, 2007; Vol.46, No.9, pp. 713-737.
18. Wang, C. L., Fan, Y. B., Lu, H. H., Tsai, M. C., & Wang, H. P., Evidence of d-Phenylglycine as Delivering Tool for Improving l-Dopa Absorption, J Biomedical Sci. 2010 Sep 6; 17(1):71.
19. Grossman, I.: ADME pharmacogenetics: Current practices and future outlook. Expert Opinion on Drug Metabolism and Toxicology, 2009; Vol.5, No.5, pp. 449462.
20. Harris, R. Z., Jang, G. R. & Tsunoda, S. : Dietary effects on drug metabolism and transport. Clin. Pharmacokinet., 2003; Vol.42, No.13, pp. 10711088.
21. Hartford, C. G., Petchel, K. S., Mickail, H., PerezGutthann, S., McHale, M., Grana, J. M. & Marquez, P.: Pharmacovigilance during the preapproval phases: an evolving pharmaceutical industry model in response to ICH E2E, CIOMS VI, FDA and EMEA/CHMP risk management guidelines. Drug Saf., 2006; Vol.29, No.8, pp. 657673.
22. Zhang, L., Zhang, Y., Strong, J. M., Reynolds, K. S. & Huang, S. M. : A regulatory viewpoint on transporter based drug interactions. Xenobiotica, 2008; Vol.38, No.,78, pp. 709724.
23. Chung, V. C., Lau, C. H., Yeoh, E. K. & Griffiths, S. M.: Age, chronic non-communicable disease and choice of traditional Chinese and western medicine outpatient services in a Chinese population. BMC Health Services Research, 2009; Vol.9, No.207.
24. Kennedy, J.: Herb and supplement use in the US adult population. Clin. Ther., 2005; Vol.27, No.11, pp. 18471858.
25. Miller, M. F., Bellizzi, K. M., Sufian, M., Ambs, A. H., Goldstein, M. S., & Ballard Barbash, R.: Dietary Supplement Use in Individuals Living with Cancer and Other Chronic Conditions: A Population Based Study. J. Am. Dietetic Association, 2008; Vol.108, No.3, pp. 483494.
26. Nowack, R., Ballé, C., Birnkammer, F., Koch, W., Sessler, R. & Birck, R.: Complementary and Alternative Medications Consumed by Renal Patients in Southern Germany. J. Renal Nutrition, 2009; Vol.19, No.3, pp. 211219.
27. Ohama, H., Ikeda, H. & Moriyama, H. : Health foods and foods with health claims in Japan. Toxicology, 2006; Vol.221, No.1, pp. 95111.
28. Ramage Morin, P. L.: Medication use among senior Canadians. Health reports / Statistics Canada, Canadian Centre for Health Information 2009; Vol.20, No.1, pp. 3744.
29. Anastasi, J. K., Chang, M. & Capili, B. : Herbal Supplements: Talking with your Patients. J. for Nurse Practitioners, 2011; Vol.7, No.1, pp. 29-35.
30. Balbino, E. E. & Dias, M. F. : Pharmacovigilance: A step towards the rational use of herbs and herbal medicines, Brazilian J. Pharmacognosy, 2010; Vol.20, No.6, pp. 992-1000.
31. Chiang, H. M., Fang, S. H., Wen, K. C., Hsiu, S. L., Tsai, S. Y., Hou, Y. C., Chi, Y. C. & Chao, P, D.: Life-threatening interaction between the root extract of Pueraria lobata and methotrexate in rats. Toxicol Appl Pharmacol., 2005; Vol.209, No.3, pp. 263-268.
32. Cockayne, N. L., Duguid, M. & Shenfield, G. M. : Health professionals rarely record history of complementary and alternative medicines. Br. J. Clin. Pharmacol., 2005; Vol.59, No.2, pp. 254-258.
33. Sim, S. N. & Levine, M. A. H. : An evaluation of pharmacist and health food store retailer's knowledge regarding potential drug interactions associated with St. John's wort. Canadian J..Clin.Pharmacol, 2010; Vol.17, No.1, pp. E57E63.
34. Smith, C. A., Priest, R., Carmady, B., Bourchier, S. & Bensoussan, A.: The ethics of traditional Chinese and western herbal medicine research: Views of researchers and human ethics committees in Australia. Evidence based Complementary and Alternative Medicine, 2011; Vol.2011, No.256915.
35. Tarirai, C., Viljoen, A. M. & Hamman, J. H.: Herb drug pharmacokinetic interactions reviewed. Expert Opinion on Drug Metabolism and Toxicology, 2010; Vol.6, No.12, pp. 15151538.
36. Wang, H.P., Wang, C. L., Yu, W. N., Huang, Y. W., Lin, Y. L., Leu, Y. L. & Lee, C. Y. From pharmacovigilance to pharmacovigilance planning--The system building for safe medication, J Food Drug Anal, 2007; 15, 377-86.
37. Bahri, P. & Tsintis, P. : Pharmacovigilance-related topics at the level of the International Conference on Harmonisation (ICH). Pharmacoepidemiol Drug Saf., 2005; Vol.14, No.6, pp. 377-387.
38. Moseley, J. N. S. : Risk management: A European regulatory perspective. Drug Saf., 2004; Vol.27, No.8, 499508.
39. Tsintis, P. & La Mache, E.: CIOMS and ICH initiatives in pharmacovigilance and risk management: overview and implications. Drug Saf., 2004; Vol.27, No.8, pp. 509517.
40. Callréus, T. (2006). Use of the dose, time, susceptibility (DoTS) classification scheme for adverse drug reactions in pharmacovigilance planning. Drug Saf., Vol.29, No.7, pp. 557-566.
41. Cappe, S., Blackburn, S., Rosch, S. & Tsintis, P. (2006). Proactive planning in pharmacovigilance. Good Clin. Practice J., Vol.13, No.6, pp. 14-17.
42. 行政院衛生署: 推動健康資料庫加值應用計畫資料庫, 臺北,衛生署,2010. http://www.doh.gov.tw/CHT2006/DM/DM2_2_p02.aspx?class_no=440&now_fod_list_no=11468&level_no=1&doc_no=77184.
43. Gau, C. S., Chang, I. S., Wu, F.L.L., Yu, H.T., Huang, Y.W., Chi, C.L., Chien, S.Y., Lin, K.M., Liu, M.Y., & Wang, H.P. : Usage of the claim database of national health insurance programme for analysis of cisapride erythromycin comedication in Taiwan, Pharmacoepidemiology and Drug Safety, 2007; Vol.16, No.1, pp. 8695.
44. 財團法人藥害救濟基金會( Taiwan Drug Relief Foundation), 臺北, 衛生署, 2010; http://www.tdrf.org.tw/.
45. Huang, W. F. & Lai, I. C.: Potentially inappropriate prescribing for insomnia in elderly outpatients in Taiwan. Int. J. Clin. Pharmacol. Ther., 2006; Vol.44, No.7, pp. 335342.
46. World Health Organization.: Legal Status of Traditional medicine and Complementary/Alternative Medicine: a Worldwide Review. Geneva, document reference WHO/EDM/TRM/2001. 2002; 2.
47. World Health Organization. : WHO guidelines for governments and consumers regarding the use of alternative therapies. Rev. Panam. Salud Publica., 2004; Vol.16, No.3, pp. 218221.
48. Ziker, D.: What lies beneath: an examination of the underpinnings of dietary supplement safety regulation? Am. J. Law. Med., 2005; Vol.31, No.23, pp. 269284.
49. Chang, S. S., Yu, W. W., Lei, S. L., Leu, C. L. & Liang, Y. H.: Study on the regulations of low level claim of Chinese medicines with real cases. Ann Rep 2006; CCMP95-CT-009:9-9.
50. Huei, D. R., Chang, G. C. & Hsu, S. W. : Taiwan Drug Relief Foundation Report on the prevalence of illegal advertisement on drugs, cosmetics and healthcare products. 2004; Ann Rep: 12-12.
51. Bagnis, C. I., Deray, G., Baumelou, A., Le Quintrec, M. & Vanherweghem, J. L.: Herbs and the kidney. Am. J. Kidney Dis, 2004; Vol.44, No.1, pp. 1-11.
52. Chang, C. H., Wang, Y. M., Yang, A. H. & Chiang, S. S.: Rapidly progressive interstitial renal fibrosis associated with Chinese herbal medications. Am. J. Nephrol., 2001; Vol.21, No.6, pp. 441-448.
53. Guh, J.Y., Chen, H.C., Tsai, J.F. & Chuang, L.Y. : Herbal therapy is associated with the risk of CKD in adults not using analgesics in Taiwan. Am. J. Kidney Dis. 2007; Vol.49, No.5, pp. 626633.
54. Nowack, R. : Herbdrug interactions in nephrology: Documented and theoretical. Clinical Nephrology 2008; Vol.69, No.5, pp. 319325.
55. Zhou, S. F., Xue, C. C., Yu, X. Q. & Wang, G.: Metabolic activation of herbal and dietary constituents and its clinical and toxicological implications: An update. Current Drug Metabolism 2007; Vol.8, No.6, pp. 526553.
56. United States Renal Data System.: Annual Data Report (ADR) 2006; Volume I: ATLAS of Chronic Kidney disease and endstage renal disease in the United States, Available from http://www.usrds.org/.
57. 行政院衛生署健保局: 台灣末期腎臟疾病患者統計報告, 臺北, 衛生署, http://www.nhi.gov.tw/webdata/webdata.asp?menu=17&menu_id=661&webdata_id=818&WD_ID=.
From Pharmacovigilance to Pharmacovigilance Planning
Hui-Po Wang
Taipei Medical University College of Pharmacy
Abstract
The concept of pharmacovigilance planning (PVP), initiated by the International Conference on Harmonization (ICH) in 2004, addressed an important conceptual change from individual product-oriented pharmacovigilance to a proactive risk prevention and minimization on medication. However, the implementation of PVP is a challenge in societies like Taiwan where irrational medication or co-medication is prevalent. This report addresses the opinion on system building for safe medication in Taiwan. Aspects included are (1) the scientific basis of system biology that governs xenobiotics-host interaction; (2) the beauty and odds of xenobiotics in biological system; (3) non-biased risk-benefit assessment of xenobiotics to be used for medication purpose; (4) summary of public information regarding to the risk underlying co-medication of drugs with complementary/alternative medicine; (5) epidemiology of co-medication of medicine with complementary/alternative medicine.
Keywords: xenobiotics, polypharmacy, co-medication, complementary/alternative medicine (CAM), traditional Chinese medicine (TCM), nutraceuticals, pharmacovigilance planning

