摘要
醫學研究種類繁多,其中屬藥品臨床試驗,如新藥開發、上市藥品拓展新適應症、新劑型開發以至學名藥欲證明與原開發廠療效相同,都需運用科學方式提供足以信賴之證據,方可運用於臨床上。臨床試驗除計劃主持人、研究護士、臨床研究專員外,尚須藥師參與擔任管理臨床試驗藥品的角色。
臨床試驗藥品與一般臨床藥品的管理有許多不同,本文提供某醫學中心藥師實際參與臨床試驗藥品管理之經驗,期望拋磚引玉對此類藥品管理有所迴響。
關鍵字: 臨床試驗藥品管理、藥品優良臨床試驗準則、藥師、management of investigational product、good clinical practice、pharmacist
壹、前言
臨床試驗是醫學研究發展過程中不可或缺的過程。新藥、新技術及新醫療器材,或是擴展新適應症、新劑型均需運用科學方式提供可信之證據,以應用於維護人類健康及促進社會福祉。近年來實證醫學成為顯學,設計良好的隨機分派控制試驗 (RCTs, Randomized controlled Trials) 證據等級較高,成為醫療決策的重要參考依據。
人類歷史中發生過許多不道德醫學研究案例,如二次大戰期間,納粹醫師與科學家對被俘虜的猶太人進行低氧、低溫、化學戰劑等人體試驗,最終這些醫師與科學家在紐倫堡受到審判1;1932至1945日本731部隊在中國大量進行鼠疫、天花、傷寒、霍亂等病毒之活人實驗2。1947年發表的「紐倫堡宣言」為全球醫界首次對人體試驗提出的倫理規範,直至1964年世界醫學會 (WMA, World Medical Association) 發表之「赫爾辛基宣言」成為國際間臨床試驗道德規範之依歸2。因各國新藥上市審核條件不同,藥廠為符合各國規定須重複多次試驗,不僅增加研發成本,亦延誤病患治療之時機。有鑑於各國醫藥品管理法規協合化之需求,美國、歐盟和日本藥政主管機關及製藥業於1990年成立國際醫藥法規協合會 (ICH, International Conference on Harmonization) 以共同制定國際規範,一致的新藥審核標準加速研發及上市,並可減少重複試驗的昂貴成本,使患者及早獲得新的治療1。我國於2005年1月6日參考ICH-E63制定並發佈藥品優良臨床試驗準則 (GCP, Good Clinical Practice)4,使國內臨床試驗與國際接軌。
貳、臨床試驗藥局與專責藥師必要性
藥品管理是藥師的天職,尤對尚無法確知療效與安全的藥品,在調劑、保存與紀錄更須審慎管理。另因臨床試驗藥品發放方式受制於各試驗之設計,與一般治療用藥極為不同,為避免工作流程造成調劑困難,建議將臨床試驗與臨床應用兩種藥品分開,成立專屬臨床試驗藥局管理。
個案醫院依據相關法規制定「人體試驗管理作業準則」5,對試驗藥品管理明確規定:「試驗用藥應存放於『臨床試驗藥品中心』或藥局,由專責藥師管理;如有特殊狀況須以個案簽呈呈報,委員會核准後得由試驗主持人自行管理。」;前述準則公佈前曾進行試驗藥品管理查核,計畫主持人大多將藥品管理工作委由研究護士或助理處理,管理缺失包含未依計畫分別管理、溫溼度監控未落實、可用藥品與回收藥品混雜、冷藏櫃未使用緊急電源、藥品存放未適當管控,未授權者亦可取得等。為改善前述缺失藥師除加強各計畫人員藥品管理能力,並積極規劃建置臨床試驗藥局,使臨床試驗藥品回歸專業藥師管理,目前已無試驗主持人自行管理之案件。衛生署衛署藥字第0980343086號函公佈後,個案醫院陸續接獲其他醫院詢問與觀摩,足見個案醫院在試驗藥品管理方面之經驗。
參、臨床試驗藥局管理實績
個案醫院於2005年6月21日成立臨床試驗藥局,當時配置兩名藥師,負責管理所屬院區臨床試驗藥品。後因業務量日增,由三名藥師負責所屬院區臨床試驗藥品及全體系試驗藥品編碼與進度控管。
該藥局以「追求卓越,要做就做最好的」為目標,有感於每試驗案均由研究團隊縝密計劃、高額研發成本及寶貴受試者共同完成,因而認真面對每一試驗案,不讓試驗案因藥品管理缺失而導致失敗。
一、業務範圍
依臨床試驗藥品管理規範,專責藥師管理之試驗藥品涵蓋:經人體試驗倫理委員會審議通過之臨床試驗案藥品非本院採購供一般臨床使用者,一律納入臨床試驗藥局管理。除具化療特性之試驗藥品由化療藥局管理外,其餘試驗藥品均由臨床試驗藥局管理,此外,尚須定期查核化療藥局及主持人自行管理之試驗藥品並協助全院區試驗藥品編碼建檔。
二、 試驗藥品編碼收件及電腦上線審查流程 (圖一)
試驗藥品管理由藥劑部負責編碼及行政審查,研擬藥品品名、規格、含量、包裝形式等資訊後呈相關主管建置藥品檔,編碼後得以電腦醫令開方,並連結批價、庫存及資訊管理,經計劃核准之醫師開立處方後,由研究助理持處方至臨床試驗藥局領藥。試驗藥品編碼建檔前,需與主持人或委託廠商討論計劃內容、執行細節,並審核相關文件 (包含核准函、計劃書、藥品管理繳款證明、主持人手冊等)。
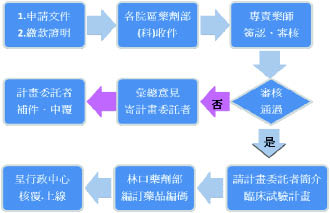
圖一 臨床試驗藥品管理流程圖
三、專責藥師例行業務
1.試驗藥品之管理、調劑、使用監測、儲藏供應、分裝及相關協調等事宜。藥品點收與存放時需核對試驗藥品之包裝及標示是否符合法令與試驗案之規定,如標示或說明、製造日期、使用期限、用量記載、運送、供應、貯藏方式並標明「人體試驗專用」等。尤應注意所有試驗藥品僅供參與試驗之醫師處方,以確保試驗藥品供應予符合該試驗案之受試者。
2.臨床試驗藥局設施之維護:每工作日上、下班分別記錄室溫與冷藏 (凍) 櫃溫 (濕) 度;每月主動寄發溫濕度記錄予委託廠商,以維護試驗藥品存放環境品質。
3.其他:(1)每試驗案獨立存放並上鎖保管。(2)製作每案受試者名冊 (Subjects List)、試驗藥品調劑、發藥注意事項、試驗藥品調劑記錄表 (Investigational Product Inventory) 等表單。(3)調劑試驗藥品應確保試驗盲性設計,含雙盲試驗案中為非盲性人員藥品調劑、記錄工作。(4)協助建置、維護全體系試驗藥品之檔案以確實掌握各院區管理情形。
四、執行成果
2009年度臨床試驗藥品管理案件數如表一,該年度監測、稽核、查核均無缺失。另因業務主要接洽以委託廠商之臨床研究專員 (CRA, Clinical Research Associate) 與研究助理 (CRC, Clinical Research Coordinator) 為主,2008年底對前述對象進行臨床試驗藥局滿意度調查。問卷共計130份,回收96份,回收率76.8%,在藥局作業流程方面滿意度達滿意以上的比例為93.1%,部分受訪者表示個案醫院的行政流程仍有簡化的空間;藥品儲存空間、監控方式等硬體設備部份滿意度達滿意以上為96.6%,然因個案醫院規模大,受訪者建議臨床試驗藥局應搬遷至較為中央的地理位置以利研究護士領用試驗藥物,針對此項個案醫院於2009年9月已將臨床試驗藥局搬遷至院區核心地點,並改善空間與硬體設備;藥師專業知識部份滿意度達滿意以上的比例更高達100%,而藥師服務態度滿意度達滿意以上為97.7%;文件紀錄品質滿意度達滿意以上則為100%,但仍希望個案醫院能填寫試驗委託廠商的表格,並增加管理回收的試驗藥品業務 (表二)。
表一 體系委託廠商贊助臨床試驗案件數
院區 |
試驗案件數 |
需藥品管理者 |
尚未進行 |
藥品存放藥局管理案件 |
查核 |
林口 |
225 |
190 |
13 |
170 |
7 a |
高雄 |
108 |
89 |
8 |
81 |
0 |
台北 |
12 |
9 |
0 |
9 |
0 |
基隆 |
22 |
16 |
1 |
15 |
0 |
嘉義 |
26 |
22 |
4 |
18 |
0 |
合計 |
393 |
326 |
26 |
293 |
7 |
註: a均為核醫藥品由核醫藥師負責,臨床試驗藥品管理藥師仍須定期查核
註: 數據資料統計至2010年1月31日
表二 臨床試驗藥局滿意度調查
項目 |
很滿意 |
滿意 |
不滿意 |
很不滿意 |
合計 |
藥局作業流程 |
40 (46.0%) |
41 (47.1%) |
5 (5.7%) |
1 (1.1%) |
87 (100%) |
儲藏空間(室溫及冷藏)、溫度監控等硬體設備 |
44 (50.6%) |
40 (46.0%) |
3 (3.4%) |
0 (0%) |
87 (100%) |
藥師專業知識 |
52 (59.8%) |
35 (40.2%) |
0 (0%) |
0 (0%) |
87 (100%) |
藥師服務態度 |
57 (65.5%) |
28 (32.2%) |
2 (2.3%) |
0 (0%) |
87 (100%) |
文件記錄的品質* |
49 (58.3%) |
35 (41.7%) |
0 (0%) |
0 (0%) |
84 (100%) |
*本題有3人未回答 |
肆、挑戰與問題
臨床試驗藥局管理較一般藥局有許多不同,如:1.試驗藥品的發放受制於試驗設計,專責藥師須了解每一計劃設計的發放方式,並非如臨床應用藥品單純由用法用量與天數計算。如雙盲雙虛擬設計每次需配發兩種藥品,使受試者能依試驗設計方式服用;雙盲試驗中藥師為解盲藥師 (unblinded pharmacist),藥師須依計劃調劑藥品負責維持盲性之要求。2.為完整記載受試者病歷且因應電子病歷趨勢,試驗藥品領用仍須開立醫囑。許多試驗案因設計不同無法結合現行醫囑系統,在藥品編碼時需異中求同考量其相關變數。3.試驗藥品僅可由計劃核准之醫師處方給藥參與計劃之受試者。目前均由藥師人工建檔核對,難免有疏漏,如以資訊系統輔助比對將更加完善。但因此資訊系統建置尚未健全且有權限問題,仍無法有效落實受試者管理。4.病人數眾多、研究團隊品質佳,參考衛生署台灣藥品臨床試驗資訊網之公開資訊6,個案醫院試驗案件數多,較已設立國家級卓越臨床試驗中心不遑多讓。臨床試驗案件持續成長,藥品存放空間與設備需求日增,然因試驗設計差異,藥品存放空間與設備需求預估不易。5.專責藥師應具臨床藥學訓練、GCP訓練認證、細心、英語及協調能力佳等多項特質,人才培養不易。再加上藥師須了解每試驗案之發藥標準程序因此不宜頻繁更動,將使專責藥師缺乏其他業務輪訓機會,此專責職務在人力資源運用上需作更宏觀之整體考量。
伍、結論
臨床試驗藥品管理是近年來藥劑部門新接觸之業務,隨著試驗案件增加,不論是社會對臨床試驗倫理議題重視、人體試驗委員會加強稽核、醫療機構對研究能力重視、藥廠開發新藥擴展市場殷切均讓執行品質要求 (包含試驗藥品管理) 不斷增加。而目前僅大型機構設立專責藥師管理,其他許多醫院均由一般藥局或主持人自行管理,可能導致試驗藥物因無專責人員管理而造成缺失。
期望藉此文分享試驗藥品管理經驗與挑戰,使其他機構可及早規劃建置相關作業標準與制度,讓藥師在臨床試驗藥品管理之品質提升,使台灣在執行臨床試驗更具國際競爭力。
參考資料:
1. 葉嘉新、林志六:新藥開發與臨床試驗,第一版。台北,秀威資訊科技股份有限公司,2008。
2. 郭英調:臨床研究手冊,2000。
3. 國際醫藥法規協合會Http://www.ich.org/cache/compo/475-272-1.html#E6。擷取日期:2009年6月1日。
4. 藥品優良臨床試驗準則,2005。
5. 聯合人體試驗委員會 http://www.jirb.org.tw/laws.asp。擷取日期:2009年6月1日。
6. 台灣藥品臨床試驗資訊網 http://www.cde.org.tw/ct_taiwan/index.htm。擷取日期:2009年6月6日。
Experiences in Management of Investigation Products
Wei-Han Chang, Wei-Li Chen, Chia-Hui Lin, Hsiu-Yin Wang
Department of Pharmacy, Chang Gung Medical Foundation, Linkou, Taiwan
Abstract
All varieties of medical researches are required to be scientifically validated before clinical applications and clinical trials involved drug intervention also included. Examples of clinical trials involved drug intervention are new drug development, new indication and formulation explorations, and bioequivalence comparison to brand drugs. In addition to principal investigators, clinical research coordinators, and clinical research associates, pharmacists also play a vital role in the management of investigational products.
In the aspect of drugs management, there are lots of difference between investigational drugs and ordinary medications. With the expectation of eliciting more responses to investigational drug management, this article provides practical experiences of pharmacists in a teaching hospital setting.

