摘要
幹細胞 (stem cells) 是一群原始未分化的細胞,具有分化 (differentiation) 成其它具功能性細胞與自我新生 (self-renewal) 產生新幹細胞的能力。常見的幹細胞分為胚胎幹細胞 (embryonic stem cell)、成體幹細胞 (adult stem cell) 與最近最熱門的腫瘤幹細胞 (cancer stem cell)。幹細胞再生醫學正如火如荼的展開,若對幹細胞的調控能清楚了解,幹細胞療法必能改變人類對於疾病的應對方式。雖然目前誘導幹細胞分化與維持幹細胞特性 (stemness) 都是利用重組蛋白來達到目的,然而亦有些科學家期望經由正進行研究的化學結構簡單的小分子藥物也能達到相同結果,最有名的例子就是retinol可以抑制胚胎幹細胞的分化能力1,使其細胞維持在細胞新生狀態,因此我們藥師對於此類治療必須有所了解,以期在未來幹細胞療法研發的過程中不落人後。
關鍵字: 幹細胞、分化、stem cell、differentiation、stem cell regenerative medicine、iPS
壹、前言
老鼠胚胎幹細胞於80年代就被建立2,然而人類胚胎幹細胞晚了將近20年,由Thomson JA團隊與Gearhart JD團隊建立胚胎幹細胞株3-4,正式開啟幹細胞治療的新頁。胚胎幹細胞目前被認為可以變成身體任何一種具功能的細胞,屬於萬能幹細胞 (totipotent),正因為如此,先前的研究學者想利用此類細胞進行細胞療法,希望為衰敗的器官和目前無可醫治的疾病,燃起重生的希望,然而胚胎幹細胞若移植到老鼠身上卻會長成畸胎瘤,因此限制了此類細胞的應用。基於胚胎幹細胞使用上的限制,日本京都大學山中彌伸教授於2006年在細胞雜誌發表利用四個基因改造老鼠纖維母細胞,成功將成體細胞誘導為類胚胎幹細胞5,之後相繼又有文獻利用不同的四個基因在人類細胞得到類似結果6,使胚胎幹細胞療法更上一層樓。
成體幹細胞是多功能性的細胞 (pluripotent),一般認為不具有跨胚層的分化和可塑性能力,如骨髓幹細胞只能分化為脂肪、骨骼及軟骨同樣為中胚層的細胞。目前成體幹細胞可自骨髓、皮膚、腦、骨骼肌、肝臟及大部份等器官分離出,這些細胞的存在乃為補充正常代謝下所損失的組織細胞,由於成體幹細胞較胚胎幹細胞不具道德爭議,因此,成體幹細胞在幹細胞療法中是目前極熱門的領域。
貳、胚胎幹細胞
胚胎幹細胞是從囊胚 (blastocyst) 的inner cell mass取得,其珍貴之處,在於其具有完全能力發展為三個胚層所需之不同的細胞,甚至可以複製一個完整個體,所以稱為萬能幹細胞。由於此類細胞的可塑性和可以無限制的新生與增生,胚胎幹細胞治療已被認為是再生醫學最好的材料。利用胚胎幹細胞治療的疾病包含遺傳的血液或免疫疾病、癌症、巴金森氏症和先天性糖尿病等,但是由於此類細胞來源具有高道德爭議性,且目前病人使用的胚胎幹細胞非患者本身的,可能會有排斥現象 (graft-versus-host disease),加上有前述致畸胎瘤的疑慮,所以訂做個人的胚胎幹細胞便成為新的研究方向。細胞核轉殖 (nuclear transfer) 技術就是想解決這個問題,眾所皆知的桃莉羊就是利用此技術所複製的動物7,其方法就是將卵細胞中的細胞核移除,以顯微注射的方式將成體細胞的細胞核轉殖到去核的卵細胞中,再進行高壓電擊讓細胞融合並使細胞活化分裂,但此方法效率極低(桃莉羊是277分之1成功率),所以當韓國科學家發表突破性的高成功率時曾造成轟動,結果卻爆出造假風波。雖說本技術成功率不高,然而在農業發展已漸趨成熟,若是要保存稀有動植物,目前都可以使用此技術,或許將來我們可以看到利用核轉殖技術重現侏羅紀恐龍時代的景象。
由於細胞核轉殖技術門檻高且失敗率也高,山中彌伸教授的iPS (induced pluripotent stem cells) 細胞是將Oct4, Sox2, Klf4和 c-Myc四個轉錄因子 (transcriptional factor, 轉錄因子為基因表現的調控蛋白) 以反轉錄病毒載體送進老鼠的纖維母細胞,此技術能強迫這些基因讓體細胞回復成類多功能幹細胞,然而c-Myc乃是致癌基因,故在醫療臨床運用上有疑慮。在2007年科學雜誌中美國科學家利用Oct4, Sox2, Nanog和 Lin28另一組四個基因5-6,也成功的將人類纖維母細胞轉型為iPS細胞,此細胞能表現出胚胎幹細胞相關基因,且能分化為三個不同胚層的細胞,或許將來我們可以從病人取得的皮膚細胞量身訂做一個私人的幹細胞庫,讓iPS細胞用來治療人類退化性疾病邁入真正的臨床新紀元。
參、成體幹細胞
成體幹細胞是胚胎生長後一群未分化的細胞,存在我們體內許多器官中,因此不像胚胎幹細胞一樣可以分化成任一種細胞,一般認為同胚層的分化是成體幹細胞最主要角色,然而越來越多的證據(包含本實驗室研究)顯示,成體幹細胞是可跨胚層分化的,如中胚層的臍帶間質幹細胞可以分化為外胚層的皮膚細胞,進行傷口癒合,不過是很有限的分化能力。目前成體幹細胞的分類,包括造血系幹細胞 (hematopoietic stem cell)、間質系幹細胞 (mesenchymal stem cell)、神經幹細胞 (neural stem cell)、肝臟幹細胞 (oval cell) 等8-9。
由臍帶血、骨髓和周邊血液分離而來的造血系幹細胞,是目前研究最為透徹且已進入臨床使用的幹細胞。在1980年代末期,臨床醫生們已經了解新生兒的臍帶及胎盤血液中含有大量的造血幹細胞,因臍帶血具有未受污染、新生 (self-renewal) 代數較多、屬於不具侵入性的醫療廢棄物和排斥性低等優點,因此,使得臍帶血應用的範圍更為寬廣,甚至逐漸取代骨髓移植與周邊血移植等治療方式,因此,目前臍帶血血庫的發展可望為未來臍帶血幹細胞療法帶來更多資源10。此外,也有科學家自女性經血中分離出幹細胞11,但此類幹細胞非造血系幹細胞,乃是間質系幹細胞(下段介紹),此類細胞在體外實驗可以分化為心臟細胞,甚至已經在動物實驗證明可以治療中風的老鼠,所以月經血以後或許不再是廢棄物,將來甚至可以用來治療退化性疾病。
間質系幹細胞是近年來熱門的研究課題之一,主要原因在於它的體外增殖及多重分化能力,使得先前無法以藥物治癒的疾病,進而可以藉由組織工程及細胞療法加以治療。間質系幹細胞最初是由Alexander Friedenstein所發現,在骨髓中存在一些中胚層結締組織的細胞,且證明這些細胞在體外可分化成為硬骨及脂肪細胞12,後來牛津大學Maureen Owen教授發現骨髓中除了漂浮的造血幹細胞外,還有一群會貼附培養皿的細胞。1999年科學雜誌揭露人類骨髓中有一群特殊的細胞,雖然為數不多,但是這些細胞卻具有極為優異的生長和分化能力,且能在體外大量增殖,之後科學家推測人體所有組織中可能都有間質幹細胞的存在,目的在維持器官組織的恆定及細胞的更新與補充。目前成體幹細胞的分離普遍使用螢光活化流式細胞儀 (fluorescence-activated cell sorter,FACS) 加以區分,利用接合螢光的抗體能辨識幹細胞膜上的特定蛋白,以FACS 儀器中的雷射來偵測細胞的光散射與螢光特性來分離幹細胞,如間質幹細胞的細胞表面抗原為CD90和CD105等。我們也利用CD34-和CD105+成功分離出瓦頓氏凝膠 (Wharton's jelly) 的間質幹細胞(圖一)13-14。另外,也有文獻指出間質幹細胞可以成球狀 (sphere) 懸浮生長,我們也發現子宮內膜間質幹細胞能球狀生長(圖二),因此利用這些技術我們能間接確認且分離間質幹細胞。
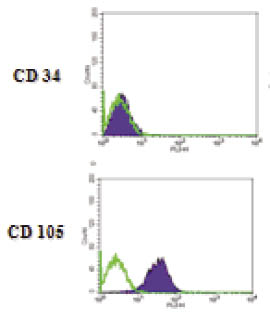
圖一 利用流式細胞儀分離出CD34-和CD105+的間質幹細胞。綠色是沒有表現CD marker的螢光量;藍色是將細胞染螢光之後CD marker的表現量
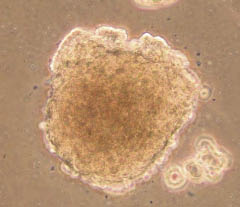
圖二 子宮內膜幹細胞在體外懸浮球狀生長
近年來發現新生兒臍帶除了臍帶血之外至少還存在有另一種幹細胞,瓦頓氏凝膠 (臍帶除了血管外的基質統稱)中的間質幹細胞。研究指出從臍帶間質所分離出來的間質幹細胞,在體外不但會分化為骨骼和脂肪細胞,也可以誘導分化為神經和心肌細胞。根據我們的經驗,這些人類臍帶間質幹細胞擁有收集容易、幹細胞數量豐富、年輕、增生穩定、分化力強、無組織抗原表現等優點,都比臍帶血和骨髓幹細胞來得更為優良13。
肆、結論
幹細胞研究是一個劃時代的新技術,也確實對許多疾病的治療提供了新希望,使用胚胎幹細胞除了有複製人的疑慮外,更有道德上的爭議;iPS細胞雖然較無道德爭議,但是細胞來源與接受者之間的個體差異,尚需要更多法令予以保障14。在2010年有科學家發表利用iPS細胞運用四倍體互補的技術 (tetraploid complementation) 複製出iPS小鼠15,所以iPS細胞也升起複製人的疑慮;目前成體幹細胞是最快運用於臨床治療,但是幹細胞培養的環境與液態氮儲存系統,都可能具有污染的風險,此外,科學家目前對於幹細胞相關基因的開啟和調控所知仍有限,因此在邁入醫療應用之際,醫師與科學家必須抱持著審慎的態度且不貿進,如此才能真正造福病人。
參考資料:
1. Chen L, Yang M, Dawes J, Khillan JS. Suppression of ES cell differentiation by retinol (vitamin A) via the overexpression of Nanog. Differentiation 2007; 75: 682-93.
2. Evans MJ, Kaufman MH: Establishment in culture of pluripotential cells from mouse embryos. Nature 1981; 292: 154-6.
3. Thomson JA, Itskovitz-Eldor J, Shapiro SS, Waknitz MA, et al: Embryonic stem cell lines derived from human blastocysts. Science 1998; 282: 1145-7.
4. Shamblott MJ, Axelman J, Wang S, Bugg EM, et al: Derivation of pluripotent stem cells from cultured human primordial germ cells. Proc Natl Acad Sci U S A 1998; 95: 13726-31.
5. Takahashi K, Yamanaka S: Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell 2006; 126: 663-76.
6. Yu J, Vodyanik MA, Smuga-Otto K, Antosiewicz-Bourget J, Frane JL: Induced pluripotent stem cell lines derived from human somatic cells. Science 2007; 5858: 1917-20.
7. Ashworth D, Bishop M, Campbell K, Colman A et al: DNA microsatellite analysis of Dolly. Nature 1998; 394: 329.
8. 李光申:間葉系幹細胞。科學發展 2007;414:18-21.
9. Baksh D, Song L, Tuan RS: Adult mesenchymal stem cells: characterization, differentiation, and application in cell and gene therapy. J Cell Mol Med 2004; 8: 301-316.
10. Lee OK, Kuo TK, Chen WM, et al: Isolation of multipotent mesenchymal stem cells from umbilical cord blood. Blood 2004; 103: 1669-1675.
11. Musina RA, Belyavski AV, Tarusova OV, Solovyova EV et al: Endometrial mesenchymal stem cells isolated from the menstrual blood. Bull Exp Biol Med 2008; 145: 539-43
12. Friedenstein AJ: Osteogenetic activity of transplanted transitional epithelium. Acta Anat (Basel) 1961; 45: 31-59.
13. Troyer DL, Weiss ML: Wharton's jelly-derived cells are a primitive stromal cell population. Stem Cells. 2008; 26: 591-599.
14. Zarzeczny A, Scott C, Hyun I et al: iPS cells: mapping the policy issues. Cell 2009; 139: 1032-7
15. Han J, Yuan P, Yang H et al: Tbx3 improves the germ-line competency of induced pluripotent stem cells. Nature, 2010; 463:1096-1100.
Stem Cells
Chien-Chih Ou1, Hsin-Pao Pan2 and Mei-Yun Lung3
Department of Pharmacology, National Defense Medical Center1
Department of Pharmacy, Hualien Armed Forces General Hospital2
Department of Pharmacy, Keelung Hospital, Department of Health3
Abstract
Stem cells are characterized by the ability to renew themselves (self-renewal) and differentiating into a diverse range of functional cell types. They can be divided into three major groups: embryonic, adult and cancer stem cells. Regarding to the molecular mechanisms regulating cell-fate and function, stem cell-based therapy would provide a better strategy against a wider variety of diseases and impairments in the future. Conventionally, the understanding of biological phenomenon in stem cells was achieved by recombinant proteins. Now, chemical approaches and small molecule drugs have provided the key to many stem cell biological discoveries. Therefore, it is important for our pharmacist to have comprehensive understanding in stem cell therapy so that we will not fall behind.

