摘要
腎功能不良病人給予含釓顯影劑 (gadolinium-based contrast agents; GdBCA),會造成嚴重皮膚或內臟器官纖維化,稱為腎因性全身性纖維化症。病人進行核磁共振攝影的影像學檢查時,接受線性較不穩定或是高劑量含釓顯影劑注入,經由配位基轉移作用,易釋放游離釓沉積於組織,吸引循環纖維母細胞啟動纖維化過程,造成腎因性全身纖維化症。其他風險因子尚包括發炎反應、電解質不平衡等。但是,目前並沒有有效的治療方法,預防為最有效的方式。因此,美國 FDA 建議,病人接受核磁共振攝影影像學檢查前,應先經由病人病史及臨床檢驗數據評估病人腎功能。第四期及第五期腎功能不良的病人、肝腎綜合症或肝臟移植期間引起急性腎功能下降之病人,應避免使用含釓顯影劑。接受顯影檢查者,應透過規律血液透析,加速含釓顯影劑代謝,以降低副作用。
關鍵字: 腎因性全身纖維化、核磁共振攝影、核磁共振血管攝影、含釓顯影劑、配位基轉移
壹、前言
腎因性全身性纖維化 (nephrogenic systemic fibrosis, NSF) 最早病例發現於1997-2000,由 Cowper 等研究者在15位洗腎及腎衰竭移植病人觀察到皮膚出現嚴重硬結,和侵犯皮膚苔蘚性黏液水腫相似,因此命名為腎源性纖維化皮膚病變 (nephrogenic fibrosing dermopathy, NFD)。2003年,研究發現有些病人也會產生肌肉、肌腱、橫膈膜,甚至心、肝、肺等內臟器官纖維化,因此用「全身性」強調纖維化的影響,更名為「腎因性全身性纖維化」1。2006年 Grobner 等研究者發現2,釓 (gadolinium; Gd) 鑭系稀土族元素,原子序64,原子量157.25,應用於核磁共振攝影 (magnetic resonance imaging, MRI) 作為顯影劑會引起 NSF,美國食品藥物管理局 (FDA) 已登記612件案例。幾乎所有病例都為成年人,但亦有兒童受到影響。因此 NSF 疾病的發生不分種族、性別及年齡,腎衰竭的病人都有可能發生。NSF 主要發現於腎衰竭病人接觸到含釓顯影劑而造成全身性纖維化,因而被認定為一個新的疾病。
貳、臨床表徵及疾病進展
NSF 幾乎所有病人都會出現皮膚表徵,少數病人則會產生全身性症狀。皮膚產生二側對稱性丘疹硬塊、斑塊或皮下節結。先由關節、下肢及手出現症狀,漸漸蔓延到大腿及前臂,但較少發生在軀幹的皮膚或臀部。傷害發生前,皮膚會先產生水腫,容易被誤診為蜂窩性組織炎,水腫漸漸消除後組織會逐漸變厚及變硬,產生鵝卵石或橘皮樣變化。皮膚受到傷害的部位會產生騷癢並伴隨尖銳刺痛或燒灼感。皮膚受損逐漸擴大到關節,因纖維化使其靈活機動性受限。晚期則會產生色素過度沉著、頭髮減少及皮膚萎縮等現象;眼睛瞳孔也可能會產生黃色斑塊3。某些病人,纖維化甚至會影響內臟器官,包括橫膈膜 (導致呼吸衰竭)、肺臟 (降低一氧化碳交換能力)、心臟、胸膜等,造成嚴重功能喪失。
NSF 是慢性持續進展的疾病,當病人持續使用含釓藥品,可能造成猛發型 NSF,病人四肢會快速屈區攣縮而喪失活動力,數週內即惡化至需要坐輪椅的狀態。
參、含釓顯影劑基礎介紹及應用
MRI 原理是以射頻 (radio frequency) 電波加給磁場中的原子核,造成磁偶極擾動,再移除干擾讓原子核回復原來狀態,測量其所發出的電磁波。影像信號從體內水或脂肪的氫原子所發出,改變氫原子核的特性是個可行的方法。因此臨床上使用釓順磁物質來使 T1 變短以增強訊號。釓不具組織專一性,為高滲透 (650 mOsm/kg) 物質,應用於核磁共振及血管攝影 (magnetic resonance angiography, MRA)。由於游離釓不溶於水及具高毒性,並抑制鈣離子通道,對心臟及神經系統都會產生影響4,因此必需與螫合劑 DTPA (diethylene triamine penta acetate) 結合成 Gd-DTPA 改善水溶性並減少毒性,才可使用於人體。含釓螫合劑依電荷及結構可分為離子性或非離子性、線狀或環狀 (表一) (圖一);一般而言,離子性環狀螫合劑比非離子性線狀螫合劑具較高穩定性4,5。
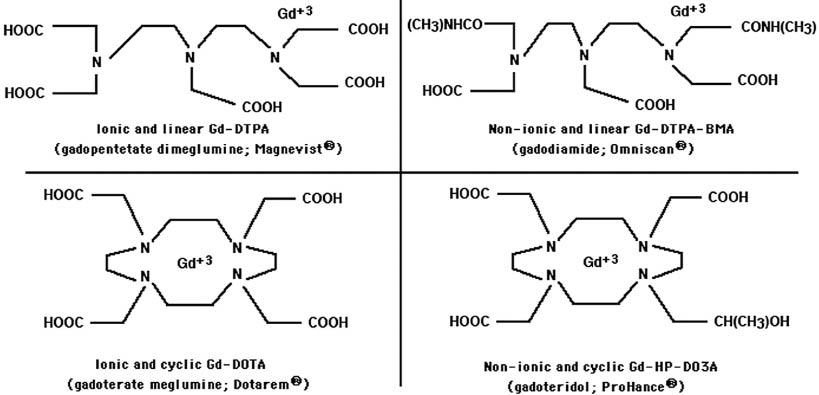
圖一 不同含釓顯影劑結構5
表一 臨床使用含釓顯影劑物理化學特性4
Name |
Brand name |
Molecular structure |
Ionicity |
Thermodynamic stability constant |
Conditional stability |
Amount of excess chelate, mg/mL |
Kinetic stability (dissociation half-life at pH 1.0) |
FDA approvel |
Gadodiamide |
Omniscan |
Linear |
Non-ionic |
16.9 |
14.9 |
12 |
35s |
1993 |
Gadoversetamide |
Optimark |
Linear |
Non-ionic |
16.6 |
15 |
28.4 |
not available |
1999 |
Gadopentetate |
Magnevist |
Linear |
Ionic |
22.1 |
18.1 |
0.4 |
10 min |
1988 |
Gadobenate |
Multihance |
Linear |
Ionic |
22.6 |
18.4 |
none |
not available |
2004 |
Gadoteridol |
Prohance |
Cyclic |
Non-ionic |
23.8 |
17.1 |
0.23 |
3 h |
1992 |
Gadobutrol |
Gadovist |
Cyclic |
Non-ionic |
21.8 |
not available |
not available |
24 h |
|
Gadoterate |
Dotarem |
Cyclic |
Ionic |
25.8 |
18.8 |
none |
>1 month |
含釓螫合劑以原型態由腎臟排出,健康者使用後半衰期為1.3小時;末期腎臟病病人半衰期則延長至34小時。投與含釓螫合劑後,病人如接受血液透析則半衰期可縮短為1.9-2.6小時。
目前 FDA 通過的含釓顯影劑為 gadodiamide、gadopentetate dimeglumine、gadoversetamide 等 (表一) 4。每種含釓顯影劑造成 NSF 機率不同,可能在於分子結構及電荷差異造成不同的毒性,gadodiamide 具最大相關性,其次為 gadopentetate,而 gadoversetamide 也有發生少數病例 (表二)6。另一個影響因素是穩定常數,不同的含釓顯影劑具有不同的穩定常數4,含釓顯影劑穩定性越低,越容易與其他陽離子 (如鋅、鐵、銅、鋁等) 競爭而解離;陰性磷酸根離子在腎衰竭病人易增加解離,產生游離釓離子,沉積在組織造成纖維化,此現象稱為配位基轉移 (transmetallation),其中又以 gadodiamide 最為常見4,5,酸性環境亦會促進配位基轉移作用。
表二 至2008年二月同儕評鑑文獻由活體檢體證明 NSF 和含釓顯影劑相關個案數6
Gd-CA |
Number of patients |
Omniscan |
157 |
Magnevist |
8 |
Optimark |
3 |
Unspecified Gd-CA |
18 |
Confounded cases with>1 Gd-CA |
4 |
No cases NSF in the peer-reviewed medical literature have been reported to be associated with macrocyclic agents. There have been 23 cases (20 Magnevist, 3 Omniscan) of NSF but without skin biopsy reported in the literature. |
|
肆、病理分子機轉
造成 NSF 的病理機制目前並不確定,主要經由二個途徑:一、活化生長因子 (transforming growth factor-beta-1, TGF-β1) 路徑。二、增加循環纖維母細胞。
進行 ex vivo 實驗,從病人身上取出皮膚細胞培養,當接觸到含釓顯影劑,會使第一型基質金屬蛋白酵素 (matrix metalloproteinases-1, MMP-1) 及組織抑制第一型基質金屬蛋白酵素增加。在大鼠實驗中,給予含釓顯影劑,會促進部分細胞激素 (cytokines) 釋放,包括單核球趨化激素第一型及第三型 (monocyte chemotactic proteins MCP-1, MCP-3)、巨噬細胞發炎蛋白 (macrophage inflammatory protein)、腫瘤壞死因子 (tumor necrosis factor)、血管上皮生長因子及骨橋蛋白 (osteopontin) 等。不論是游離釓或釓與陰離子形成複合物,都會促進細胞激素釋放,作為化學趨化物質吸引巨噬細胞聚集,巨噬細胞更進一步促進細胞激素釋放,吸引、幫助傷口癒合及組織修復的纖維細胞 (fibrocyte) 匯集。循環纖維細胞 (CD34、CD45RO 及 CD68 染色呈陽性) 及原膠原第一型 (procollagen I),促進 T 細胞活化,疤痕形成 (scar formation),最終造成組織纖維化7。
其他因子包括發炎性反應、代謝性酸中毒、使用紅血球生長激素的劑量或高血磷狀態,與 NSF 的風險增加,可能都扮演重要的角色,但機轉未明8。
伍、治療及預防
NSF 是一個很新,且致病機轉尚未明瞭的疾病,治療追蹤病例數亦有限,預防是目前最重要的方法。而物理治療為基本,以維持關節靈活度,避免關節及皮膚攣縮使活動受限。藥品治療包括給予 imatinib、cyclophosphamide、高劑量免疫球蛋白、局部病灶注射 glucocorticoid 等。
血漿分離術 (plasmapheresis) 治療,難以確認是否能真正達到治療效果,或是源於病人本身腎功能改善而使病況減緩;在其他研究中,血漿分離術治療無效8。另一方面,給予含釓顯影劑後經由血液透析,使腎臟功能改善,可有效改善 NSF 病程。另有體外光化學療法 (extracorporeal photopheresis, ECP),病人先塗抹或口服 8-MOP (8-methoxypsoralen) 感光劑,再透過多次長波紫外線照射,達到治療功效。目前已知的長波紫外線光化學治療機轉經由單核球衍生腫瘤壞死因子 (TNF-α) 抑制膠原蛋白合成及促進膠原蛋白酶 (collagenase) 產生。
陸、結論
目前已知非離子線狀含釓顯影劑和 NSF 具相關性,2007年5月23日美國 FDA 發布警訊,要求含釓顯影劑的仿單增訂重要警訊:所有含釓顯影劑可能有導致 NSF 的風險。洗腎或腎功能不良病人使用含釓顯影劑,產生 NSF 風險較高。仿單中應詳述並強調:急、慢性腎功能不良 (GFR<30 mL/min/1.73 m2)、肝腎綜合症或肝臟移植期間引起急性腎功能下降之病人,應避免使用含釓顯影劑,除非病人有必要接受診斷,且無法以非含釓顯影劑來增強 MRI 診斷效果。FDA 又於2007年9月28日再次發布警訊通知醫療人員,所有含釓顯影劑仿單增加 BOXED WARNING 及修訂「特殊警語」部分。
來自耶魯大學研究針對腎因性全身性纖維化提出建議:一、臨床醫師應審慎評估末期腎衰竭病人接受 MRI 或 MRA 檢查,須施打含釓顯影劑之必要性;若有使用需要,建議以最低劑量施打。二、對中末期腎衰竭病人進行 MRI 或 MRA 檢查,醫師應告知病人,在施打含釓顯影劑檢查後,可能會產生 NSF,此疾病會導致失能及潛在致死風險。三、接受檢查者,若已接受規律的洗腎,儘快於注射後3小時內安排洗腎,24小時內進行第二次洗腎。
NSF 尚有許多未知而有待解決的問題,需要進一步探究,且致病機轉仍不明確。部分研究中發現有些病人產生 NSF,但病人並未接觸含釓顯影劑。是否有其他危險因子參與?及其所扮演的角色都需要更深入研究。因此目前需要使用更靈敏的檢測方法,來偵測皮膚檢體中是否含有極低量的釓元素,以釐清 NSF 和含釓顯影劑之間的相關性。藉由全世界的相關研究,增進我們對 NSF 疾病的瞭解,在未來希望能更進一步的研究及了解,以根除及治療此疾病。
參考資料:
1. Cowper SE: Nephrogenic systemic fibrosis: the nosological and conceptual evolution of nephrogenic fibrosing dermopathy. Am J Kidney Dis 2005; 46: 763-5.
2. Grobner T: Gadolinium-a specific trigger for the development of nephrogenic fibrosing dermopathy and nephrogenic systemic fibrosis? Nephrol Dial Transplant 2006; 21: 1104-8.
3. Galan A, Cowper SE, Bucala R: Nephrogenic systemic fibrosis (nephrogenic fibrosing dermopathy). Curr Opin Rheumatol 2006; 18: 614-7.
4. van der Molen AJ: Nephrogenic systemic fibrosis and the role of gadolinium contrast media. J Med Imaging Radiat Oncol 2008; 52: 339-350.
5. Perazella MA: Current status of gadolinium toxicity in patients with kidney disease. Clin J Am Soc Nephrol 2009; 4: 461-9.
6. Broome DR: Nephrogenic systemic fibrosis associated with gadolinium based contrast agents: a summary of the medical literature reporting. Eur J Radiol 2008; 66: 230-4.
7. Steger-Hartmann T, Raschke M, Riefke B, et al: The involvement of pro-inflammatory cytokines in nephrogenic systemic fibrosis-a mechanistic hypothesis based on preclinical results from a rat model treated with gadodiamide. Exp Toxicol Pathol 2009; 61: 537-52.
8. Saab G, Abu-Alfa A: Nephrogenic systemic fibrosis-implications for nephrologists. Eur J Radiol 2008; 66: 208-12.
Nephrogenic Systemic Fibrosis and GdBCA
Wei-Li Chen1, Pi-Yu Shih Lee2
Department of Pharmacy, Taipei City Hospital1
Department of Pharmacy, Taipei City Hospital, Zhongxing Branch2
Abstract
Nephrogenic systemic fibrosis is a rare but severe disease that manifests as fibrosis of skin and viscera. GdBCA (gadolinium-based contrast agents) of low stability are likely to undergo transmetallation and release free Gd ions that may deposit in tissues and attract circulating fibrocytes to initiate the process of fibrosis. FDA guideline recommends checking for renal impairment. Patients with advanced acute or chronic kidney disease (CKD), liver transplantation or candidates avoid all GdBCA. Other GdBCA should only be used after careful consideration of risks versus benefits.

