摘要
Denosumab 為一具全新作用機轉用來治療停經後婦女具骨折高風險性之骨質疏鬆症的藥品,亦為一種人類單株抗體製劑,會與 RANKL (Receptor Activator of Nuclear Factor Kappa B Ligand) 結合,抑制 RANKL 和破骨細胞的結合,避免骨質的流失,因而增加骨骼骨質密度。Denosumab 有明顯降低停經後婦女之骨折風險的療效,包括新脊椎骨折、髖骨骨折及非脊椎骨折發生率,其為每6個月皮下注射60 mg,方便使用,亦可以改善病人的順從性。
關鍵字: denosumab、RANKL (receptor activator of nuclear factor kappa B ligand)、骨質疏鬆症、osteoporosis
壹、前言
骨質疏鬆症是一種無聲無息進行中的疾病,其會造成骨質密度減少、骨組織微結構變差和骨骼強度減低。其原因為骨質重建 (bone remodeling) 處於負平衡,包括骨質再吸收 (bone resorption) 增加及骨質生成作用 (bone formation) 減少1。治療骨質疏鬆症是藉由改變骨質重建的平衡,進而增加骨質密度。治療骨質疏鬆症的藥品分成兩大類,一類是抑制骨質再吸收的藥品,藉由抑制蝕骨細胞的吸收作用,減緩骨質流失速度,此類藥品包括雙磷酸鹽類 (bisphosphonate)、雌激素 (estrogen)、選擇性雌激素受體調節劑 (selective estrogen receptor modulator, SERM)、抑鈣激素 (calcitonin)、鍶化合物 (strontium ranelate) 等。另一類是增加骨質生成作用,刺激造骨細胞作用,加速骨質生成,如副甲狀腺素 (parathyroid hormone)、鍶化合物等。而於2011年8月衛生署核准全新機轉的 denosumab 用來治療停經後婦女具骨折高風險性之骨質疏鬆症,可提供骨質疏鬆症病人一項新選擇。以下介紹 denosumab 的使用與注意事項。
貳、作用機轉
人體的骨骼終生都在不斷地進行除舊換新的動作,其主要是利用破骨細胞 (osteoclast) 進行骨質再吸收,以及造骨細胞 (osteoblast) 進行骨質生成,正常人此兩種細胞作用的速度相近。若是骨質再吸收速度超過骨質生成速度,將導致骨質流失而造成骨質疏鬆。
Denosumab 的作用方式不同於其他抑制骨質再吸收的治療骨質疏鬆症藥品。Denosumab 是一種人類 IgG2 單株抗體製劑,會與 RANKL 結合,為 RANKL 抑制劑。RANKL 是一種蛋白質,由造骨細胞生成,促使破骨細胞先驅物 (osteoclast precursor) 成熟,形成破骨細胞,然後破骨細胞作用在骨骼,溶出骨骼內的鈣質,造成骨質的流失。Denosumab 可針對 RANKL 產生作用,抑制 RANKL 和破骨細胞的結合,抑制破骨細胞活化,避免骨質的流失,因而增加骨質密度,使骨折風險降低 (圖一)2,3。
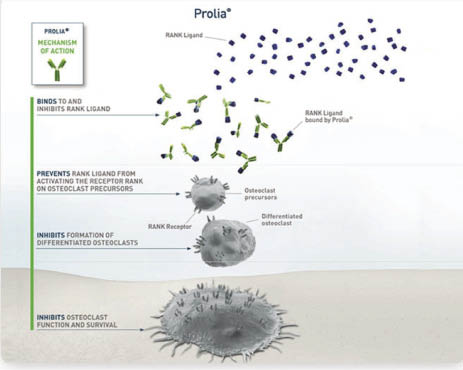
圖一 Denosumab 作用機轉3
參、臨床療效與安全性
一項隨機分派、雙盲、安慰劑對照組的 FREEDOM (Fracture Reduction Evaluation of Denosumab in Osteoporosis Every 6 Months) 研究,共納入7,808位60-90歲停經後婦女,且 T-score 介於-2.0至-4.0之間,比較每6個月皮下注射 denosumab 60 mg 與安慰劑之臨床療效與安全性,持續追蹤36個月。結果顯示,使用安慰劑治療36個月後的婦女新脊椎骨折、髖骨骨折發生率分別為7.2%、1.2%,而使用 denosumab 治療的發生率為2.3%、0.7%,所以使用 denosumab 治療的新脊椎骨折、髖骨骨折發生率相對風險分別顯著減少68% (p<0.001) 及 40% (p=0.04)。此外使用 denosumab 治療也可明顯地降低非脊椎骨折的風險20% (p=0.01)(安慰劑8.0% vs. denosumab 6.5%),且相對性地增加腰椎 (lumbar spine) 骨質密度9.2%和全髖骨 (total hip) 6.0%,和骨代謝指標 (如 type I collagen C-telopeptide, CTX 及 procollagen type 1 N-terminal propeptide, P1NP) 減少,所以使用 denosumab 治療,有明顯降低停經後婦女之骨折風險的療效 (圖二)。其會出現低血鈣症、引起感染等不良反應發生率與安慰劑組相似1。
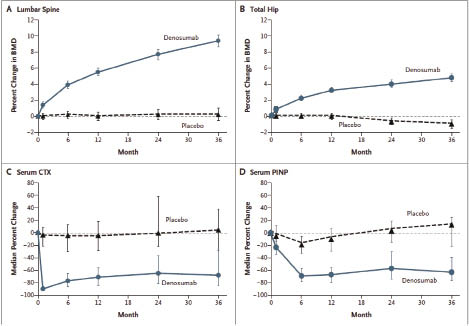
圖二 骨質密度和骨代謝指標的百分比變化3
在2011年 Camilla von Keyserlingk 等人發表一篇「Denosumab 用於治療低骨質密度及骨質疏鬆症的停經後婦女之臨床療效與安全性」系統性文獻回顧的統合分析 (meta-analysis),搜尋 Medline、EMBASE 和 Cochrane Central Register of Controlled Trials (CENTRAL) 等資料庫,共納入4個臨床試驗進行統合分析,包括8,864位病人。結果發現使用 denosumab 相較於安慰劑治療,降低42%發生骨折的風險 (95% CI 0.52-0.66),denosumab 明顯降低停經後婦女之骨折風險。至於安全性方面,使用 denosumab 與安慰劑治療相比,包括發生嚴重不良反應的風險比為1.33 (0.83-2.14)、發生與感染有關之嚴重不良事件的風險比為2.10 (0.64-6.90)、發生腫瘤的風險比為1.11 (0.91-1.36)、因不良事件而退出試驗的風險比為1.10 (0.83-1.47) 及發生死亡的風險比為0.78 (0.57-1.06),皆未有顯著差異4。
另有與 alendronate 直接比較療效之第3期隨機分派、雙盲、多中心的 DECIDE (Determining Efficacy: Comparison of Initiating Denosumab versus Alendronate) 研究,收納1,189位 T-score ≤-2.0低骨質密度的停經後婦女,比較每6個月皮下注射 denosumab 60 mg (n=597) 與每週口服一次 alendronate 70 mg (n=595) 之臨床療效與安全性,持續追蹤12個月。結果顯示,治療12個月後,denosumab 較 alendronate 在5處骨頭皆可顯著增加骨質密度,分別在全髖骨 (3.5% vs. 2.6%; p<0.0001)、轉子 (trochanter) (4.5% vs. 3.4%; p<0.0001)、橈骨末梢 (one-third radius) (1.1% vs. 0.6%; p=0.0001)、股骨頸部 (femoral neck) (2.4% vs. 1.8%; p=0.0001)、腰椎 (5.3% vs. 4.2%; p<0.0001)。且 denosumab 與 alendronate 相較,可顯著降低骨代謝指標 (CTX 及 P1NP)。副作用方面,兩者並無明顯差異 (80.9% denosumab vs. 82.3% alendronate; p=0.6)5。
肆、使用方式
Denosumab 建議劑量為每6個月皮下注射一次,每次60 mg,施打於上臂、大腿或腹部等部位。對腎功能受損的病人,不需調整劑量。至於嚴重腎功能受損 (ClCr < 30 mL/min) 或正接受透析治療病人,則應審慎評估風險與效益。如有忘記施打時,應盡快補施打,之後再從最後一次注射的日期算起,排定每6個月一次的注射時間。一般儲存於2-8℃,施打前,自冰箱取出達到室溫後,即可進行施打。若儲存於室溫25℃,必須14天內使用,超過14天即需丟棄6。
針對使用 denosumab 治療需多久時間,目前尚無一致性結論,不過已有持續治療6年之研究報告,發現可持續降低骨骼流失和增加骨密度,至於副作用方面並無新發現。在2011年9月廠商於美國骨骼與礦物質學會 (American Society for Bone and Mineral Research, ASBMR) 發表,持續觀察上述研究達8年時,發現腰椎和全髖骨骨質密度分別增加了16.8%和6.9%,可持續增加骨密度,且副作用與先前之研究並無差異。假使中斷治療12個月後,腰椎和全髖骨骨質密度分別減少了6.6%和5.3%,骨代謝指標同時增加;倘若再次恢復開始治療,則腰椎骨質密度會顯著增加9%,骨代謝指標也隨之降低7-9。
伍、警語及副作用
Denosumab 禁用於低血鈣病人,因低血鈣症可能會因使用 denosumab 而惡化,所以應適量補充鈣質和維生素D,且使用時須定期追蹤血鈣濃度。如有副甲狀腺功能低下病史、曾接受甲狀腺/副甲狀腺手術、營養吸收障礙症候群、已切除小腸、嚴重腎功能不佳或正接受透析治療等皆有產生低血鈣之可能。
施打 denosumab 最常見的副作用為背痛 (34.7%)、四肢疼痛 (11.7%)、肌肉骨骼疼痛 (7.6%)、高膽固醇血症 (7.2%) 及泌尿膀胱感染 (5.9%)。嚴重副作用包括低血鈣症、嚴重皮膚與其他感染、皮膚炎、皮疹和濕疹等皮膚狀況及抑制骨代謝作用,亦可能會增加顎骨壞死 (osteonecrosis of the jaw, ONJ)、非典型骨折及延遲骨折癒合等風險6,10。
陸、安全性疑慮
對於 denosumab 有一些使用上的安全性疑慮,包括可能發生顎骨壞死風險、增加癌症的風險與嚴重感染的風險。曾有每個月使用120 mg denosumab 治療的病人發生顎骨壞死,因此懷疑可能與 denosumab 的給藥頻率及累積劑量有關,所以對於使用 denosumab 治療的各種研究設計,修改為給藥頻率3個月以上,且6個月的累積劑量不得超過210 mg,以減少發生顎骨壞死的機會11。在開始治療前,應由處方醫師進行常規口腔檢查。對於有發生顎骨壞死危險因子,包括侵入性牙科處置 (拔牙、植牙、口腔手術)、患有癌症、進行化療、使用類固醇治療、口腔衛生不良等之病人,在開始治療前,應進行牙科檢查。疑似發生顎骨壞死現象時,應接受牙醫師或口腔外科醫師的照護6。
使用 denosumab 增加癌症的風險疑慮,是因在尋找適當劑量之研究時 (Trial 223),有3位受試者每6個月接受100 mg 高劑量 denosumab 發生癌症造成死亡12。不過在 FREEDOM 的大型研究,受試者每6個月接受60 mg denosumab 治療,在整體癌症發生率上,denosumab 組與安慰劑組之間並無差異 (3.7% vs. 3.2%, p=0.28)。
FREEDOM 的研究中,發現非致命性嚴重感染發生率,以 denosumab 組4.1%較安慰劑組3.4%為高,雖無明顯差異 (p=0.14),但因曾有使用 denosumab 治療,出現嚴重皮膚感染以及腹部、尿道及耳朵感染而住院治療的報告,且發生蜂窩性組織炎,以 denosumab 組0.3%明顯高於安慰劑組< 0.1% (p=0.002)。疑似可能和 denosumab 是 RANKL 抑制劑有關,因 RANKL 會表現於活化的T與B淋巴球上及淋巴結中,導致增加嚴重感染的風險。併用免疫抑制劑或免疫系統受損的病人發生嚴重感染的風險可能會提高,所以醫師在處方前,宜審慎評估風險與效益1,6。
柒、結論
對患有骨質疏鬆症之停經後婦女,denosumab 可降低脊椎、非脊椎和髖骨骨折的發生率。使用方式為每6個月皮下注射給予,1年只需注射2次且方便使用,可以改善病人治療的順從性,同時亦為提供不適用口服雙磷酸鹽及腎功能不佳的病人之另一種新選擇。
參考資料:
1. Steven R. Cummings, Javier San Martin, Michael R. McClung, et al: Denosumab for Prevention of Fractures in Postmenopausal Women with Osteoporosis. N Engl J Med 2009; 361:756-765.
2. Paul D. Miller: Denosumab: Anti-RANKL antibody. Current Osteoporosis Reports. 2009; 718-22.
3. Prolia® (denosumab), Amgen. Available at http://www.proliahcp.com/mechanism-of-action/.
4. Von Keyserlingk C, Hopkins R, Anastasilakis A, et al: Clinical efficacy and safety of denosumab in postmenopausal women with low bone mineral density and osteoporosis: a meta-analysis. Semin Arthritis Rheum. 2011 Oct; 41(2): 178-86.
5. Brown JP, Prince RL, Deal C, et al:Comparison of the effect of denosumab and alendronate on BMD and biochemical markers of bone turnover in postmenopausal women with low bone mass: a randomized, blinded, phase 3 trial. J Bone Miner Res. 2009 Jan; 24(1): 153-61.
6. Prolia® (denosumab) prescribing information, Amgen.
7. Miller PD, Bolognese MA, Lewiecki EM, et al: Effect of denosumab on bone density and turnover in postmenopausal women with low bone mass after long-term continued, discontinued, and restarting of therapy: a randomized blinded phase 2 clinical trial. Bone. 2008 Aug; 43(2): 222-9.
8. Miller PD, Bolognese MA, Lewiecki EM, et al: Six-Year Safety and Efficacy Data from Denosumab Phase 2 Extension Study. Journal of Clinical Densitometry. 2010; 13: 131-132.
9. McClung M. Concurrent oral session 11. Abstract #1061. Safety of denosumab reported out to 8 years in extension study. Presented at: the American Society for Bone and Mineral Research 2011 Annual Meeting; Sept. 16-20, 2011; San Diego.
10. Denosumab: Drug information.Available at MICROMRDEX 2012.
11. A. Kyrgidis and K. A. Toulis: Denosumab-related osteonecrosis of the jaws. Osteoporos Int (2011) 22:369–370.
12. Adrienne Rothstein: Denosumab Safety FDA Analysis. Available at http://www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/Drugs/
ReproductiveHealthDrugsAdvisoryCommittee/UCM179782.pdf.
Denosumab - A New Therapy for Osteoporosis
Shih Ya-Fen, Liao Shu-Chen, Tsai Yu-Chuan, Chien Su-Yu
Department of Pharmacy, Changhua Christian Hospital
Abstract
Denosumab is a new option for the treatment of postmenopausal osteoporosis in women with high fracture risk. Denosumab is a fully human monoclonal antibody to the receptor activator of nuclear factor kappa B Ligand that blocks its binding to RANK, inhibiting the development and activity of osteoclasts, decreasing bone resorption, and increasing bone density. This agent lowered risk for spine, hip, and nonvertebral fractures. The recommended dose is 60 mg every 6 months as a subcutaneous, thus improving patient adherence.

