摘要
世界各地的醫療機構皆不斷地參與新藥研發工作,而在美國藥師已於臨床試驗藥品的管理上扮演著重要角色。本文以俄亥俄州立大學醫學中心為例,從研究人員的組成、藥品優良臨床試驗規範、臨床試驗計劃書審核與試驗開始前的準備,及臨床試驗計劃的執行幾方面,介紹美國醫院藥局所提供的研究用藥服務,以期台灣藥師能對臨床試驗具備基本概念,進而建構符合自己醫院需求的研究用藥服務。
關鍵字: Investigational Drug Service、Good Clinical Practice、Institution Review Boards
壹、前言
在現代社會中,人們的疾病之所以能獲得有效管理,生活品質得以提升,有很大部份須歸功於新藥的研發及生產,使得在醫療上有更多有效、安全的藥品可以使用。全世界各大醫藥研究機構亦無不持續地發展許多有潛力的藥物。從新藥研發的進程看來1,於醫院進行臨床試驗的藥品,可能是首次在動物實驗後用在人體上,安全性絕對是最重要的考量,而對受試者的保護亦是研究團隊中各醫療專業人員共同的責任。藥師具備藥物相關的背景和知識基礎,積極參與新藥臨床試驗自然責無旁貸。在美國,各大醫學中心的藥事部門大都提供研究用藥服務 (Investigational Drug Service; IDS),協助藥品臨床試驗的執行及推展,且 IDS 已成為重要的藥學專科。ASHP (American Society of Health-System Pharmacists) 亦認為醫院藥師應在已上市藥品或試驗藥品的臨床研究中扮演重要的角色,並有責任積極參與藥物相關的研究工作,使藥物治療能透過這些科學性的研究不斷進步2,3。ASHP 更在其網站中建置了 IDS 資源中心4,提供研究用藥服務相關的作業指引及教育訓練資料,足見此藥學專科受重視的程度。
以下以俄亥俄州立大學醫學中心為例,從研究人員的組成、藥品優良臨床試驗規範 (Good Clinical Practice; GCP)、臨床試驗計劃書審核與試驗開始前的準備,及臨床試驗計劃的執行幾方面,介紹美國醫院藥局所提供的研究用藥服務。
貳、研究人員的組成
成功的臨床試驗有賴於各方資源有效的整合及分配,其中最根本的是適當的研究人員組成,無論研究計劃大小皆然,且各成員須清楚了解其工作內容,以使計劃能照時程有效執行。通常研究團隊包括了計劃主持人、協同主持人、研究護理人員、資料處理員、研究助理、藥師及住院醫師。此外,俄亥俄州立大學醫學中心亦設置臨床試驗部門 (Clinical Trial Office) 處理相關行政及法規事宜。
藥師對臨床藥物研究的參與主要分為兩類,其一為與藥品儲存、調劑流程及試驗藥品記錄保存相關的工作;其二為在研究團隊中擔任研究計劃主持人、協同主持人及在研究倫理審查委員會 (Institution Review Boards; IRB) 的工作。俄亥俄州立大學醫學中心的 IDS 藥師則肩負了試驗藥品調劑流程管理、電腦系統試驗藥品資料建置和 IRB 的工作,並有配有1:1的技術員協助。此外,IDS 藥師亦須與各臨床試驗相關領域的專科藥師充份合作,以期做好藥品管理和研究計劃書審查的工作。
參、藥品優良臨床試驗規範
美國聯邦政府針對已上市或試驗藥品訂定完善的法律或規範,以使藥品的品質、安全性及有效性可以獲得確保。其食品藥物管理局 (Food and Drug Administration; FDA) 所訂定與藥品臨床試驗相關的法規主要與受試者保護、IRB 和新藥臨床試驗申請 (Investigational New Drug Application; IND) 等議題相關。FDA 亦出版了藥品優良臨床試驗作業指引5,提供藥品臨床試驗在研究設計、執行、記錄及發表過程的統一化標準。透過此作業指引得以使研究人員更清楚及遵從相關的法規規範,並由各醫療機構訂定適合的院內政策及作業程序。
經由 GCP 可達到資料保密、合乎法規、受試者保護及 FDA 核准等目的,其基本精神與原則含蓋了赫爾辛基宣言、風險利益指數、受試者保護、試驗藥品資訊、科學性的計劃書、IRB 核准、計劃主持人及研究團隊的資格認定、知情同意、臨床試驗資訊、保密協定、試驗藥品 GMP 認證及品質管控等方面,這些也是 IDS 藥師在參與臨床試驗時必須具備的概念。
肆、 臨床試驗計劃書審核與試驗開始前的準備
為確保臨床試驗執行的可行性、有效性與安全性,做好計劃書的審查工作及試驗開始前的準備是必要的。俄亥俄州立大學醫學中心主要透過試驗可行性審查委員會 (Feasibility Review Committee; FRC),臨床科學性審查委員會 (Clinical Scientific Review Committee; CSRC),研究倫理審查委員會等機制進行計劃書審查,其中 FRC 和 CSRC 主要由試驗相關領域的專科藥師參與,IDS 藥師綜整審核意見,IRB 則由 IDS 藥師參與。通常在進到 IRB 審查的同時,計劃資助機構即會到院召開訪視會議 (Site Initiation Visit; SIV),試驗即將開始前則召開試驗執行會議 (Implementation Meeting; IM),以確認試驗流程及各研究團隊成員的準備工作皆已完善。
一、可行性審查委員會
主要針對研究計劃的可行性審核。例如,試驗藥品取得、合併治療藥品之保險給付、是否為非核准適應症、調劑設備空間是否滿足需求、教育訓練的需求,及其他可能窒礙難行的流程。
二、臨床科學性審查委員會
就研究設計本身及學理上進行審核。與藥物相關的重點包括了藥物使用合理性、給藥順序、藥物劑量調整、忘記給藥的處理、是否符合院內用藥指引等,亦即藥師必須運用本身具備的藥品知識對計劃所提到或該提到的藥物資訊提供意見。
三、研究倫理審查委員會
IRB 委員皆需接受 CITI (Collaborative Institutional Training Initiative) 受試者保護相關的網路訓練課程,取得時數認證並定期更新之。IRB 的審查重點在藥品本身的安全性及試驗相關資訊是否能透過受試者同意書清楚地、準確地讓受試者了解,此亦為 FDA 最基本的要求。
受試者同意書必須提供的資訊及重點包括;試驗參與是自願性、參與試驗並不一定能改善病情、為何進行此研究、將有多少人參與、參與試驗後的治療流程、試驗期、是否可於試驗進行中退出、可能的風險及副作用、參與試驗對病情可能帶來的助益、如不參加試驗有無其他治療選擇、試驗相關資訊是否保密、試驗費用、試驗補貼、參與試驗後享有的權利、諮詢管道等。上述內容必須隨著計劃書內容同步訂定或修改,始終維持一致性。
四、SIV
主要針對試驗實際執行的細節做討論,確認各相關單位對試驗流程是否能配合。例如,有些基因治療藥物可能會用到病毒做為載體,就必須考量其是否有複製能力、是否會感染人類細胞,來決定生物安全性等級 (Biosafety Level; BSL),使用適當的作業要求和工作環境 (圖一)6。IDS 藥師亦須於這時確認試驗藥品如何取得及補充、藥局資料夾的內容是否完備、調劑相關記錄表是否符合需求、藥物相關流程面設計是否允當等,以使後續試驗能順利執行。
五、IM
目的在對試驗開始前的各項準備工作做最後確認。對試驗藥局來說,最重要的是試驗藥品是否已經取得、相關調劑流程是否已建置完成。通常如果在 SIV 所提出的問題在 IM 召開前皆已解決,則該臨床試驗在 IM 後便很快可以開始執行。
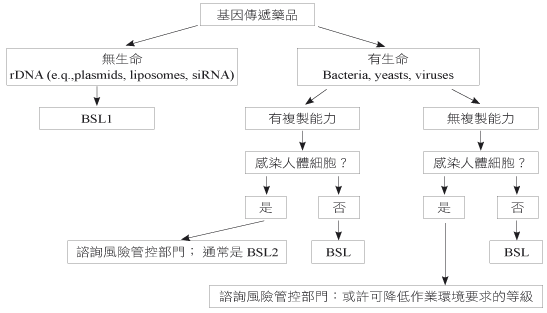
圖一 基因治療藥物生物安全性等級建議決策樹6
伍、臨床試驗計劃的執行
臨床試驗開始後與 IDS 直接相關的工作包括了試驗藥品調劑與管理、試驗監測 (monitoring) 與稽核 (auditing) 及試驗藥品資料表更新等工作。臨床試驗病人的處方審核及臨床藥事服務則由相關專科藥師和 CTU (Clinical Trial Unit) 藥師負責。
一、試驗藥品調劑與管理
俄亥俄州立大學醫學中心每年執行約300件臨床試驗計劃,就試驗藥品調劑與管理來說,只要是隨機雙盲試驗、調劑程序複雜或多中心給藥的臨床試驗,皆由 IDS 藥師和技術員負責調劑工作。技術員調劑備藥後,才由 IDS 藥師覆核藥品、標籤後裝袋;屬需再調製藥品且調劑程序複雜度高者,則由技術員於生物櫃中備齊藥品、稀釋液後,於 IDS 藥師或化療藥師監督下進行調劑加藥,並包裝、貼標。其他藥品管理工作尚包括了藥品儲存、訂藥、分配、存量管制、回收或銷毀,主要皆由技術員負責大部份的工作。另由於其臨床試驗管理是以總院的 IDS 為中心,各癌症研究中心亦有藥師協同執行,因此 IDS 尚須備有總試驗藥品存量管制表管理,定期至衛星單位對帳、查核,並作為試驗監測與稽核對口的唯一單位。
二、試驗監測與稽核
試驗監測主要是檢視臨床試驗執行過程是否遵照計劃書的內容、GCP 及相關標準作業程序,並清楚記錄之;就藥局而言,主要是針對藥品儲存情形、存量、調劑及相關記錄表實施查核。試驗稽核則是通盤對臨床試驗的相關活動、文件進行查核,除試驗監測的內容外,尚可能包括了病歷記載、詳細的給藥程序及合併的用藥等,其頻率較不若試驗監測那麼高。
三、試驗藥品資料表更新
俄亥俄州立大學醫學中心具備完善的電腦資訊系統作輔助,使得藥師和技術員都能透過此系統確實掌握試驗進度,彼此合作,並與其他團隊人員建立良好的溝通管道。IDS 藥師必須協助建立適當的線上作業流程及試驗藥品資料表,提供其他藥師及專業人員參考,並持續更新之。例如,NCI (National Cancer Institute) 會定期收整所屬試驗藥品的不良反應事件 (adverse events; AE) 或嚴重不良反應事件 (severe adverse events; SAE),提供給相關試驗計劃主持人及醫療機構。計劃主持人必須據此更新計劃書和受試者同意書的內容;IDS 藥師則須更新試驗藥品資料表的內容。
陸、結論
對成功的藥品臨床試驗而言,可行性、有效性與安全性的確保三者缺一不可。而藥師具備藥物本身相關的背景與知識,自然必須積極參與相關的審核與執行工作,協助此目的達成。雖然國內正進行臨床試驗的醫院已有臨床試驗委員會和研究倫理委員會的設置,但藥師在其中實際參與的程度各醫院不盡相同,且多數臨床試驗藥師必須負擔不少時間在藥品調劑和管理上。反觀美國的醫院,多配置有1比1的技術員人力協助大部份的藥品調劑及管理工作。整個臨床試驗的流程從計劃書的審查、試驗流程的設計到試驗的執行,區分較多的環節做檢視,分工較細,且臨床試驗藥師在各環節都有參與,著墨亦較深,甚至有些醫院已開始發展臨床試驗病人的藥事照顧。本篇文章介紹美國的研究用藥服務即是希望能提供臨床試驗的基本概念並引導藥師可介入的作為,以期大家對 IDS 專科能有所了解,甚而於各醫院持續建立或精進適合自己的研究用藥服務,充份展現藥師在臨床試驗中所扮演的角色。
參考資料:
1. WM. KK, Susan H: Oncology clinical trial- Successful design, conduct, and analysis. 2010.
2. American Society of Hospital Pharmacist. ASHP guidelines for pharmaceutical research in organized healthcare settings. Am J Hosp Pharm. 1989; 46: 129-30.
3. American Society of Hospital Pharmacist. ASHP guidelines for the use of investigational drugs in organized healthcare settings. Am J Hosp Pharm. 1991; 48: 315-9.
4. ASHP 官網 IDS 資源中心: http://www.ashp.org/IDS.
5. Food and Drug Administration, Department of Health and Human Services. International conference on harmonisation; good clinical practice consolidated guideline. Fed Regist. 1997; 62: 25692-709.
6. Sharon LE, Debra LH. Perceived versus real risks of handling gene therapy agents in the pharmacy environments. Am J Hosp Pharm. 2010; 67: 838-48.
The Investigational Drug Service in American Hospital Pharmacy
Huang Chi-Wei, Wang Shiao-Ping, Ching Ya-Hui, Chen Jye-Daa
Department of Pharmacy Practice, Tri-Service General Hospital
Abstract
Research to develop new agents is occurring in health system practice settings throughout the world. Pharmacists have played a pivotal role in the management of drugs used in the conduct of clinical research in United States. Taking Ohio State University Medical Center as an example, we introduce the investigational drug service settings in United States through several aspects, such as components of study personnel, Good Clinical Practice, review of clinical trial protocol and preparations before trial opened, and implementation of clinical trial. We hope that pharmacists in Taiwan could get general concepts about clinical trials and further develop a structure with procedures specific to its own needs and organization.

