摘要
藥物性肝傷害 (drug-induced liver injury, DILI) 為許多國家發生急性肝傷害之主要原因,也因其為嚴重之藥物不良反應,成為近年來美國食品藥物管理局進行藥品之回收或撤市原因排名第一位。常見引發 DILI 之藥品包含 acetaminophen 及抗結核菌藥 (anti-tuberculosis treatment, ATT) 等。故本文將就台灣藥害救濟案例資料庫內,疑似藥物引起肝傷害之相關案例進行分析,探討此藥物不良反應發生型態,及與各可能危險因子之相關性,提供臨床醫療人員於處方藥物及監測並預防此不良反應發生之本土性資料。
關鍵字: drug-induced liver injury、antituberculosis、hepatitis B、adverse drug reactions、drug injury relief
壹、前言
在美國,每年約有2000件急性肝衰竭案例發生,肇因除病毒性肝炎外,其次即為藥物引起的肝臟傷害 (drug-induced liver injury, DILI)1,以歐洲等地病人為對象之研究指出,急性肝衰竭的發生率約為每年每百萬人口之1至6人2,然而目前 DILI 發生率的大規模流行病學研究數據仍不多。藥物之肝毒性也往往是導致藥品退出市場的重要原因,並已成為近年來美國食品藥物管理局進行藥品之回收或撤市原因排名第一位 (佔27.9%);此外,更因此項嚴重不良反應對其他多項藥品採取修正仿單等各項風險管控措施3。常見引發 DILI 之藥品包含 acetaminophen 及抗結核菌 (anti-tuberculosis treatment, ATT) 等2,與 ATT 有關的肝毒性不良反應在台灣及其他亞洲地區更顯嚴重,有文獻指出在亞洲單一地區統計的發生率約為10%4。
回顧1999年至2013年6月之藥害救濟審議案例統計結果顯示,RIF、INH、PZA 累計為藥害救濟給付案件疑似藥品排名第三位5;此外,其他如抗黴菌類藥、抗癲癇類藥亦是引起藥物性肝炎之常見疑似藥品。故本文將就台灣藥害救濟案例資料庫內,疑似藥物引起肝傷害之相關案例進行分析,探討此藥物不良反應發生型態,及與各可能危險因子之相關性,提供臨床醫療人員於處方藥物及監測並預防此不良反應發生之本土性資料。
貳、資料分析
本文彙整財團法人藥害救濟基金會自1999年至2013年6月間所有申請藥害救濟案件,並經衛生福利部 (原行政院衛生署) 藥害救濟審議委員會審定完成,包含個案基本資料、病歷記載之處方藥品名稱、劑量、疾病診斷名稱、以及案件審議結果等。其中「處方藥物地區」係依衛福部中央健康保險署各分局所轄縣市區域分類;「藥品所致之藥物不良反應種類 (名稱)」以及「疑似導致藥害藥品品項」係依藥害救濟審議委員會就各案件之審定結果為準,並依 MedDRA (Medical Dictionary for Regulatory Activities) 以及 ATC (Anatomical Therapeutic Chemical Classification System) 編碼系統進行分類案例分別以 Microsoft Excel 匯集資料並以 PASW 16.0版統計軟體進行統計分析。
參、結果
一、基本資料描述
自1999年1月至2013年6月底止,藥害救濟審議委員會共完成1,918例藥害救濟申請案之審議。所有案例之藥害型態如以藥物不良反應器官分類代碼 (System Organ Classes, SOC) 分類,屬於藥物導致肝膽疾患 (hepato-biliary disorder) 不良反應相關者共計有148件 (佔7.7%);男性有90例 (60.8%)、女性有58例 (39.2%),平均年齡為54歲 (範圍2-86),相關資料如表一所示。此外,疑似導致藥害藥品屬抗結核菌類 (ATT) 有64件次 (39%),佔最多數、其次依序為抗黴菌類有23件次 (14%)以及抗癲癇類計15件次 (9%),詳細藥物類別統計如圖一所示。
表一 疑似藥物引起肝傷害之申請個案基本資料
基本資料 (案件數=148件) |
案件數(%) |
|
性別 |
|
|
|
男性 |
90 (60.8%) |
|
女性 |
58 (39.2%) |
年齡 (歲) |
|
|
|
< 10 |
3 (2.0%) |
|
10-19 |
4 (2.7%) |
|
20-29 |
5 (3.4%) |
|
30-39 |
15 (10.1%) |
|
40-49 |
27 (18.2%) |
|
50-59 |
37 (25.0%) |
|
60-69 |
28 (18.9%) |
|
70-79 |
20 (13.5%) |
|
> 80 |
9 (6.1%) |
平均年齡 (歲) |
54 ± 17 (2-86)# |
|
申請類別 |
|
|
|
死亡 |
69(46.6%) |
|
障礙 |
6(4.1%) |
|
嚴重疾病 |
73(49.3%) |
#平均值標準差(範圍)
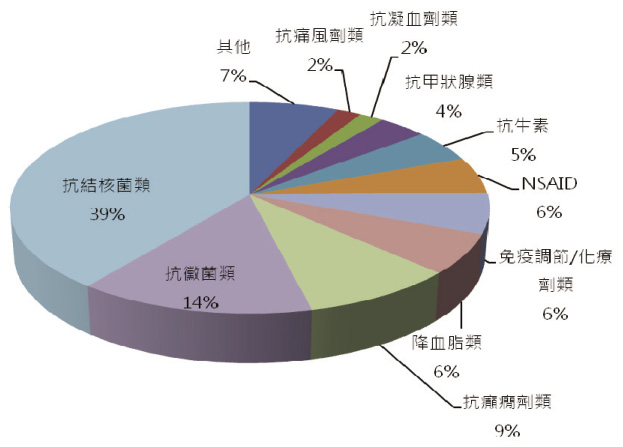
圖一 疑似引起藥物性肝傷害之藥物類別
二、 各藥物類別之常見藥品以及疾病分類統計
另如將各藥物類別中,相同藥物品項發生次數大於2次以上者列表,可見在 ATT 類中仍以一般熟知之第一線抗結核藥為主,包含 isoniazid、rifampin、pyrazinamide、ethambutol 等;抗黴菌類藥中則以 terbinafine、ketoconazole 較為常見,其他類別暨其藥品品項整理於表二。另依各藥物類別與疾病分類 (MedDRA) 進行交叉統計,除免疫調節劑類及抗痛風類藥物外,其他類別藥物引起之肝炎診斷以急性肝炎或肝功能異常為最多,其中 ATT 藥品及抗凝血劑藥品之死亡案件比率均大於五成,分別為70.3%及66.7%,詳細資料如表三。
表二 常見疑似藥物統計
藥物類別 (次數) |
藥品品項* |
嚴重程度‡ (%) |
||
死亡 |
障礙 |
嚴重疾病 |
||
抗結核菌類 (64) |
isoniazid、rifampin、pyrazinamide、ethambutol |
70.3 |
3.1 |
26.6 |
抗黴菌類 (23) |
terbinafine、ketoconazole |
17.4 |
4.3 |
78.3 |
抗癲癇類 (15) |
phenytoin、valproate、phenobarbital |
46.7 |
6.6 |
46.7 |
降血脂類 (11) |
fluvastatin、fenofibrate |
10.0 |
- |
90.0 |
免疫調節/化療劑類 (10) |
methotrexate、adalimumab |
40.0 |
10.0 |
50.0 |
NSAID (9) |
mefenanic acid、diclofeanc |
37.5 |
12.5 |
50.0 |
抗生素 (8) |
co-trimoxazole、ciprofloxacin |
25.0 |
- |
75.0 |
抗甲狀腺類 (6) |
propylthiouracil、carbimazole |
- |
- |
100.0 |
抗凝血類 (3) |
clopidogrel |
66.7 |
- |
33.3 |
抗痛風類 (3) |
allopurinol |
33.3 |
33.3 |
33.3 |
其他 (11) |
amiodarone |
36.3 |
- |
63.7 |
*藥品品項僅列出發生次數 > 2次以上者
‡係依據申請類別區分為死亡、障礙及嚴重疾病
表三 藥物與 MedDRA 二類別交叉統計
藥物類別 |
MedDRA類別 (%) |
|
死亡率 (%) |
||||
Drug induced hepatitis |
Cholestatic hepatitis/jaundice |
Hepatic failure/fulminant hepatitis |
Acute hepatitis/hepatic function abnormal |
Chronic hepatitis active aggravated |
others |
||
抗結核菌類 |
6.2 |
4.7 |
35.9 |
46.9 |
1.6 |
4.7 |
70.3 |
抗黴菌類 |
8.7 |
8.7 |
21.7 |
60.9 |
- |
- |
17.4 |
抗癲癇類 |
6.7 |
- |
26.7 |
46.6 |
- |
20.0 |
46.7 |
降血脂類 |
10.0 |
- |
30.0 |
60.0 |
- |
- |
10.0 |
免疫調節/化療類 |
- |
- |
50.0 |
30.0 |
20.0 |
- |
40.0 |
NSAID |
- |
- |
37.5 |
50.0 |
- |
12.5 |
37.5 |
抗生素 |
25.0 |
25.0 |
12.5 |
37.5 |
- |
- |
25.0 |
抗甲狀腺類 |
- |
16.7 |
- |
83.3 |
- |
- |
- |
抗凝血類 |
33.3 |
- |
- |
66.7 |
- |
- |
66.7 |
抗痛風類 |
33.3 |
- |
33.3 |
33.3 |
- |
- |
33.3 |
其他 |
- |
10.0 |
20.0 |
40.0 |
10.0 |
20.0 |
36.3 |
肆、討論
一、藥物性肝傷害之嚴重程度
侷限於藥害救濟之申請限定藥物不良反應的嚴重程度一般至少需達住院或延長住院時間,故資料庫中僅以嚴重藥物不良反應為主,雖然缺乏全面性之藥物不良反應案例,但所有案件皆經過藥害救濟審議委員會評估討論且具完整醫療資料,仍可由其窺見具意義之訊息。與藥物相關之肝傷害為歷年藥害救濟給付案件之藥物不良反應器官分類第3位,僅次於嚴重皮膚組織疾患與免疫相關疾患5。而此類藥物性肝傷害案例中,年齡分布界於40至69歲間,且其中死亡案件占46.6%、嚴重疾病案件占49.3%,此類藥物不良反應之死亡率較平均案件數高6,值得注意。
二、與藥物性肝傷害有關之常見藥物類別
因台灣目前仍屬結核病之高風險地區7,故抗結核病藥物之使用率自然較歐美國家高,以傳統第一線 ATT 藥品 rifampin、isoniazid、pyrazinamide 及 ethambutol 合併治療結核菌感染,仍是目前最具療效及經濟效益之方式,也是台灣現行最新版結核病診治指引之建議8,然而在因此疾病治療時程之特殊原因下,長期且併用多種藥物也造成其為台灣地區常見導致藥害救濟之藥品排名第三5。此外,與台灣藥害救濟制度起緣息息相關之抗黴菌類藥品,亦為引起 DILI 之常見藥物類別。其他如抗癲癇類藥品、降血脂類藥品、免疫調節劑、NSAID 等,皆為與藥物性肝傷害有關之藥物類別。其中免疫調節劑或化療劑類別中,以 adalimumab 等 TNF-α blocker 類藥品較值得注意,此類藥品多非直接造成肝臟傷害,而常見於B型肝炎病毒帶原者,因使用此類藥品產生免疫抑制作用,進而造成病毒活化,間接引起肝傷害。
三、用藥前、後監測之重要性
(一)抗結核菌藥
依據台灣疾病管制署之結核病診治指引規範8,結核病人治療前及治療後的2、4、8週建議執行肝功能檢查,如以前項檢查為指標檢視本資料庫之相關案件,顯示有部分案件 (8.3%) 於用藥前未執行任何肝功能相關檢查,而多數案件則並未依該指標於治療後進行定期監測;此外,相關案件中亦發現仍有部分醫師處方抗結核菌藥品前,並未進行病毒性肝炎檢查。以各藥物類別區分,顯示此類藥物造成肝傷害之死亡率最高,達7成,可能與長期且併用多種藥物使用有關聯。另有多篇文獻指出影響 ATT 藥品肝毒性之可能危險因子包含年齡 (大於35)、性別為女性、慢性肝功能異常、曾受B型或C型肝炎感染者4,10,11。故仍建議處方 ATT 藥品前,應為病人進行肝功能及病毒性肝炎檢查,治療後亦應定期追蹤肝功能變化。
(二)抗黴菌類藥
雖此類藥物具肝毒性不良反應已廣為周知,且相關藥物仿單亦載有相關肝功能監測與注意事項,然綜觀資料庫中仍有少數案件於處方藥品前、後,未見安排相關肝功能檢查,甚或有案件為病人拒絕檢查,然仍處方藥品使用。另如以 MedDRA 分類,相關案件以急性肝炎與肝衰竭為最多,但死亡率 (17.4%) 較 ATT 類藥品為低。此外,本類藥品中之 ketoconazole 成分,即因其可能出現的嚴重肝傷害風險高於治療效益,於2013年7月經歐盟發布暫停市場販售,而美國 FDA 亦同步發布限縮使用之規定,表示其成份之口服劑型,不應作為任何黴菌感染之第一線用藥,故此類藥品之效益風險評估,仍需請處方人員審慎衡量。
(三)免疫調節劑/化療劑
如表二所示,化療劑中最常見之藥品成分為 methotrexate,臨床上可用於固體腫瘤、白血病、乾癬等適應症,惟其具有潛在之肝、毒性、骨髓抑制等嚴重不良反應,故衛福部於101年9月18日針對此藥物再度發佈函示,提醒注意如處方該藥品前,應先了解相關血液情形與肝、腎功能,處方後亦應定期監測;若有嚴重肝臟或腎臟功能不良時,則屬該藥品之使用禁忌,應特別留意。另有關 TNF-α blocker 類之免疫調節劑,因其藥理特性可能會使病人出現對細菌、真菌、病毒、原生動物及伺機性病原菌感染,亦包含有B型肝炎病毒再活化之可能。故建議醫師於處方前,應先瞭解病人是否具肝炎帶原情形,對於B型肝炎病毒再活化之高風險者 (HBsAg+或 HBsAg-/anti-HBc+),用藥期間及治療結束後數月,宜定期檢測肝生化值 (AST、ALT),並密切注意是否出現活動性肝炎之臨床症狀。此外,需注意的是,依據現行藥害救濟法之規定,非因藥物直接所致之嚴重不良反應,屬不符合藥害救濟之給付要件規定。
(四)其他
如抗癲癇類、降血脂類等藥品,相關仿單及臨床醫學文獻對於肝臟不良反應均有記載,處方時仍應注意監測肝功能;而抗生素類藥品中,以 co-trimoxazole 及 ciprofloxacin 二藥之發生機率較高,其中有四分之一個案之肝傷害類型屬膽汁鬱滯,雖發生機率較小,仍提醒注意。
預防勝於治療,是避免藥物不良反應發生之不二法門,而處方前、後的定期監測就是保障病人用藥安全與避免醫療爭議的重要方法。由藥害救濟申請案件累積之寶貴資料與經驗,顯示醫療人員應重視藥品相關安全資訊,並主動執行監測機制,同時亦告知病人可能的不良反應與其初期症狀,往往可減少藥害之發生或降低其嚴重程度,建立醫病雙贏之醫療環境。
Drug-Induced Liver Injury in Taiwan
— Drug Injury Relief Foundation Database
Lan-Hui Chih
Taiwan Drug Relief Foundation
Abstract
Drug-induced liver injury (DILI) is the major cause of acute liver injury in the US and many other countries. It is also the most common reason for withdrawing an approved drug in the US. The non-prescription acetaminophen overdose is the most common drug induced liver injury in the US in the and northern Europe, and the second one is anti-tuberculosis treatment (ATT) medications.
In the past decades, DILI has become the important adverse drug reactions (ADRs) attributed to the drug relief payment in Taiwan. We analyzed and reported the serious cases results from drug injury relief applications. This article may provide appropriate information and strategies to health care professionals about how to avoid further preventable miseries.
參考資料:
1. Navarro VJ, Senior JR: Drug-Related Hepatotoxicity. N Engl J Med 2006; 354: 731-9.
2. William B, Georg A, Anil D, et al: Acute liver failure. Lancet 2010; 376: 190–201.
3. Zhang W, Roederer MW, Chen WQ, et al: Pharmacogenetics of Drugs Withdrawn From the Market. Pharmacogenomics 2012; 13: 223-31.
4. Anand AC, Seth AK, Paul M, et al: Risk factors of hepatotoxicity during anti-tuberculosis treatment. Medical J Armed Forces India 2006; 62:45-49.
5. 財團法人藥害救濟基金會:歷年藥害救濟統計資料。http://www.tdrf.org.tw/ch/05knows/kno_07_main.asp?bull_id=5231
6. On WF, Chih LH, Liu C, et al: A unique drug-injury relief system in Taiwan: comparing drug-injury compensation in different countries. J harm Health Serv Res 2012, 3: 3-9.
7. 衛生福利部疾病管制署全球資訊網:結核病。2013。http://www.cdc.gov.tw/diseaseinfo.aspx?treeid=8d54c504e820735b&nowtreeid=dec84a2f0c6fac5b&tid=BAB48CF8772C3B05
8. 衛生福利部疾病管制署:台灣結核病診治指引第五版。衛生福利部疾病管制署, 2013。
9. Hwang SJ, Wu JC, Lee CN, et al: A prospective clinical study of isoniazid-rifampicin-pyrazinamide-induced liver injury in an area endemic for hepatitis B. J Gastroenterol Hepatol 1997; 12: 87-91.
10. Wong WM, Wu PC, Yuen MF, et al: Antituberculosis drug-related liver dysfunction in chronic hepatitis B infection. Hepatology 2000; 31: 201-6.
11. Lucena MI, Andrade RJ, Kaplowitz N, et al: Phenotypic characterization of idiosyncratic drug-induced liver injury: The influence of age and sex. Hepatology 2009; 49: 2001-9.

