摘要
依據衛生福利部公布國人2012年十大死因中,惡性腫瘤連續30年蟬連台灣十大死因之首位。醫學科技進步雖然提升病人的存活率,但疾病或治療過程中產生的不適症狀仍持續困擾患者,對生活品質產生極大影響,超過75%以上接受癌症治療的病人有疲憊症狀的問題,而此疲憊症狀難以多休息而改善。癌因性疲憊症屬國際疾病分類 (ICD-10) 定義之疾病,其發生機轉可能包括免疫失衡 (immune imbalance)、下視丘-腦垂體-腎上腺軸 (hypothalamic- pituitary-adrenal axis, HPA axis) 異常活化及貧血,其中又以免疫失衡問題可能是引起癌因性疲憊症之重要原因;根據美國國家癌症資訊網癌因性疲憊症指引提出,癌因性疲憊症是可以被治療改善的,其中緩解癌因性疲憊症的方式包括藥物 (如:止痛劑、抗憂鬱劑、貧血用藥或中草複方) 及非藥物治療 (如:運動、能量保存、營養及睡眠) 等方式幫助患者改善疲憊。然迄今以治療癌因性疲憊症為主適應症之藥物,目前全球只有經台灣 TFDA 核准的黃耆多醣注射劑,能增強雙向免疫調節作用,且改善患者疲憊症狀,進而提升癌症病人生活品質。
關鍵字: 黃耆多醣、疲憊、癌因性疲憊症、Astragalus polysaccharides、fatigue、cancer-related fatigue
壹、癌因性疲憊症與治療現況
癌因性疲憊症 (cancer-related fatigue, CRF) 依據美國國家癌症資訊網 (The National Comprehensive Cancer Network, NCCN) 指引的定義:為一種由癌症或癌症治療所引起持續性身體、情緒或認知感到疲累、精疲力竭的主觀感覺,並干擾日常生活功能,但其與日常活動多寡不成比例關係1。文獻指出,約有75-80%的癌症病人有疲憊症狀的問題,接受化學治療的病人約為59-96%,接受放射線治療的患者約為65-100%,而長期存活者也約達30%2。更有三分之二的病人認為疲勞症狀比疼痛更困擾他們的生活,以致於拒絕癌症治療,甚至厭世、輕生。過去臨床上常忽略癌因性疲憊症是一項癌症病人生活品質指標,隨著癌症病人存活期延長,對生活品質如癌因性疲憊症逐漸受到醫護人員、癌症患者及其照顧者的重視,世界衛生組織 (WHO) 在1998年將癌因性疲憊症歸屬為一種疾病,列在國際疾病與相關健康問題之分類第十版 (The International Statistical Classification of Diseases and Related Health Problems 10th Revision, ICD-10)3。癌因性疲憊症的病理機轉尚不清楚,目前存有多種假說,包括貧血 (anemia)、促發炎細胞激素 (pro-inflammatory cytokine)、下視丘-腦垂體-腎上腺軸[hypothalamic-pituitary-adrenal (HPA) axis]、血清素 (serotonin) 失調、迷走神經活化 (vagus nerve-afferent) 等調控機制4,其中促發炎細胞激素異常增加導致的免疫失衡 (immune imbalance),被認為是引起癌因性疲憊症的其中一項重要關鍵機轉。
臨床上,為有效管理癌因性疲憊症的問題,NCCN 建議出一套標準化的處置流程,提供臨床診斷、評估及治療建議,除必須考量患者對疲憊的主觀感受之外,建議應分析疾病和醫療歷史,以及可被治療的影響因子 (treatable contributing factor) 如貧血、疼痛、沮喪、營養不良、睡眠障礙、治療副作用及合併症等,以作為採取治療措施之依據。非藥物治療方法,建議可利用運動、能量保存及營養支持等;對於較嚴重的疲憊症,建議應使用藥物治療,並依據診斷分析評估結果使用藥品,包括類固醇、貧血用藥、神經刺激劑或抗憂鬱劑,但以上用藥皆多屬相關症狀處理或療效尚不明確,並為仿單標示外使用 (off-label use)1,因此癌因性疲憊症仍為臨床治療上迫切需要,但未被滿足的醫療需求 (unmet medical need)。近年來,台灣本土已自行研發並核准上市用於癌因性疲憊症的治療藥品-黃耆多醣注射劑 (Astraglus Polysaccharides Injection, APS Injection),以下將介紹黃耆多醣注射劑的成分及適應症介紹、藥理學和毒理學研究及藥物發展近況。
貳、黃耆多醣注射劑介紹
一、成分及適應症
黃耆多醣注射劑 (Astragalus Polysaccharides Injection, APS Injection) 係從傳統中藥上藥黃耆利用科學先進技術,經萃取分離以及純化的高度複雜技術精製而成之黃耆多醣 (polysaccharides of Astragalus membranaceus) 萃取物。本品為台灣食品藥物管理局核可限由醫師使用的西藥處方藥,用於治療癌因性疲憊症。黃耆多醣注射劑所含的黃耆多醣有效成分是由α-1,4 (1,6) 鍵結之葡聚醣 (glucan)、阿拉伯半乳多醣 (arabinogalactan)、鼠李半乳醣醛酸多醣 (rhamnogalacturonan) 及阿拉伯半乳多醣蛋白 (arabinogalactan protein, AGP) 所組成,平均分子量為2萬至6萬 dalton。其中 AGP 許多文獻已指出具免疫調節功能5。
二、藥理學研究
(一)藥理學研究
藥理學研究結果顯示黃耆多醣注射劑有效成分具有雙向免疫調節、促進骨髓造血、增強免疫功能、抗發炎、神經保護及抗氧化等作用 (表一)。目前已知過多促發炎細胞激素所造成的免疫失衡 (immune imbalance),為引起癌因性疲憊症的關鍵機轉之一,因此黃耆多醣注射劑推測可能透由其雙向免疫調節及抗發炎作用達到治療癌因性疲憊症之療效。
表一 黃耆多醣藥理研究結果說明列表
藥理作用 |
總結 |
In vivo 雙向免疫調節作用 |
第I型糖尿病小鼠模式 (Th1過度免疫異常疾病): 黃耆多醣注射劑有效成分能降低過高的 Th1免疫反應而恢復 Th1/Th2平衡,同時減低胰島炎 (insulitis),保護β細胞6。 |
燒傷後細菌感染的小鼠模式 (Th2過度免疫異常疾病): 黃耆多醣注射劑有效成分可通過對T調控細胞 (T regulatory cell) 的調節,進一步促成 Th1/Th2的平衡,而能抑制膿毒症 (誘發敗血症),明顯延長動物存活,並且可觀察到給予黃耆多醣注射劑亦可調節 IL-10 的產生,而這些調節是透過 Toll-like receptor 4 (TLR4)7。 |
|
In vitro & In vivo 刺激骨髓造血功能
|
黃耆多醣注射劑有效成分可調節人類周邊血液單核細胞: (peripheral blood mononuclear cell, PBMC) 分泌多種造血相關之細胞激素,包括:IL-1, IL-6, TNF-α, INF-γ, GM-CSF及 G-CSF8。 |
利用不同濃度之黃耆多醣注射劑有效成分單獨或與 IL-3 共同培養正常小鼠非黏附性骨髓細胞證實,黃耆多醣注射劑有效成分可促進骨髓巨核細胞 (megakaryocytes) 活化及成熟。 |
|
黃耆多醣注射劑有效成分促進小鼠基質細胞 (stromal cell)、嗜中性白血球、骨髓巨核細胞的增殖和成熟。 |
|
對接受5-氟尿嘧啶 (5-FU) 或絲裂黴素C (MMC) 化療或X光高劑量輻射的小鼠,黃耆多醣注射劑有效成分可促進其骨髓及脾臟前驅細胞的增殖與成熟,並促進其周邊血液白血球、紅血球和血小板的回升,有效降低毒性物質所造成的副作用。 |
|
In vitro & In vivo 增強免疫功能 |
將 C57/black 小鼠接種 S180腫瘤細胞並給予不同濃度黃耆多醣注射劑有效成分處理14天,分離其脾臟細胞進行檢測,顯示黃耆多醣注射劑有效成分可提升脾臟自然殺手細胞 (NK cell) 活性及 IL-2 產生。 |
黃耆多醣注射劑有效成分可刺激 BALB/c 小鼠脾臟細胞增生。 |
|
小鼠經半致死劑量輻射產生免疫低下反應,給予黃耆多醣注射劑有效成分處理後,經巨細胞病毒感染,發現小鼠可免除死亡,延長存活期。 |
|
In vitro 抗發炎作用 |
黃耆多醣注射劑有效成分在 THP-1細胞可抑制 LPS 誘導的誘導的 TNF-和 IL-1β9。 |
In vivo 神經保護作用 |
黃耆多醣注射劑有效成分於腦出血大鼠動物模式結果顯示,黃耆多醣注射劑有效成分可能通過抑制 NF-κB65及補體 C9 在腦出血血腫周圍的表現,達到保護腦組織效果10。 |
In vitro 抗氧化作用 |
黃耆多醣注射劑有效成分在 EA.hy926 細胞研究結果顯示,具有抗氧化作用,降低脂質過氧化,並抑制 NF-κB p65活化及 IL-8 和細胞間黏著分子 (intercellular adhesion molecule, ICAM) 表現11。 |
(二)毒理學研究
在大鼠急性毒理試驗結果顯示,黃耆多醣注射劑有效成分未觀察到毒性的最高劑量 (No Observed Adverse Effect Level, NOAEL) 為1,500毫克/公斤/天 (相當於人體使用劑量30倍之使用劑量)。犬90天重複劑量毒性試驗結果顯示,黃耆多醣注射劑有效成分未觀察到毒性的 NOAEL 為600毫克/公斤/天 (相當於人體使用劑量36倍之使用劑量)。在基因毒性試驗,以 Salmonella typhimurim TA97,TA98,TA100,TA102,TA1535菌株基因突變試驗結果顯示,黃耆多醣注射劑有效成分以5,000公克/plate 培養下,無毒性反應。中國倉鼠卵巢細胞染色體異常分析結果顯示,在5 毫克/毫升黃耆多醣注射劑培養下,無毒性反應。小鼠紅血球細胞之微核測試結果顯示,給予2,000毫克/公斤黃耆多醣注射劑有效成分,無毒性反應。由以上說明黃耆多醣注射劑臨床使用劑量是安全的。
(三)藥品與藥品交互作用
依據目前研究報告顯示,黃耆多醣注射劑並不會影響與其他藥品之交互作用。藥物進入人體後大多經由肝臟代謝酵素細胞色素450 (cytochrome P450, CYP450) 系統代謝處理。CYP 450有許多亞型如 CYP1A2、CYP2A6、CYP2B6、CYP2D6、CYP2E1、CYP2C9、CYP2C19、CYP3A4,參與大部分藥物代謝途徑。經人類肝微粒體 (liver microsome) 及表現重組酵素體外試驗結果顯示,黃耆多醣注射劑並不會抑制人類肝微粒體 (liver microsome) CYP1A2、CYP 3A4、CYP2C9、CYP2C19 及 CYP2D6酵素活性。且經人類及小鼠體外肝細胞 CYP3A4誘導試驗顯示,黃耆多醣注射劑亦不會誘導 CYP3A4活性。
三、治療癌因性疲憊症的臨床試驗
黃耆多醣注射劑治療晚期癌症病人癌因性疲憊症之隨機、雙盲及安慰劑對照三期樞紐臨床試驗,於馬偕紀念醫院安寧緩和教育示範中心選擇正接受安寧緩和照護之晚期癌症病人執行。本試驗每位病人治療八週,前四週採取隨機、雙盲及安慰劑對照設計,治療組進行黃耆多醣注射劑治療,控制組進行安慰劑治療,隨後四週治療因恩慈考量,兩組病人都使用黃耆多醣注射劑治療。臨床試驗結果顯示,使用黃耆多醣注射劑治療,每週三次,每次一劑 (500 mg),有六成左右病人有顯著疲憊症改善效果,效果可持續維持八週 (圖一中治療組)。控制組前四週病人先給予安慰劑治療,在後四週接受治療黃耆多醣注射劑治療,有將近七成病人有顯著疲憊症改善效果,相較於原先接受安慰劑治療僅四成,具顯著統計意義 (P = 0.02) (圖一中控制組)12。另外,比較於黃耆多醣注射劑及安慰劑治療四週後的疲憊症改善效果,以意圖治療 (ITT) 群體黃耆多醣注射劑治療組改善疲勞症狀的人數百分比為56%,安慰劑治療組僅38%,兩組差異達18% (95%信賴區間範圍-4%~44%);以計畫書 (PP) 群體分析,黃耆多醣注射劑治療改善疲憊症狀的人數百分比為60%,安慰劑治療組僅40%,兩組差異達20% (95%信賴區間範圍-4%~41%),進一步探討達中、重度疲憊症的病人,結果顯示兩組間改善疲憊症狀的人數百分比差異有29% (73% vs. 44%),並具統計差異 (P = 0.034)。
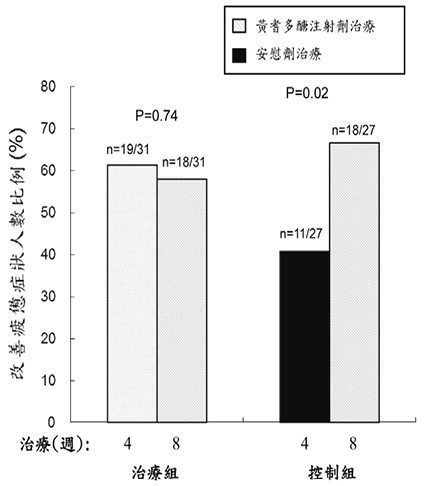
圖一 癌症病人治療四週及八週後之疲憊症狀評估
黃耆多醣注射劑在對於接受化學治療藥品 vinorelbine 及 cisplatin 治療的非小細胞肺癌136位病人的隨機對照臨床試驗顯示,比較於控制組每個化療週期合併使用黃耆多醣注射劑250 毫克連續7天,可顯著的緩解疲憊、噁心嘔吐、疼痛及改善食慾,並有提昇生理功能及整體生活品質的功效13。
目前臨床上,黃耆多醣注射劑相關之副作用並不常見,大多輕微且短暫,偶見瘙癢 (2.38%)、輕微皮疹 (5.95%) 及頭暈 (2.38%)。一般在注射後2-3小時即自然消除,經對症處理均可迅速獲得緩解。由以上結果顯示,黃耆多醣注射劑臨床使用安全性高,並可有效緩解癌因性疲憊症並改善癌症病人生活品質。
四、黃耆多醣注射劑未來發展
研究已知黃耆多醣具多種生物活性14,包括免疫調節、抗氧化、抗腫瘤、抗發炎、抗病毒、抗糖尿病、抗動脈粥狀硬化、促進造血功能、肝臟保護作用及神經保護作用等。國內所開發的黃耆多醣注射劑,使用上安全性高,依循藥品多樣化的功能,積極開發新適應症,以利擴大應用範圍及增加新藥價值,以下簡述兩項開發中之新適應症方向:
(一)原發性血小板缺乏性紫斑症
原發性血小板缺乏性紫斑 (idiopathic thrombocytopenic purpura, ITP) 為自體抗血小板抗體造成血小板破壞而導致之疾病,屬Th1輔助細胞過度免疫反應之免疫失衡疾病15。一般而言,臨床症狀輕微時有口腔黏膜出血、皮膚出現瘀斑的現象,但嚴重時則可能產生顱內出血等危及生命的併發症,常令病人本身或長期照護的家屬感到困擾。本病在兒童常為急性且短期的,僅需支持性療法。但在成人,本病大多為慢性,需要藥物治療或脾臟切除。目前市面上可供使用的藥品有限,且有用藥風險及療效不穩定之顧慮,仍有待更好的治療方式。藥理研究已證實黃耆多醣注射劑具有調節血小板生成及促進骨髓血小板前驅細胞的生成的作用,亦可調節免疫平衡,因此,黃耆多醣注射劑被開發用於治療原發性血小板缺乏性紫斑。黃耆多醣注射劑在治療原發性血小板缺乏性紫斑已完成美國 FDA 所核准的多中心第二期人體臨床試驗,結果顯示黃耆多醣注射劑對於傳統治療無效、血小板仍低下的慢性 ITP 病人,具有提升血小板及改善出血嚴重度的效果,特別是與 ITP 傳統治療例如使用類固醇或曾脾臟切除患者合併使用之效果更好,並將投入大型臨床試驗。
(二)腦中風
腦中風 (cerebral Vascular Accident, CVA) 高居國人十大死因第二位,僅次於癌症。且為成人殘障之主因及健保支出之大宗。臨床型態依成因不同分為出血性及缺血性中風。血栓溶解劑 rt-PA 被視為目前唯一且有效治療急性缺血性中風藥物,且3小時內施用能幫助急性缺血性中風病人造成重度殘障的機率將減少13%,超過治療窗期則腦出血機率大增。而對於腦出血後水腫目前尚無更好的治療藥物。黃耆治療中風已有久遠歷史,為治療腦中風方劑-補陽還五湯之第一位藥。鑒於黃耆能減少腦梗塞面積及抗氧化作用,具有治療中風的潛力。黃耆多醣注射劑於大鼠腦出血模型實驗中顯示10,可能通過抑制 NF-κB p65及補體 C9在腦出血血腫周圍的表現,達到保護腦組織效果,目前黃耆多醣注射劑正於國內十五家醫學中心執行第二期人體臨床試驗,評估其對於急性期缺血性中風預後之腦損傷改善效果。
(三)癌症免疫治療中的免疫調節劑
黃耆具有補氣固表、利水消腫和生肌等功效。它含有多醣、蛋白質、生物鹼、氨基酸、黃酮類、苷類、微量元素等多種生物活性物質,其中黃耆多醣的免疫活性特別突出。文獻指出,黃耆多醣作為生物免疫調節劑 (immune modulator),主要通過以下幾個途徑作用於人體的免疫系統:激活巨噬細胞,促進T細胞轉化,活化 Tc 細胞,提高B淋巴細胞和 NK 細胞的數量與活性;激活網狀內皮系統和補體系統;誘生多種免疫因子,如 IFN、IL-2和 TNF 等;影響神經內分泌-免疫系統網絡;促進細胞中的核糖核酸 (RNA)、脫氧核糖核酸 (DNA)、促進巨噬細胞合成一氧化氮,增強機體的免疫功能及蛋白合成和細胞內環核苷酸 (cGMP,cAMP) 的含量等5。此外,黃耆對正常小鼠抗體生成功能無影響作用,但對正常小鼠胸線具有顯著增重作用,能促進小鼠網狀內皮系統的吞噬能力,黃耆還可使 Con A 激發的T淋巴細胞增殖反應明顯增強。黃耆多醣有明顯的免疫增強作用,能增加實驗動物的脾臟重量,提高小鼠腹腔巨噬細胞的吞噬百分率,這可能是因為黃耆多醣促進巨噬細胞的生長,增強機體對免疫複合物的清除,所以小鼠在灌服黃耆多醣後,會促進其巨噬細胞生長,增加對免疫因子的吞噬,減輕對膜細胞的刺激,減少膜細胞的增生和基質的增多。另外 IL-1與巨噬細胞膜上的相應受體結合後,通過 Ras-MAPK 信號傳導途徑,誘導活化蛋白-1(AP-1),NF-kB 和 NF-IL6轉錄因子等,活化多種免疫分子的啟動子,從而促進其基因表達,它是急性反應的主要介質之一,黃耆多醣可顯著提高巨噬細胞吞噬能力的作用14。黃耆多醣注射劑將具開發為癌症免疫治療中免疫調節劑之潛力。
參、總結
近年輔助和另類醫學 (complementary and alternative medicine, CAM) 觀念普遍興起及被重視,使得許多已開發國家民眾對於植物藥接受度日漸提高,並被認為具有解決現代醫學無法有效治癒疾病之潛力。全球對於植物藥研發及應用之趨勢日益增加,許多植物藥 (中草藥) 具長期人體使用經驗,以植物藥為材料,採科學化方式生產及控管其品質,達藥品等級,並用西方醫學嚴謹的科學方法驗證療效,蔚成國際新藥開發潮流。台灣自行研發的黃耆多醣注射劑,實屬此一成功案例,並已核准用於醫學上無藥可醫癌因性疲憊症的西醫處方用藥,其多樣化功能深具對其他迫切需要新治療用藥的疾病 (如中風及癌症免疫治療中的免疫調節劑) 及罕見疾病 (如原發性血小板低下症) 治療的發展潛力,希冀未來能擴大應用範圍,嘉惠更多病人。
New Trends in the Therapy of Cancer-Related Fatigue
Hsiao-Chien Cheng1, Chi-Tai Yeh2, Liang-Shun Wang3
PhytoHealth Corporation1
Department of Education and Research, Taipei Medical University
— Shuang Ho Hospital, Ministry of Health and Welfare2
Institute of Clinical Medicine, Taipei Medical University3
Abstract
The leading cause of death in Taiwan 2012 is malignant tumor, which has remained the top killer during the past three decades. Although the survival rate for cancer has steadily improved due to advancements in diagnostic medical technology, cancer patients still suffer from malaise along with disease progression and treatments; also make great impacts on quality of life. Over 75% of cancer patients with cancer treatment reported fatigue as a universal symptom which was not relieved by rest. Proposed criteria for cancer-related fatigue (CRF) have been adopted for inclusion in ICD-10-CM. The potential mechanisms underlying CRF include immune imbalance, HPA-axis disruption, and anemia. Alteration of immune homeostasis may be the important mechanism which contributes to CRF. According to National Comprehensive Cancer Network (NCCN) clinical practice guideline, the interventions for CRF include pharmaceutical interventions, such as analgesics, antidepressants, erythropoietin, and botanical medicine, and non-pharmaceutical interventions, such as exercise, energy conservation, nutrition consultation, and sleep therapy. Up to now, Astragalus Polysaccharides (APS) Injection, the TFDA-approved prescription drug, is the only drug labeled with the indication of CRF treatment. APS Injection has the efficacy to alleviate fatigue and improve quality of life among cancer patients via modulating bi-directional immune function.
參考資料:
1. NCCN Clinical Practice Guidelines in Oncology™: Cancer related fatigue. Ver 1, 2014.
2. Baker F, Denniston M, Smith T, West MM (2005) Adult cancer survivors: how are they faring. Cancer 104(Suppl 11):2565-2576.
3. Mitchell SA, Berger AM. Cancer-Related Fatigue: The Evidence Base for Assessment and Management. Cancer J 2006;12:374-87.
4. Wang XS.: Pathophysiology of cancer-related fatigue. Clin J Oncol Nurs. 2008; 12(5 Suppl):11-20
5. Yang B, Xiao B, Sun T: Antitumor and immunomodulatory activity of Astragalus membranaceus polysaccharides in H22 tumor-bearing mice. Int J Biol Macromol. 2013;62:287-90.
6. Li RJ, Qiu SD, Chen HX, et al: The Immunotherapeutic Effects of Astragalus Polysaccharide in Type 1 Diabetic Mice. Biol Pharm Bull. 2007;30(3):470-6.
7. Liu Q-y, Yao Y-m, Yu Y, Dong N, Sheng Z-y (2011) Astragalus Polysaccharides Attenuate Postburn Sepsis via Inhibiting Negative Immunoregulation of CD4+ CD25+ high T Cells. PLoS ONE 6(6): e19811.
8. Lou X, Zhang B, Song J, et al: Effect of Astragalus Polysaccharide in Stimulating the Secretion of Hematopoietic Growth Factors from Activated Human PBMC. Traditional Chinese Drug Research & Clinical Pharmacology 2003;14(5):310-12.
9. He X, Shu J, Xu L, et al: Inhibitory Effect of Astragalus Polysaccharides on Lipopolysaccharide- Induced TNF- and IL-1-Production in THP-1 Cells. Molecules 2012;17:3155-64.
10. Liu BR, Xiao J, Ding XS.: Expressions of complement 9 and nuclear factor kappa B65 in perihematomal tissue following intracerebral hemorrhage in rats and the interventional effect of astragalus polysaccharides. Chin J Cerebrovasc Dis 2007;4(1):26-31.
11. Huang WM, Liang YQ, Tang LJ, et al: Antioxidant and Anti-inflammatory Effects of Astragalus Polysaccharide on EA.hy926 cells. Experimental and Therapeutic Medicine 2013;6:199-203.
12. Chen HW, Lin IH, Chen YJ, et al: A novel infusible botanically-derived drug, PG2, for cancer-related fatigue: a phase II double-blind, randomized placebo-controlled study. Clin Invest Med. 2012;35(1):E1-11.
13. Guo Li, Bai Shu-Ping, Zhao Ling, et al: Astragalus polysaccharide injection integrated with vinorelbine and cisplatin for patients with advanced non-small cell lung cancer: effects on quality of life and survival. Medical Oncology 2012; 29(3)1656-62.
14. Jin M, Zhao K, Huang Q, Shang P: Structural features and biological activities of the polysaccharides from Astragalus membranaceus. Int J Biol Macromol. 2014 ;64:257-66.
15. Wang T, Zhao H, Ren H, et al: Type 1 and type 2 T-cell profiles in idiopathic thrombocytopenic purpura. Haematologica 2005;90:914-23

