摘要
抗甲氧苯青黴素金黃色葡萄球菌 (methicilin-resistant Staphylococcus aureus,MRSA) 是院內感染 (hospital acguired;HA) 肺炎最常見之菌種之一,但首選以 vancomycin 為主的糖肽類抗生素 (glycopeptides) 治療 MRSA 的高失敗率,常導致臨床治療的困難;因此,新一類抗生素 telavancin 核准對抗 HA-MRSA 肺炎的成效令人期待。根據臨床試驗結果,當 vancomycin MICs ≥ 1 µg/mL 時,成效有明顯差異87.1% (telavancin) vs. 74.3% (vancomycin);95% CI,0.5-23,p = 0.03,不過血清肌酐酸 (serum creatinine) 增加幅度大於50%或超過1.5 mg/dL 的比例高於 vancomycin (telavancin 16% vs. vancomycin 10%),但影響是可逆的,需密切監測腎功能的變化,尤其是腎功能不全 (CrCl ≤ 50 mL/min)。Telavancin 治療 HA-MRSA 肺炎整體效益並不亞於 vancomycin,但統計學上的差別並不明顯,未來仍需更進一步的隨機對照組試驗 (randomized controlled trial, RCT) 以釐清其治療 HA-MRSA 肺炎的臨床效益。
關鍵字: methicilin-resistant Staphylococcus aureus、hospital acquired pneumonia、lipoglycopeptides、院內感染肺炎
壹、前言
院內感染的類型中,院內感染肺炎 (hospital acquired pneumonia,HAP) 的盛行率是僅次於呼吸器相關肺炎 (ventilator-associated bacterial pneumonia,VABP),對於重症患者,常是導致醫療照護成本增加甚至死亡的重要原因1。其感染源以金黃色葡萄球菌 (S.aureus) 為主,尤其是抗甲氧苯青黴素金黃色葡萄球菌 (methicilin-resistant Staphylococcus aureus,MRSA)。目前全球的盛行率大約25-50%甚至更高2,依台灣疾病管制署感染監測系統 (Taiwan Nosocomial Infection Surveillance System;TNIS) 顯示,分析2009年醫學中心加護病房中院內肺炎的感染就有將近八成是 MRSA,可見抗藥性菌株的嚴重性。自1980年代中期以來,針對疑似 MRSA 引起的嚴重感染,經常選擇 vancomycin 作為經驗性療法,在過度依賴下,衍生出對 vancomycin 敏感性降低的抗藥性菌株包含 VISA、hVISA 以及 VRSA,以致於失敗率甚至高達40%3,因此急需開發新的抗生素。但後續新藥的發展並不如預期,從1962年至今,僅僅兩類新型對抗 GPC 的抗生素被研發成功包含 oxazolidinone (linezolid) 與 cyclic lipopeptide (daptomycin)。但針對 HAP,目前 FDA 僅核准 linezolid,而 daptomycin (Cubicin) -主要治療複雜性皮膚和軟組織的感染 (cSSSIs),由於肺部組織穿透性不佳,並不適合治療院內感染肺炎。直到2009年9月,新型合成物 telavancin (Vibativ)-lipoglycopeptids 類抗生素取得 FDA 核可治療 cSSSIs,並於2013年6月新增可治療因金黃色葡萄球菌引起院內與呼吸器相關的肺炎感染 (HABP/VABP),但限定當其他治療無效時。因此本篇就此議題探討治療的現況與新一類抗生素 — telavancin 的作用機轉、結構與以及比較 vancomycin 的效益,以提供臨床參考。
貳、治療現況
1980年代 MRSA 成為院內常見菌種以來,選擇 vancomycin 作為經驗治療已經超過30年,但近年來發現 MRSA 菌種分佈的 MIC 值不斷提高 (0.5 mg/L - > 2 mg/L),此現象稱為 MIC creep4,以致於 vancomycin 在標準劑量下無法達到有效殺菌濃度,儘管美國臨床與實驗室標準協會 (Clinical and Laboratory Standards Institute,CLSI) 於2006年將 MRSA 對 vancomycin 的敏感性判讀標準由4 mg/L 降為2 mg/L,但整體治癒率卻不見起色。除了 glycopeptides,目前包含北美與歐盟核准可以治療 MRSA 靜脈注射型抗生素包括 quinupristin-dalfopristin,linezolid,daptomycin 和 tigecycline。但針對肺炎的研究中5,quinupristin-dalfopristion 的效果似乎不太理想;而 daptomycin 的活性受到肺部界面活性劑 (pulmonary surfactant) 抑制,在支氣管與肺部薄壁組織的濃度相當低,顯示藥物穿透性不佳6,因此兩者臨床上未核准同時也不建議用於 MRSA 引起的肺炎,當病人合併有菌血症及肺炎時需考慮使用其他藥品。而 tigecycline (Tygacil) 是 glycylcycline 化合物,為廣效型抑菌性抗生素。儘管對肺泡的穿透力佳,但分布體積過大,臨床經驗常應用在多重抗藥性細菌引起的混合感染,如軟組織或是腹部感染等。Linezolid 是 oxazolidinone 類的抗生素;雖然在 in vitro 中,它對金黃色葡萄球菌是抑菌性的 (bacteriostatic),但對於嚴重的 MRSA 或是 vancomcyin 治療失敗的 hVISA 感染仍然保有敏感性7。美國胸腔與感染醫學會 (ATS/IDSA) 在2005年的準則中疑似或證實由 MRSA 引起的肺炎 (HAP、VAP、HCAP),可選擇 linezolide 作為治療首選或替代建議,並且在2011年 IDSA 再次重申 linezolid 的重要性,尤其在 MRSA 感染的治療上,其中包含肺炎。但近年來的研究對 MRSA 肺炎的療效似乎並不優於 vancomycin,根據2012年 Wunderink 等人針對 MRSA-NP 的所作的前瞻性、隨機雙盲、多中心的研究,雖然 linezolide 的治癒率顯著高於 vancomycin (57% vs.46%,P = 0.042),但終點試驗的臨床結果與微生物的清除率,在統計學上並不優於 vancomycin,而且60天的死亡率與副作用的發生與 vancomycin 相當8。更重要的是研究中 vancomycin 的劑量僅採用15 mg/kg/每12小時,並沒有選擇更高的劑量如15-20/kg/每8小時,因此仍需要更多的研究證實其對院內肺炎的臨床效果。故...期待新藥的成效。
一、Telavancin 的作用機轉與結構
Telavancin 藥物動力學屬於濃度-依賴型抗生素,具有雙重作用機制,能有效對抗革蘭氏陽性菌,包括對 vancomycin 或 daptomycin 敏感性下降的菌株-VISA、hVISA9。提高活性的原因在於結構中有類似 teicoplanin 親脂性的支鏈 lipophilic side chains 能崁入正在成長細胞壁的結合位置10。Telavancin 屬於脂糖肽類的殺菌型抗生素,化學結構為 lipoglycopeptides (圖一),在 vancosamine sugar nitrogen 原子上連接疏水性支鏈,經由修飾 vancomycin 的糖結構而自成一類。Telavancin 能有效地結合細菌細胞壁上的 D-Ala-D-Ala (dipeptide),可以抑制 transglycosylase 的活性防止細胞壁前驅物質 (precursors) 進行聚合 (polymerization) 與交聯 (cross-linking) 而阻礙肽聚糖 (peptidoglycan) 合成,同時可以結合到細胞膜的特定受體稱為 lipid II,它也是細胞壁的前驅物質的ㄧ種,除了破壞胜糖的合成,親脂性的支鏈也引發細胞的去極化而改變膜的電位,使得細胞屏障功能受損,相對於 vancomycin,lipid II 受體也是主要增加抗菌活性的原因11,並且在體外的研究也證實,telavancin 具有後抗生素效應 (post-antibiotic effect) 長達10小時12。
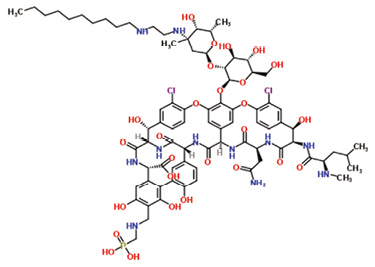
圖一 Telavancin的結構 (分子式C80H106C12N11O27P)
Telavancin 在正常腎功能狀態,半衰期大約是7-9小時,而且此藥有後抗生素效應,目前研究顯示每公斤10毫克一天一次的給藥模式,可以達到最佳殺菌作用。根據 FDA labeling information,telavancin 的代謝路徑尚未被證實,在體外的研究中,經由人類肝臟酵素作用並未發現其代謝產物,因此推論 telavancin 並不受到肝臟 p450酵素的影響與其他藥物的交互作用,76%由尿液原型排出,所以腎功能不全需調整劑量,建議 Scr 30-50 mL/mil,給與正常劑量的75%,而 ESRD 則建議每48小時投與10 mg/kg (表一)。
表一 依腎清除率劑量調整建議
Creatinine Clearance# (mL/min)* |
VIBATIV Dosage Regimen |
> 50 |
10 mg/kg every 24 hours |
30-50 |
7.5 mg/kg every 24 hours |
10-≤ 30 |
10 mg/kg every 48 hours |
*As calculated using the Cockcroft-Gault formula |
|
節錄自 FDA labeling information 2009
使用 telavancin 常見的副作用有味覺異常、噁心嘔吐與泡泡尿。而快速輸注可能引起紅人症候群 (red man syndrome) 包括:上半身的潮紅,蕁麻疹,皮膚瘙癢或皮疹等,建議輸注時間至少要大於60分鐘;另外使用 telavancin 治療期間可能發生腎毒性,尤其是腎功能不全 (CrCl ≤ 50 mL/min),需密切監測腎功能的變化;而使用 telavancin 可能延長 QTc 的間隔導致心律不整,應避免與相關藥物併用或者有合併潛在心律異常疾病包含非補償性心臟衰竭或嚴重左心室肥大等。
二、 Telavancin vs. Vancomycin 效益分析
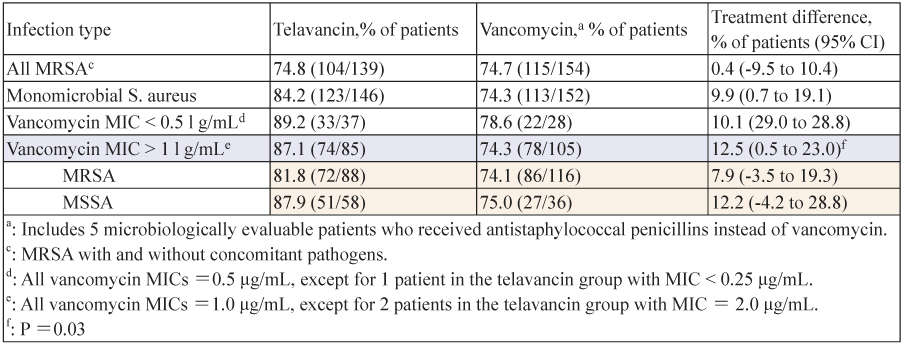
根據 ATTAIN 的臨床研究 (The Assessment of Telavancin for Treatment of Hospital Acquired Pneumonia)13,針對革蘭氏陽性菌引起的院內肺炎,選擇注射型 telavancin (10 mg/kg/q 24h) 和 vancomycin (1 g/q 12h) 治療7至21天,評估 telavancin 的療效與安全性。它由兩個相同的,隨機,雙盲,多中心,III 期臨床試驗分為0015與0019。實驗中共1503例患者被隨機分配到兩個治療組。其中以臨床療效區分為 CM 組 (n = 654) (clinically evaluable),telavancin (n = 312) 和 vancomycin (n = 342) 的治癒率分別為82.4%和80.7% (95% CI,-4.3-7.7%);由 CM 組中再以感染菌種 ME (microbiologically evaluable) 區分 (n = 480),兩組治癒率分別為79.0%和76.8% (95% CI,-4.3-7.7%),雖沒有明顯差異,但針對金黃色葡萄球菌引起的肺炎無論是 MSSA 或 MRSA,使用 telavancin 明顯優於 vancomycin (表二),尤其當 vancomycin MICs ≥ 1 µg/mL 時 (87.1 vs 74.3; 95% CI,0.5-23,p = 0.03);而死亡率,兩組研究 (0015與0019) 的比較結果是不一致的,不過血清肌酐酸 (serum creatinine) 增加幅度大於50%或超過1.5 mg/dL 的比例高於 vancomycin (16%:10%),但影響是可逆的,另外可能延長心率 (prolongation QT interval) 大於60毫秒,兩組的發生率是相當的 (8%:7%)。故 ATTAIN 的研究結果並未證實 telavancin 有較高的死亡率與顯著療效,但整體使用 telavancin 治療經由 GPC 引起的院內感染型肺炎並不劣 vancomycin。另外根據 Lodise 等人在2008年的研究,telavancin 對肺部組織有較佳的穿透性。由曲線下分佈體積分析在肺泡的薄壁組織與未結合型藥物的血漿濃度的比值,相對於 vancomycin 為0.73:0.39,有將近75%以上未結合型藥物進入肺泡,顯示其治療 pneumonia 優於 vancomycin14。
表二 依微生物鑑定 ME (microbiologically evaluable) 分析治療成效
三、優勢與限制
Telavancin 具有雙重殺菌機制,能破壞細胞壁的合成與干擾細胞膜的屏障;對肺部組織有優異的穿透性,能有效抗 Gram positive pneumonia infections 包含 vancomycin intermediate sensitive strains of S. aureus (VISA) and heterogenous VISA (hVISA)。由於不受 p450代謝影響,並未發現藥物交互作用。但可能的副作用包含腎功能不全與心律延長 (QTc prolongation) 以及干擾 PT, aPTT, and INR 的檢驗數值,須審慎評估 telavancin 的使用。
參、討論
Vancomycins 仍是目前主流上的選擇藥物。但是當 vancomycin 之 MIC 大於2 mcg/mL 之 MRSA 菌株,若使用 vancomycin 做常規治療有較高失敗率,即便培養報告顯示對 vamcomycin 仍具敏感性,MIC 大於1 mcg/mL 之菌株,成功率也僅9.5%15。因此 HA-MRSA 肺炎感染高 MIC 的菌株,尤其是 hVISA,或許應該選用其他新型的抗生素如 linezolid 或 telavancin,可避免治療失敗造成抗藥性的擴散。
肆、結論
近年來由於過度依賴抗生素治療細菌性感染,多重抗藥性菌株的風險 (multidrug-resistant bacteria) 已提升到危及的程度,甚至成為公共衛生關注的議題。因此面對常見的院內肺炎,新一代的 lipoglycopeptids-telavancin 將提供臨床對抗 MRSA 的新選擇,但我們仍必須謹慎且正確地使用這些新武器,包含即時有效的檢驗抗藥性,以避免篩選出更多頑強的菌株。
The Novel Antibiotic Aganist HA-MRSA Pneumonia
Chien-Wen Kang
Department of Pharmacy, Madou Sinlau Christian Hospital
Abstract
Staphylococcus aureus, particularly methicillin-resistant S. aureus (MRSA), is the most common pathogens of hospital-acquired pneumonia (HAP). But the rates of clinical failure in patients with HAP due to MRSA are high, especially in vancomycin. Therefore, the novel antibiotic of lipoglycopeptide - telavancin is exciting for treatment of HAP. According to results of clinical trials, when vancomycin MICs ≥ 1 μg/mL, telavancin was significantly inferior to vancomycin (87.1% vs 74.3%;95% CI ,0.5-23, p = 0.03) and also found the increases of serum creatinine levels were more common in the telavancin group (16% vs 10%). Hence, when using telavancin should be closely monitored, especially in renal insufficiency (CrCl ≤ 50 mL/min). In conclusion, telavancin is noninferior to vancomycin in the treatment of HAP, but no significant differences. We still need the further randomized controlled trials to clarify the benefit.
參考資料:
1. Kollef MH. Prevention of hospital-associated pneumonia and ventilator associated pneumonia. Crit Care Med 2004; 32:1396-1405.
2. Drago L, De Vecchi E, Nicola L, Gismondo MR. In vitro evaluation of antibiotics' combinations for empirical therapy of suspected methicillin resistant Staphylococcus aureus severe respiratory infections. BMC Infect Dis. 2007;7:111.
3. Moise PA, Forrest A, Bhavnani SM, Birmingham MC, Schentag JJ. Area under the inhibitory curve and a pneumonia scoring system for predicting outcomes of vancomycin therapy for respiratory infections by Staphylococcus aureus. Am J Health Syst Pharm 2000; 57:S4-9.
4. Steinkraus G, White R, Friedrich L. Vancomycin MIC creep in non-van¬comycin-intermediate Staphylococcus aureus (VISA), vancomycin-sus¬ceptible clinical methicillin-resistant S. aureus (MRSA) blood isolates from 2001–05. J Antimicrob Chemother. 2007;60(4):788–794.
5. Maclayton DO, Hall RG 2nd. Pharmacologic treatment options for nosocomial pneumonia involving methicillinresistant Staphylococcus aureus. Ann Pharmacother 2007; 41:235-44.
6. Oberholzer CM, Caserta MT. Antimicrobial update: Daptomycin. Pediatr Infect Dis J. 2005 Oct; 24 (10):919-20.
7. Huang YT, Hsiao CH, Liao CH, et al: Bacteremia and infective endocarditis caused by a nondaptomycin- susiceptible, vancomycinintermediate, and methicillin – resistant Staphylococcus aureus strain in Taiwan. J Clin Microbiol 2008;46:1132-6.
8. Wunderink RG, Niederman MS, Kollef MH, et al: Linezolid in methicillin-resistant Staphylococcus aureus nosocomial pneumonia: a randomized, controlled study. Clin Infect Dis. 2012;54(5): 621-629.
9. Lunde CS, Rexer CH, Hartouni SR, Axt S, Benton BM. Fluorescence microscopy demonstrates enhanced targeting of telavancin to the division septum of Staphylococcus aureus. Antimicrob Agents Chemother. 2010;54:2198-200.
10. Bambeke FV. Glycopeptides in clinical development: pharmacological profile and clinical perspectives. Curr Opin Pharmacol 2004;4:471-8.
11. Lunde CS, Hartouni SR, Janc JW, Mammen M, Humphrey PP, Benton BM. Telavancin disrupts the functional integrity of the bacterial membrane through targeted interaction with the cell wall precursor lipid II. Antimicrob Agents Chemother. 2009;53:3375-83.
12. Pankuch GA, Appelbaum PC. Postantibiotic effects of telavancin against 16 gram-positive organisms.Antimicrob Agents Chemother. 2009;53:1275-7.
13. Rubinstein E, Lalani T, Corey GR. Telavancin versus vancomycin for hospital-acquired pneumonia due to Gram-positive pathogens. Clin Infect Dis. 2011;52:31-40.
14. Lodise TP,Gotfried M,Barriere S,et al: Televancin penetration into human epithelial lining fluid determined by population pharmacokinetic modeling and Monte Carlo simulation.Antimicrob Agents Chemother.2008;52:2300-4.
15. Sakoulas, G, et al: Relationship of MIC and bactericidal activity to efficacy of vancomycin for treatment of methicillin - resistant Staphylococcus aureus bacteremia. J Clin Microbiol, 2004. 42(6): p. 2398-402.

