摘要
在目前慢性C型肝炎標準治療藥品組合:干擾素和瑞比達 (ribavirin;Rebetol) 使用後,能夠達到成功治癒的比例並不高,其中胰島素阻抗是治療失敗的一個很重要的因素,造成阻抗原因複雜包括:促發炎物質細胞激素 (cytokines)、腫瘤壞死因子 (tumor necrosis factor TNF)、間白質素 (interleukin-6;IL-6) 等;metformin 是 AMPK (AMP-activated protein kinase) 致效劑,是一個可以減少胰島素阻抗及增加胰島素敏感性的降血糖藥品,本文旨在回顧 metformin 應用於慢性C型肝炎所引起胰島素阻抗的機轉及提升C型肝炎治癒率並降低復發,同時減少肝硬化肝炎的發生。
關鍵字: metformin、慢性C型肝炎、胰島素阻抗、腺苷單磷酸活化蛋白激酶、AMPK
壹、前言
根據衛生署在2013年6月公布:2012年惡性腫瘤已經連續好幾年為十大死因之首,其中肝癌為十大癌症死因第2名,慢性肝病及肝硬化則列為國人十大死因第3名1。
2006年世界衛生組織 (WHO) 調查,估計全球約有一億七千萬人感染C型肝炎,每年有四百萬人感染C型肝炎,且人數仍在持續上升中,預估在2025-2030年會達到高峰,每年大約有五十萬人死於C型肝炎併發症2。
C型肝炎病毒可分為6種主要基因型 (1b,2a,3a,3h,4h,5a),在台灣主要以第一或第二型為主,根據高雄醫學院附設醫院副院長余明隆研究3,台灣C型肝炎盛行率平均達4.4%,預估C型肝炎患者有六十萬人,C型肝炎病毒急性感染後有55-85%的人會轉變成慢性感染。台大醫院劉俊人教授研究發現慢性C型肝炎病人約20%會發生肝硬化,而肝硬化的C肝患者每年約1-4%的機會產生肝細胞癌,4-5%機會發生肝功能代償失調4。
胰島素阻抗 (insulin resistance IR) 和很多疾病都有相關性,如心血管疾病、高血壓、肥胖、不孕、神經退化等,更是第二型糖尿病的重要致病原因。全球1億7千萬慢性C型肝炎患者中約有30-70%有胰島素阻抗5。而臨床上常用來評估C肝治療效果-持續病毒學反應 (sustained virological response, SVR) 註一,主要影響的因素就是胰島素阻抗,它也是C肝感染患者治療失敗的原因之一。
貳、案例簡介
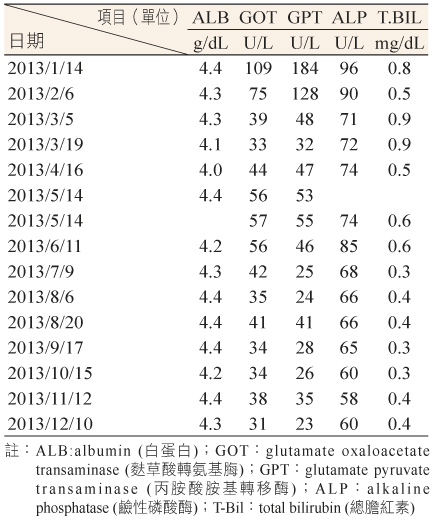
王女士63歲,102年元月因外院治療慢性C型肝炎失敗而轉介本院時,丙胺酸胺基轉移酶/麩胺酸草酸轉胺 (GPT/GOT) 值:184/109 U/L,總膽紅素 (T-Bil) 值:0.8 mg/dL,C型肝炎病毒抗體 (Anti-HCV ab) 值:15.38,C肝病毒 RNA (HCV RNA) 值:10.5百萬,基因型 IB,上腹部超音波檢查診斷為1.肝臟實質病變2.肝臟脂肪病變3.胰臟囊腫,C-胜肽 (C-peptide) 值:1.72 ng/mL,免疫反應胰島素 (immune reactive insulin;IRI) 值:7.98 μU/mL。102年1月23日王女士處方 Metformin 500 mg TID 直到2月20日加入 Ribavirin 1000 mg QD + Pegasys 180 mcg QW 開始3合1療法,4個星期後 RNA值:172,早期病毒學反應 (early virologic response;EVR) 為陽性 [EVR(+)],12週後快速病毒學反應 (rapid virologic response;RVR) 亦為陽性 [RVR(+)],12月份再抽血檢查時,GOT/GPT 值:31/23;T Bil值:0.4,C-peptide 值:3.08 ng/mL,IRI值:23.7 μU/mL。檢驗數據如表一, 結果顯示病人C肝有大幅改善。
表一 住院期間相關檢驗數據
參、慢性C型肝炎與胰島素阻抗機轉6-8
慢性C型肝炎與胰島素阻抗之間的關係目前尚未完全清楚,可能的假說包括:在C型肝炎病毒複製中,病毒的核心蛋白接觸到粒腺體外膜後,一方面開始複製莢膜,一方面促使細胞質內 (intracytoplasmic) 油滴 (lipid droplet) 產生,才能複製核心蛋白,油脂分泌愈多複製也愈有利,雙方面各自複製新的莢膜和核心蛋白後在內質網中結合成為新的病毒 (圖一)6。然而在複製的過程中產生過多的脂肪堆積,進而使脂肪細胞產生胰島素阻抗,也會造成血中游離脂肪酸增加而加重肝臟和肌肉組織的胰島素阻抗,誘發巨噬細胞活化並分泌大量促發炎物 (proinflammatory),例如:細胞激素 (cytokines)、腫瘤壞死因子 (tumor necrosis factor TNF)、間白質素 (interleukin-6;IL-6)…等,引發發炎反應和動脈粥狀硬化7,8。
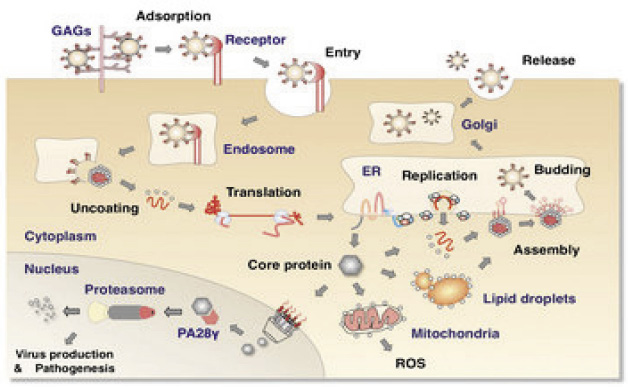
圖一 C型肝炎病毒複製中,需要油滴 (lipid droplet) 存在,才能順利完成複製6
一、胰島素受體受質9
在肝臟細胞、脂肪組織、骨骼肌上有胰島素受體,而胰島素受體受質 (insulin receptor substrate;IRS;IRS-1和3) 必須經過酪氨酸磷酸化 (tryrosine phosphorylation) 後才能使胰島素和類胰島素生長因子 (insulin-like growth factor) 發揮作用,而 IRS 的蛋白質訊息傳遞則是透過磷脂酰肌醇3激酶 (PI3 K)、磷酸化蛋白激酶B (AKT 亦稱 PKB) 等物質,當C型肝炎病毒感染時會降低 IRS 的磷酸化,因而降低胰島素接受體的作用及 PI3K 活性,而 PI3K 是身體血糖恆定的重要因子,它可控制身體內胰島素的代謝,包括葡萄糖、脂肪、蛋白質降低,不僅會降低胰島素活性,也會使體內葡萄糖、脂肪、蛋白質代謝失衡。
二、腫瘤壞死因子
腫瘤壞死因子 (tumor necrosis factor;TNF)10 所造成的胰島素阻抗,有各種不同的機轉,包括:抑制 IRS 的酪氨酸磷酸化會使胰島素受體受質 (IRS-1、IRS-2) 的作用下降、刺激脂肪分解 (lipolysis) 及降低葡萄糖轉換蛋白質4 (glucose transporter protein;GLUT-4) 使葡萄糖傳送受阻,也會降低甲型過氧化體增殖活化受體 (peroxisome proliferator activated receptorα;PPAR-α) 或直接對β細胞造成毒性,使胰島素訊息的傳遞受到傷害造成胰島素阻抗。
三、細胞激素傳訊的抑制因子
細胞激素的傳訊因子 (suppressor of cytokine signaling SOCS)11-13,例如:SOC-3、SOC-1,一旦被抑制,訊息轉換器及其轉入過程的活化皆會被阻礙,這些都是調節胰島素和干擾素活性的重要生化反應11,12。因此 SOCS-3、SOC-1的抑制會阻斷干擾素的抗病毒活性,使干擾素治療失敗,也會降低胰島素所促成的肝醣合成而造成胰島素阻抗13。
四、 過氧化體增殖活化受體
過氧化體增殖活化受體 (peroxisome proliferator-activated receptors PPARs)14 屬於-細胞核受體超家族,與脂質調節之脂肪生成和血糖控制相關的共有三種,包括 PPARα、PPARβ、PPARγ。其中 PPARα 主要負責與肝臟游離脂肪酸氧化相關的基因轉錄,PPARγ 主要是白色脂肪組織參與脂肪酸攝取和脂肪儲存的基因轉錄14。研究報告指出C型肝炎病毒核心蛋白所造成的脂肪堆積是因為粒腺體三酸甘油脂傳遞蛋白質的抑制和 PPARγ 的降低,而造成肝臟脂肪增加,更有利於C型肝炎病毒的複製。
C型肝炎病毒核心蛋白干擾胰島素所造成的阻抗會因為基因型不同而有不同的機轉,經由不同的基因型態、不同的中間傳訊物質,皆會造成胰島素抗性,並增加肝臟脂肪的堆積,而使C肝病毒的複製趨於更有利狀態,使干擾素治療受阻,因此治療胰島素抗性和治療C肝有同等的重要性。
肆、 Metformin 作用機轉
Metformin 是二甲雙胍類化合物 (biguanidine),二甲雙胍源自於中世紀歐洲的植物--法國紫丁香 (calega officinalis,french lilac),此草藥含有被稱為「胍」成分 (guanidine),有助於減輕糖尿病症狀。1922年 Emil Werner 和 James Bell 將胍分子變成二甲雙胍 (N,N/dimethylguanide),也是 metformin 第一次在文獻中被提到。1929年 Slotta 和 Tschesche 發現此成分可降低兔子的血糖,但之後就一直沒研究,直到1950年 Eusbio Y Garcia 用 metformin (當時稱 fluamine) 治療流行性感冒,當中也有提到降低血糖的作用,Garciac 並認為 metformin 有抑菌、抗病毒、抗瘧疾、止痛退燒等作用。1957年 Jean Sterne 命名為 Glucophage 正式用於糖尿病的治療。
美國 FDA (Food and Drug Administration) 在1994年核准此藥用於第二型糖尿病,之後由 Bristol Myers Sguibb 公司首先於1995年拿到執照。之後 metformin 就成為全世界處方最多的降血糖藥物之一。
在2001年 Zhou 等人發現 metformin 是肝臟和肌肉中的一種腺苷單磷酸活化蛋白激酶 (adenosoine monophosphate activated protein kinase;AMPK) 的作用劑,活化 AMPK 會抑制乙醯輔酶A羧化酶 (actylcoA carboxylase),此為脂肪分解的速率限制步驟,而其抑制脂肪分解的功能因此減少脂肪酸的生成並促進脂肪酸氧化,除此之外,活化 AMPK 會降低膽固醇調節元素結合蛋白 (sterol regulatory element binding protein;SREBP) 的表現,而 SREBP 會增加胰島素抗性而引發血脂異常,這也是糖尿病阻抗產生的原因之一。降低 SREBP 也可以降低三酸甘油脂的合成和肝臟脂肪的堆積,因此 metformin 經由 AMPK 的活化可以降低肝臟葡萄糖新生的速度,也會增加體內游離脂肪酸的氧化 (圖二) 15,在骨骼肌方面,則會增加 GLUT4由細胞內移至細胞膜表面,發揮運輸葡萄糖的功能增加骨骼肌對葡萄糖的汲取,使胰島素抗性改善。
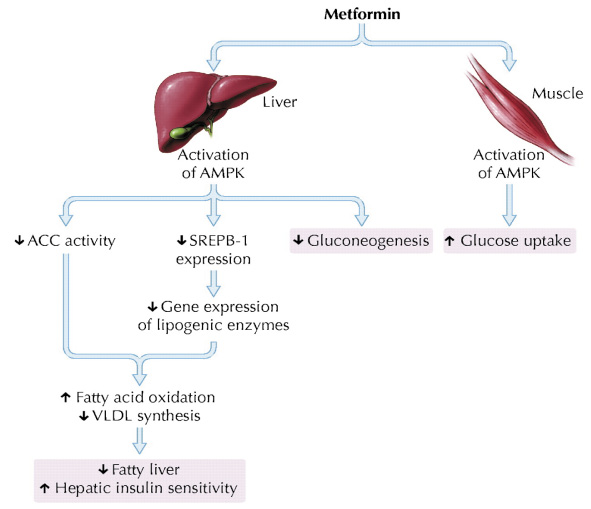
圖二 Metformin 經由活化 AMPK 來改善醣類和脂質的代謝15
2013年四月由台中榮總、中興大學、國家衛生研究院、陽明大學、台灣大學、中國醫藥大學、與義守大學的轉譯醫學研究團隊發表於 <GUT> 的文章中提到藉由分析全民健保資料庫,以近10萬名肝癌患者以及近20萬名對照組,綜合分析在12年間的糖尿病發生情形及糖尿病藥品使用狀況,發現若糖尿病病人每增加一年服用 Metformin 可以有效減少7%的肝癌發生。2008年西班牙一個隨機雙盲臨床試驗 TRIC-1(treatment of resistance to insulin in hepatitis c genotype) 則是把 metformin 加入標準治療中,結果對於女性感染第一基因型C型肝炎病毒和 HOMA > 2 (註2),顯示前12周病毒數量有大幅下降,而持續病毒血清反應增加至兩倍,研究顯示在24週內 metformin 可以改善50%以上胰島素抗性並使 HOMA < 使得對C型肝炎治療失敗病人的治療重現曙光,也對C型肝炎引起的胰島素抗性有更多的了解。
伍、結論
慢性C型肝炎有70%的人可能會發展成肝硬化和肝腫瘤,治療C型肝炎刻不容緩,長效型干擾素和 ribavirin 合併療法為治療第一和第四基因型之慢性C型肝炎的首選藥,但胰島素抗性會降低干擾素敏感度,阻斷它對細胞訊息的傳送,造成C型肝炎治療失敗的不可逆的結果12。Metformin 除了降低胰島素阻抗、減少肝臟脂肪堆積和促進干擾素作用外,價格便宜而且副作用少,若能增進C肝的治癒效果便可使C肝併發症及肝癌發生率大幅降低。未來對於胰島素阻抗的改善除了 metformin 外,其他的胰島素增敏劑藥品,如 pioglitazone,可以改善脂質的藥品,如 statin,也能以不同機轉輔助C型肝炎的治療,這部分仍待未來更多的研究證實。
註一:病毒持續性反應(sustained virologic response,SVR)
定義為停藥後24週在血清中未再驗出 HCV RNA 達成與否來判定。
註二:homeostasis model assessment (HOMA)
1985年由 Matthews 等人提出,利用休息狀態的空腹胰島素值及血糖值計算出胰島素抗性,公式為 HOMA-IR index= insulin (μU/mL) × glucose (mmol/L) /22.5,HOMA 的優點為容易取得空腹胰島素值及血糖值、公式簡單可用於大量流行病學研究、以及不需注射任何藥物,缺點為檢驗室檢測胰島素的精準性、壓力、或運動皆可能影響 HOMA 計算結果。
Role of Metformin in the Treatment of Chronic Hepatitis C
Tzu-Ting Huang, Pei-Chin Lin, Pi-Lai Tseng
Department of Pharmacy, Kaohsiung Veterans General Hospital
Abstract
After introducing the combination of interferon and ribavirin (Rebetol) for the treatment of chronic hepatitis C, the achievement of the eradication rate is not high, one of the important factors of treatment failure is insulin resistance, which might be due to complex mechanism, the factors involved in the mechanism are as following: pro-inflammatory cytokines substances (cytokines), tumor necrosis factor (TNF), Interleukin-6 (IL-6) etc; while metformin is an AMPK agonist. It is well known that it can reduce insulin resistance and increase insulin sensitivity of tissue. The goal what we want to achieve is how to apply metformin for treatment of insulin resistance in chronic hepatitis C patients. Consequently, it would be more cost-saving and fewer side effects to improve cure rate and decrease relapse rate.
參考資料:
1. http://www.mohw.gov.tw/cht/DOS/Statistic.aspx?f_list_no=312&fod_list_no=2747
2. World Health Organization. Hepatitis C. October 2000;1-3. Available from: http://www.who.int/mediacentre/factsheets/fs164/en/print.html. Accessed: February 27, 2006.
3. Yu ML,Chuang WL.Treatment of chronic hepatitis C in Asia: when East meets West. J Gastroenterol Hepatol 2009;24:336-45.
4. 劉俊人、許景盛、高嘉宏 慢性C型肝炎治療的新進展:從干擾素到直接抗病毒藥物 內科學誌2012;23:383-91。
5. Stephen A.Insulin resistance among patients with chronic hepatitis C: etiology and impact on treatment CLINICAL GASTROENTEROLOGY AND HEPATOLOGY 2008;6:864-76.
6. 松浦善治.Molecular mechanisms of HCV propagation and pathogenesis. Osaka University 2009.http://www-yoshi.biken.osaka-u.ac.jp/
7. Cancello R,Clement K.Is obesity an inflammatory illness? Role of low-grade inflammation and macrophage infiltration in human white adipose tissue. Br J Obstet Gynaecol 2006;113:1141-47.
8. Kahn SE,Hull RL,Utzschneider KM.Mechanisms linking obesity to insulin resistance and type 2 diabetes. Nature 2006; 444: 840-46.
9. Aytug S,Reich D,Sapiro LE, et al: Impaired IRS-1/PI3-kinase signaling in patients with HCV: a mechanism for increased prevalence of type 2 diabetes. Hepatology 2003;38:1384-92.
10. Paz K,Hemi R,LeRoith D, et al: A molecular basis for insulin resistance. Elevated serine/threonine phosphorylation of IRS-1 and IRS-2 inhibits their binding to the juxtamembrane region of the insulin receptor and impairs their ability to undergo insulin induced tyrosine phosphorylation.J Biol Chem 1997;272:29911-18.
11. Cooney RN.Suppressors of cytokine signaling (SOCS):inhibitors of the JAK/STAT pathway. Shock 2002;17:83-90.
12. Rico-Bautista E,Flores-Morales A,Fernandez-Perez L.Suppressor of cytokine signaling (SOCS) 2, a protein with multiple functions. Cytokine Growth Factor Rev 2006;17:431-439.
13. Song MM,Shuai K.The suppressor of cytokine signaling (SOCS) 1 and SOCS3 but not SOCS2 proteins inhibit interferon-mediated antiviral and antiproliferative activities. J Biol Chem 1998;273: 35056-62.
14. Tontonoz P,Hu E,Spiegelman BM:Stimulation of adipogenesis in fibroblasts by PPAR gamma 2, a lipid-activated transcription factor.Cell 1994;79:1147-56.
15. Zhou G,Myers R,Li Y,et al.Role of AMP-acitvated protein kinase in mechanism of metformin action.J Clin Invest 2001;108(8):1167-74.

