摘要
根據美國肝病研究學會 (AASLD) 之治療準則,肝硬化合併腹水病人的治療首先需要戒除酒精與限制鈉攝取,而藥物治療通常優先採用利尿劑合併療法,若病人對利尿劑產生抗性或難治性腹水時,則可建議加入第二線藥物或選擇外科手術方式進行治療。本文報告的案例是一位肝硬化合併嚴重腹水病人,住院初期使用三種利尿劑合併治療,經醫師評估病人排尿反應不佳後,調高利尿劑使用劑量,但每日尿液排除作用仍不顯著。在加入第二線治療藥物 midodrine 後,病人尿液排出量明顯增加,下肢水腫、腰圍與體重等臨床表徵皆有明顯改善。
關鍵字: 肝硬化、腹水、midodrine、refractory ascites、diuretic-resistant ascites
壹、前言
腹水的形成原因很多,依流行病學調查,肝硬化造成腹水的比例約有81%,是最主要成因1,由文獻指出經診斷為肝硬化病人十年內會產生腹水機率有58%,肝硬化合併腹水病人其兩年的存活率僅有50%2。目前腹水致病機轉尚未十分明確,可能原因為門脈高壓造成全身的動脈血管擴張,進一步促使血管擴張因子釋出 (如 nitric oxide、glucagon、endothelin) 而導致有效循環血液容量不足,進而活化腎素-血管收縮素-醛固酮系統 (renin-angiotensin-aldosterone system, RAAS) 造成體內鈉水滯留而形成腹水及周邊水腫症狀3。
臨床診斷方式通常有:一、進行腹水濁音評估 (shifting dullness 或 flank dullness);二、影像檢查包括腹部超音波攝影 (ultrasound)、電腦斷層攝影 (CT scan)、磁振造影 (MRI);三、腹膜穿刺術 (paracentesis)。
根據2013年美國肝病研究學會針對肝硬化合併腹水之治療準則 (表一)4,飲食部分首先需要戒除酒精與限制鈉攝取 (2 g/day),首選治療藥品以口服 spironolactone 與 furosemide 兩種利尿劑合併使用為主,建議每日給藥劑量比例為100 mg: 40 mg (每日最大劑量比例為400 mg: 160 mg),同時應該避免使用 non-steroidal anti-inflammatory drugs (NSAIDs)、angiotensin converting enzyme inhibitors (ACEIs)、angiotensin receptor blocker (ARBs) 和 β-blockers 等藥品,避免腎臟血液灌流減低,進而降低鈉的排除與增加血液中氮的生成。
根據文獻指出,大約有10%病人會對利尿劑治療反應不佳,即所謂利尿劑抗性腹水 (diuretic-resistant ascites) 或難治性腹水 (refractory ascites),一旦產生上述情形,六個月存活率為50%,而一年存活率則僅剩25%5。因此當腹水病人合併有低血壓與 (或) 產生利尿劑抗性時,建議加入 midodrine 作為第二線藥物治療;可能機轉為血管收縮作用促進腎臟血液灌流增加與逆轉利尿劑抗性4,進而增加水分排除,改善腹水與水腫症狀;midodrine 的建議起始劑量為5 mg 每日三次,可依病人臨床反應每24小時增加2.5 mg/dose,最高使用劑量為17.5 mg 每日三次。
表一 肝硬化合併腹水之治療選擇4

貳、案例報告
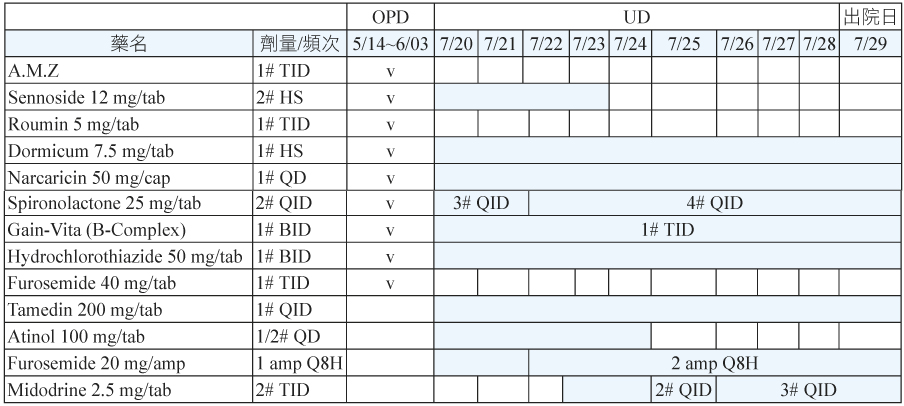
66歲男性病人,身高158公分,體重68公斤;有抽菸與酗酒習慣,因肝硬化合併腹水病史,自102年5月起於本院門診接受藥物常規治療 (表二)。102年7月20日病人因為全身虛弱、食慾不佳、全身無力、腹脹嚴重與下肢水腫至本院住院治療;理學檢查發現:病人意識清楚、有倦怠感、鞏膜黃疸現象、心跳過速、腹部明顯突起 (ovoid shape)、腹水評估呈陽性,下肢呈明顯水腫現象 (pitting edema 4+);入院時生命徵象監測:體溫35.8℃、脈搏132下/min、呼吸19次/min、血壓86/64 mmHg;生化檢查為 BUN 17 mg/dL、Cr 1.6 mg/dL、GOT 51 U/L、GPT 20 U/L、Na 125 mEq/L、K 3.2 mEq/L、Uric acid 9.7 mg/dL (表三)。入院主診斷為肝硬化合併嚴重腹水、高尿酸血症,此次住院治療計畫為使用利尿劑治療。
表二 病人用藥紀錄
表三 檢驗數據
檢驗項目 |
正常值 |
7/20 |
7/26 |
WBC |
4.0-10.1×103/μL |
7.52 |
5.86 |
RBC |
4.0-6.0×103/μL |
3.11 |
2.66 |
Hb |
12.9-17.0 g/dL |
11 |
9.3 |
Ht |
38.0-53.0 % |
31.2 |
27.4 |
MCV |
80.0-100.0 fl |
100.3 |
103 |
MCH |
27.0-32.0 pg |
35 |
--- |
MCHC |
31.0-36.0 g/dL |
33.9 |
--- |
Platelet |
150-400×103/μL |
254 |
197 |
BUN |
8.0-22.0 mg/dL |
17 |
41 |
Creatinine |
0.5-1.3 mg/dL |
1.6 |
4 |
Uric acid |
2.1-7.3 mg/dL |
9.7 |
--- |
GOP (AST) |
3-38 U/L |
51 |
24 |
GPT (ALT) |
3-37 U/L |
20 |
12 |
Albumin |
3.5-5.1 g/dL |
2.7 |
2.7 |
T-Bil |
0.2-1.2 mg/dL |
1 |
--- |
D-Bil |
0-0.2 mg/dL |
0.5 |
--- |
ALP |
104-338 U/L |
556 |
--- |
Cholesterol |
110-220 mg/dL |
94 |
--- |
TG |
39-211 mg/dL |
99 |
--- |
Na+ |
135-153 mEq/L |
125 |
137 |
K+ |
3.5-5.1 mEq/L |
3.2 |
3.2 |
Ammonia |
9-47 μg/dL |
59 |
--- |
7月20日住院後醫師即處方 spironolactone 25 mg/tab 3# QID + furosemide 20 mg/amp 1 amp Q8H + hydrochlorothiazide 50 mg/tab 1# BID 三種利尿劑合併治療,7月22日病人因尿液排除不顯著與水腫情形改善不佳,醫師調整 spironolactone 25 mg/tab 4# QID 與 furosemide 20 mg/amp 2 amp Q8H 後亦未明顯改善,7月23日醫師加入第二線藥物 midodrine 2.5 mg/tab 2# TID 治療,7月25日與7月26日陸續調整劑量為2# QID 與3# QID,使用後病人尿液排出量 (I/O值) 由原本-441 mL ~ -732 mL 明顯改善至-1210 mL ~ -2192 mL (圖一),下肢水腫情形亦有改善(4+→3+),腰圍由114 cm 減少至103 cm,體重由68 kg 減少至57 kg (表四),7月29日病人因病情改善出院改由門診持續追蹤治療。
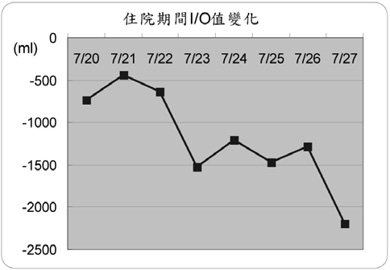
圖一 住院期間尿液排出量 (I/O值) 變化
表四 病人用藥後臨床評估
評估項目 |
7/20 |
7/21 |
7/22 |
7/23 |
7/24 |
7/25 |
7/26 |
7/27 |
7/28 |
7/29 |
|
I/O值 (mL) |
-732 |
-441 |
-640 |
-1528 |
-1210 |
-1468 |
-1282 |
-2192 |
-190+loss |
--- |
|
水腫評估 |
4+ |
4+ |
4+ |
3+ |
3+ |
3+ |
3+ |
3+ |
3+ |
3+ |
|
體重 (kg) |
68.0 |
65.3 |
67.5 |
66.3 |
63.8 |
62.8 |
62.0 |
60.0 |
59.0 |
57.0 |
|
腰圍 (cm) |
114 |
106 |
110 |
108 |
108 |
110 |
109 |
104 |
105 |
103 |
|
血壓(mmHg) |
收縮壓 |
86 |
100 |
89 |
66 |
74 |
90 |
94 |
77 |
83 |
103 |
舒張壓 |
64 |
71 |
56 |
64 |
46 |
55 |
63 |
54 |
59 |
65 |
|
參、討論
肝硬化合併腹水之病人常因為肢體水腫、腹部腫脹,導致食慾減低、生活品質不佳,所以治療目標主要為減少腹水容積與改善末梢水腫情形進而預防相關併發症產生。
病人於住院期間採用 AASLD 治療準則建議之 spironolactone 與 furosemide 兩種利尿劑合併治療,初期由於尿液排除量與體重減輕情形不佳,另考量病人有血鉀偏低問題 (3.2 mEq/L),為避免鉀離子嚴重流失,因此 furosemide 使用比例未按治療準則建議;觀察住院期間鉀離子雖未恢復正常值,亦未因為 furosemide 的劑量增加而有惡化現象,且臨床觀察病人住院期間無明顯心律不整、呼吸急促等低血鉀臨床症狀發生。因此使用利尿劑治療期間須特別注意血中鈉/鉀離子的變化,就本案例入院時鈉離子亦有偏低現象 (125 mEq/L),然而依據文獻建議鈉離子並未 < 120 mEq/L,故未採取限水措施,且經治療後鈉離子濃度已恢復正常;就整體而言利尿劑劑量均未超過每日最高使用劑量範圍 (spironolactone 為200-400 mg/day;furosemide 為60-120 mg/day)。
另外,肝硬化合併腹水之病人若使用注射劑型之 furosemide 投與,可能引發腎血流灌流不足與氮血症,故建議除非病人有心臟衰竭疾病,且醫師考量口服吸收效果不佳時使用,否則應予避免6-9。病人於102年4月住院時本身即有腎功能不佳情形,此次觀察本案例住院期間腎功能有惡化情形,可能與本身疾病有關或是使用注射劑型之 furosemide 造成。儘管如此,文獻也提及使用注射劑型之 furosemide 有利於讓醫師在使用初期時,快速偵測到病人對利尿劑產生抗性問題,而儘快地採取第二線治療6。
由於使用利尿劑治療三天後尿液排除效果不佳,醫師評估病人可能對利尿劑產生抗性故加入 midodrine 治療。根據 Singh V 等人研究7將難治性腹水病人分成兩組各20人,兩組皆採用標準治療 (包含飲食限鈉、使用利尿劑與反覆進行大容積穿刺術),但其中一組加入 midodrine 治療,結果顯示有使用 midodrine 治療,病人之排尿量、尿鈉排除量、平均動脈壓皆明顯增加 (p < 0.05),整體腹水控制則明顯優於未使用 midodrine 病人 (p = 0.013),而未使用 midodrine 病人其死亡率明顯高於有使用 midodrine 病人 (p < 0.046),另外一項研究結果也顯示類似結果8。
本案例住院期間因利尿劑治療效果不佳,加上病人血壓皆有偏低情形 (圖二),故醫師選擇 midodrine 治療為合理考量,在7/23使用後尿液排出量明顯增加,下肢水腫、腰圍與體重等臨床表徵皆有明顯改善;由此顯示,當肝硬化合併腹水病人對利尿劑產生抗性時,配合利尿劑再加入 midodrine 治療,對於病人臨床腹水症狀確實能有效改善。
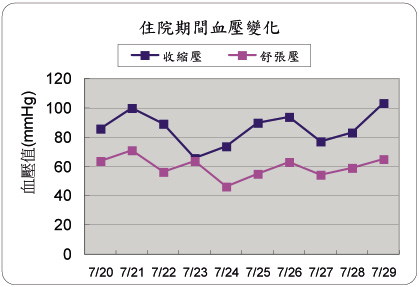
圖二 住院期間血壓值變化
肆、結論
本案例可能為利尿劑抗性腹水或難治性腹水病人,雖然依據 AASLD 之治療準則可採用腹膜穿刺術、腹膜靜脈分流術 (peritoneovenous shunt)、經內頸靜脈肝內門脈-肝靜脈分流術 (transjugular intrahepatic portosystemic shunt; TIPS) 與肝臟移植 (liver transplantation) 等外科治療方式,但本院侷限於地區型醫院規模,未有相關設備可執行上述手術治療,故第二線藥物使用為緩解病人臨床症狀之較佳選擇,且本案例使用midodrine 治療結果確實與相關臨床研究一致,可明顯改善腹水症狀。
Using Midodrine in A Patient with Cirrhosis and Ascites
Yung-Chia Hsu, Chiung-Yueh Chang
Department of Pharmacy, Chien-Yu Hospitol
Abstract
According to the guidelines of American Association for the Study of Liver Diseases (AASLD), patient with cirrhosis and ascites should abstain from alcohol, restrict sodium intake, and adopt combinational diuretics as first-line therapy. Second-line medications or surgical treatment are only considered for patients who develop resistance to diuretics or refractory ascites.
Our case report concerns a patient with liver cirrhosis and severe ascites. Triple combination of diuretics was prescribed at the beginning of hospitalization. The patient showed poor response to these diuretics. Despite subsequent dose elevation of diuretics, no significant improvement was seen on patient’s daily urination.
After adding a second-line medication midodrine to the patient, his daily urination was markedly increased. Significant improvements on clinical manifestations, such as lower limbs edema, waistline and body weight, were also observed.
參考資料:
1. Runyon BA, Montano AA, Akriviadis EA, et al: The serum-ascites albumin gradient is superior to the exudate-transudate concept in the differential diagnosis of ascites. Ann Intern Med. 1992;117(3):215.
2. Gines P, Quintero E, Arroyo V, et al: Compensated cirrhosis: natural history and prognostic factors. Hepatology 1987;7:12-18.
3. Martin PY, Gines P, Schrier RW: Nitric oxide as a mediator of hemodynamic abnormalities and sodium and water retention in cirrhosis. N Engl J Med 1998; 339:533-540.
4. Runyon BA, AASLD. Introduction to the revised American Association for the Study of Liver Diseases Practice Guideline management of adult patients with ascites due to cirrhosis 2012. Hepatology. 2013;57(4):1651.
5. Bories P, Garcia Compean D, Michel H, et al: The treatment of refractory ascites by the LeVeen shunt. A multi-centre controlled trial (57 patients). J Hepatol. 1986;3(2):212.
6. Spahr L, Villeneuve JP, Tran HK, et al: Furosemide induced natriuresis as a test to identify cirrhotic patients with refractory ascites. Hepatology 2001;33:28-31.
7. Singh V, Dhungana SP, Singh B, et al: Midodrine in patients with cirrhosis and refractory or recurrent ascites: a randomized pilot study. J Hepatol 2012;56:348-354.
8. Singh V, Singh A, Singh B, et al: Midodrine and Clonidine in Patients With Cirrhosis and Refractory or Recurrent Ascites: A Randomized Pilot Study. Am J Gastroenterol 2013; 108:560–567.
9. Runyon BA, Such J: Ascites in adults with cirrhosis: Initial therapy. UpToDate online. Available at http://www.uptodate.com.(cited: 25/06/2013)

