摘要
民國71年起政府公告實施藥品 GMP,88年公告「藥品優良製造規範 cGMP」,104年將全面實施 PICS/GMP,大幅提升國內藥品製造廠從製造、品質管理到風險管理的能力,並增加全球市場的競爭力。藥品在製造過程中,除了須符合相關規定外,在藥品上市後,品質監測、不良品通報與回收也是確保藥物品質相當重要的一環。藉由藥物不良品通報之探討,可分析的資料內容包括藥品資料、產品不良缺陷之描述、藥品劑型、廠商處理方式等相關問題,了解整個藥物不良品系統通報的成效,希望未來能進一步提升產品品質,以維護國人用藥安全。
關鍵字: 藥物不良品通報、國際醫藥品稽查協約組織藥品 GMP 法規、藥物安全監視、substandard drugs、drug safety
壹、前言
新藥開發需經過漫長且繁複的流程,所花費的成本更是不計其數1,一個藥品的發明是集合多種專業團隊共同研發製造,其作用於人之療效與安全性皆須受到嚴格把關。目前市面上所販售的藥品,都是經過漫長的時間試驗與評估後才可通過審核機構的標準而上市販賣;新藥上市後廠商仍需持續追蹤藥品於人體服用後的反應,此為 Phase IV 第四階段,此階段目的在於上市後長期安全性監視 (postmarketing surveillance)。如有發現會對人體產生危害,審核機構有權力宣布藥品回收下架,停止銷售。
我國自71年起開始要求藥品製造須符合藥品優良製造規範 (Good Manufacturing Practice,GMP),之後隨著品質觀念的革新及國際 GMP 標準的提升,為了與國際接軌,我國逐步更新西藥 GMP 的規範。繼84年起實施 cGMP 確效作業後,更於99年起正式採用國際通用之 PIC/S GMP「國際醫藥品稽查協約組織 (全名為 Pharmaceutical Inspection Convention and Pharmaceutical Inspection Co-operation Scheme),簡稱 PIC/S」所公布的 GMP 為標準。PIC/S GMP 為目前全球公認最嚴謹,且經歐美先進國家及東南亞等各國採用的製藥規範,依衛生福利部食品藥物管理署第0961401849號公告「西藥製劑製造工廠實施國際 GMP 標準 (PIC/S GMP) 之時程」2,預定至103年12月31日前所有西藥製劑廠全面完成實施。無法通過查核者將不發給產品許可證,屆時產品將無法生產銷售。
不論是學名藥或新藥,每一顆藥的產生,過程都要符合政府的規範,確保藥物的物理、化學、生物、微生物的屬性,能在使用及儲藏期間不受環境的影響,依然可維持其品質安全及療效。藥物不良品的範圍涵蓋產品的包裝、外觀、標示、內容物、療效、以及使用後是否會導致病人產生不良反應 (ADR) 等3。如有嚴重藥物不良品事件發生,根據藥物回收作業實施要點4,藥商於有事實認定其提供之藥物有危害使用者安全與健康之虞者,應主動為必要之處理。
貳、藥物不良品通報作業流程
本院藥物不良品通報及評估作業流程 (圖一),為醫療人員發現藥物不良品時,填寫「品質不良報告單」,送至藥劑科交付專責藥師進行評估及通報。若為嚴重不良品者,由藥事委員會決議暫停使用該藥,並發函通知該供應商限期改善。
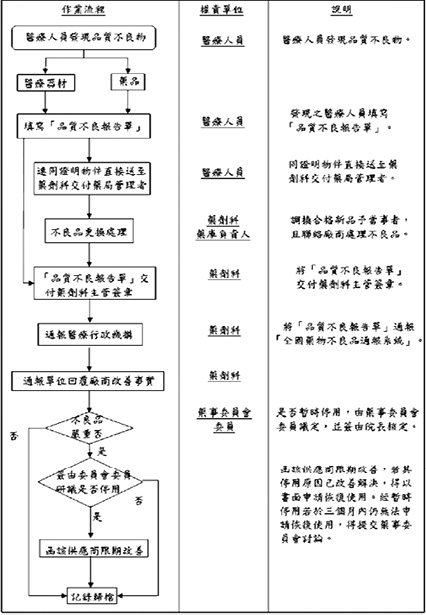
圖一 藥物不良品通報作業流程
參、研究分析
本研究以民國100年至102年做為取樣區間,收集通報至藥劑科之藥物不良品通報案件進行分析,藥師依衛生福利部全國藥物不良反應通報中心公告之「藥物不良品通報表」為基準5,分析資料內容包括藥品資料、產品不良缺陷之描述、藥品劑型等相關問題,以描述性分析統計。
民國100年至102年間共收集90件通報資料 (表一),其中衛署藥輸藥品有41件 (佔45.56%),衛署藥製藥品有49件 (佔54.44%)。藥物不良品之產品型態分析如 (表二),藥品外觀 (非包材) 異常占最大比例 (48件,53.33%),係指藥品本身之異常情形,如顏色異常、大小異常、受潮 (潮溼)、碎裂/破損、外觀不良等,其中碎裂/破損位居所有產品不良型態之首,(23件,25.56%) (圖二)。產品型態分析表中其次為產品包裝 (22件,24.44%),此部份係指包材或包裝過程有異常所引起,如空包、外包裝異常等;其中容器破裂可能為運送過程不當所致。療效不佳 (9件,10.00%),其中有5件導致藥物不良反應 (ADR) 的發生。雜質/異物 (8件,8.89%),係指藥品內混入異物或接觸藥品表面 (但未混入藥品內),如乾燥劑破裂、頭髮。「藥品標示」、「操作發生相關問題」則占較少比例。
表一 通報案件內容
不良品原因分類 |
通報件數 |
|||
國外 (署輸) |
國內 (署製) |
合計 |
比例 |
|
藥品外觀異常 |
17 |
31 |
48 |
53.33% |
雜質/異物 |
5 |
3 |
8 |
8.89% |
藥品標示 |
0 |
1 |
1 |
1.11% |
產品包裝 |
10 |
12 |
22 |
24.44% |
操作發生相關問題 |
2 |
0 |
2 |
2.22% |
療效不佳 |
7 |
2 |
9 |
10.00% |
總數 |
41 |
49 |
90 |
100% |
表二 藥物不良品之產品型態分析表
產品不良型態 |
件數 |
小計 |
百分比 |
|
藥品外觀異常 (非包材) |
顏色異常 |
6 |
48 |
53.33% |
大小異常 |
6 |
|||
受潮 (潮溼) |
1 |
|||
外漏外溢 |
1 |
|||
結塊 |
5 |
|||
外觀不良 |
5 |
|||
發霉 |
1 |
|||
碎裂/破損 |
23 |
|||
雜質/異物 |
異物混入藥品內 |
7 |
8 |
8.89% |
異物接觸藥品表面 (未混入藥品內) |
1 |
|||
藥品標示 |
標示不清 |
1 |
1 |
1.11% |
產品包裝 |
空包 |
5 |
22 |
24.44% |
外包裝異常 |
3 |
|||
外漏/外溢 |
1 |
|||
產品包裝不全 |
5 |
|||
容器破裂 |
6 |
|||
容量 (數量) 不足或錯誤 |
2 |
|||
操作發生相關問題 |
無法依說明使用 |
1 |
2 |
2.22% |
注射針無法壓入稀釋液中,混合接頭斷裂 |
1 |
|||
療效不佳 |
未達預期效果 |
4 |
9 |
10.00% |
效果較之前的差,且引起 ADR 案件 |
5 |
|||
合計 |
90 |
90 |
100% |
|

圖二 藥物不良品態樣
在通報案件劑型中 (表三),以口服錠劑最高 (77件,佔77.78%),其次是口服膠囊劑 (8件,8.89%) 與注射液劑 (5件,5.56%),錠劑不良品遠高於注射針劑,推測可能是因該院所使用之藥品錠劑品項較藥品注射劑品項多所導致(比例約為12:1)。
表三 藥物不良品之劑型分析表
藥物不良品通報案件劑型分析 |
|||
藥品劑型 |
通報件數 |
比例 (%) |
|
口服 |
錠劑 |
70 |
77.78% |
膠囊劑 |
8 |
8.89% |
|
液劑 |
1 |
1.11% |
|
吸入劑 |
3 |
3.33% |
|
注射 |
液劑 |
5 |
5.56% |
粉劑 |
2 |
2.22% |
|
外用液劑 |
1 |
1.11% |
|
總數 |
90 |
100.00% |
|
肆、討論
藥物不良品定義為「懷疑藥品有污染、藥品安定性有問題,或有產品不良、包裝或標示不佳等。6」曾經有國際藥品安全事件發生:2008年於美國境內發現用於洗腎病人的 Heparin 受到“過硫酸化硫酸軟骨素 (over-sulfated chondroitin sulfate, OSCS)”的汙染,由美國百特公司 (Baxter Healthcare Corporation) 宣布回收,至少有785件案例報告指稱因使用這些肝素而產生過敏反應,並有高達81人因此死亡7。2012年9月來自 NECC Framingham 藥廠含有黴菌污染的 melthylprednisolone 針劑導致病人感染腦膜炎 (meningiatis) 的案例8。這些事件,當時引起社會很大的輿論,顯示了藥物不良品及藥物不良反應通報的重要性。藥物不良品通報跟藥物不良反應通報是息息相關的,這兩種通報皆是輔助並啟動藥物回收機制的平台。ADR 和藥物不良品最大的差異是,ADR 是給藥後才能發現,而大多數藥物不良品都能在給藥前發現,相較於 ADR,藥物不良品如果能在一開始就發現藥物有瑕疵、品質不良、混摻甚至使用後產生不良反應,透過線上即時通報,都有可能挽救重大的藥物危害事件。
我國自民國93年元旦起即開放藥物不良品的線上通報,凡藥事法規定之藥物 (包括:藥品、醫療器材),發現品質有瑕疵時,皆可以作通報。若有疑似藥品不良而導致病人受到傷害時,除應做藥物不良反應通報 (ADR) 外,也應做藥物不良品的通報。不良品通報的機制不僅是一個公開平台聯繫著各方如衛生主管機關 (食品藥物管理署、各縣市衛生局)、供應商 (藥物製造或販賣業者) 以及使用者 (如醫療人員、一般民眾) 外,也可讓前線醫療人員即時知道不良品的存在以避免潛在危險;主管機關以及供應商能掌握即時訊息,做好後續的處置,達到藥物回收管理機制的完整連貫。在工作前線的醫療人員們,接觸這些產品時,如發現產品品質不良,有變色、變質、混摻、受汙染等情形,也應主動通報單位主管機關。藉由通報資料的分析、追蹤與調查,與廠商聯繫後,可協助製造廠商發現一些問題。
然而國內通報不良品還有很多進步的空間,藥物不良品的通報還處於被動的狀態,通報機制是屬於 spontaneous reporting (自發性的通報)。在國外,如西班牙的某教學醫院就有所謂的獎勵機制,藉由獎勵機制可以提高通報率,鼓勵前線的醫療人員主動發掘,了解病人使用藥物後的主述反應9;在病人方面,民眾對藥物不良品的通報概念是處於資訊薄弱的狀態,但可藉由醫療人員的宣導及衛教,提升民眾對藥物不良品及藥物不良反應的敏感性;此外,醫療專業人員教育訓練的提升還有跨領域的合作,對藥物安全監視是很重要的,但也需要依賴好的資訊、數據的分析,才能有效提升並確認藥物的各種訊息。衛生主管機關除加強且抽查製造過程中的原料、製程、分析、清潔及確效等步驟外,醫療人員平時也應多了解國內各項衛生法規資訊,收集藥物使用之安全性訊息,提供患者正確的藥物使用資訊,以保障全國民眾之用藥安全。
Analysis of the Medical Defect Products System in A Psychiatric Hospital
Wei-Ting Lai, Shu-Wen Cheng
Department of Pharmacy, Taoyuan Psychiatric Center, Ministry of Health and Welfare
Abstract
Pharmaceutical GMP was announced for implementation by the government since 1982. The GMP for Medicinal Products was announced in 1999, and the PICS/GMP will be comprehensively implemented in 2015 to substantially improve the capability of Taiwan pharmaceutical manufacturers in all aspects from manufacturing, quality control to risk management and increase their competitiveness in the global market. The manufacturing process of drugs must follow relative regulations, and in addition, quality inspection, product defect reports and recall also play important roles in guaranteeing the quality of drugs. Based on the medical product defect reporting system, the study was designed to learn about the effectiveness of the medical product defect reporting system through analyzing relative issues such as the data on drugs, description of product defects, the form of drugs and solutions of manufacturers, expecting to further improve product quality in the future to guarantee drug safety in Taiwan.
參考資料:
1. DiMasi JA, Hansen RW, Grabowski HG: The price of innovation: new estimates of drug development costs. Journal of health economics 2003; 22: 151-85
2. 西藥製劑製造工廠實施國際GMP標準(PIC/S GMP)之時程。資料來源:http://www.fda.gov.tw/TC/lawContent.aspx?id=1369&chk=47d8f500-53e4-4766-a93c-ec2eb602a33a¶m=pn%3d8%26cid%3d68%26cchk%3d5de8311e-df71-4c43-b741-4a65701ba76e。擷取日期: 2014/01/01。
3. Johnston A, Holt DW: Substandard drugs: a potential crisis for public health. British journal of clinical pharmacology 2013:1-63.
4. 衛生福利部(原行政院衛生署)。藥物回收作業實施要點。資料來源:http://www.fda.gov.tw/TC/lawContent.aspx?id=1205&chk=50b15afb-5187-4649-8c00-8c88ae54a43b¶m=pn%3D1%26cid%3D55%26cchk%3Df2d99f85-142b-4517-86c1-571ecbb15758。擷取日期:2014/01/01。
5. 全國藥物不良品通報系統之藥物不良品通報表。資料來源:http://recall.fda.gov.tw/。擷取日期:2014/01/01。
6. 全國藥品不良品通報系統通報填寫指引。資料來源:http://recall.fda.gov.tw/。擷取日期:2014/01/01。
7. Blossom DB, Kallen AJ, Patel PR, et al: Outbreak of Adverse Reactions Associated with Contaminated Heparin, New England Journal of Medicine 2008;359:2674-84.
8. Smith RM, Schaefer MK, Kainer MA, et al: Fungal Infections Associated with Contaminated Methylprednisolone Injections, New England Journal of Medicine 2013; 369:1598-609.
9. Dal Pan, Gerald J: Ongoing Challenges in Pharmacovigilance. Drug Safety 2014;37:1-8.

