摘要
目前臨床上慢性C型肝炎的治療有著顯著長足的進步,傳統以干擾素為基礎的治療由於其療效低、耐受性差及有些患者對干擾素是禁忌而受到限制。但是,近年來許多直接抗病毒藥品 (direct-acting antiviral, DAA) 如雨後春筍般出現,增加治療功效及改善耐受性和安全性。其中 sofosbuvir (GS-7977, SOF) 於2013年12月被 FDA 核准上市用於慢性C型肝炎的治療,是屬於聚合酶 (NS5B polymerase inhibitors) 的特定核苷酸抑制物,針對目前所有基因型皆有不錯的療效。在臨床試驗上,針對基因型第一型未治療過的患者,SOF/Peg-IFN/RBV 三合一療法治療12週,其療效高達90%。全口服用藥 (SOF/RBV) 不含干擾素的治療,針對基因型第二、三型一樣非常有效。在藥物不良反應方面,常見的是疲勞、頭痛、噁心、失眠等,與傳統治療相比較具有較少的藥物不良反應。本文將提供 SOF 的特性及幾個臨床試驗概況,提供大家參考。
關鍵字: 慢性C型肝炎、sofosbuvir、direct acting antiviral
壹、前言
慢性C型肝炎 (Chronic Hepatitis C, CHC) 是全球公共衛生的主要課題,CHC 是由C型肝炎病毒 (Hepatitis C virus, HCV) 所感染而引起的疾病,有別於慢性B型肝炎是亞太地區特有的疾病且已有疫苗可以防治,CHC 則流行於全球各地且無疫苗可用。HCV 感染後可引起慢性肝炎、肝硬化和肝細胞癌。WHO 估計全球約有1.85億人受到感染,而每年約有35萬人因此而死亡1。目前 CHC 的標準療法 (standard of care, SOC) 是合併長效型干擾素 (pegylated interferon, Peg-IFN) 和雷巴威林 (ribavirin, RBV) 持續治療24-48週,此 SOC 的持續性病毒學反應 (sustained virologic response, SVR,停藥後24週在血清中未再驗出病毒量) 大約有50-80%,對於感染 HCV-1 (HCV genotype 1)、肝臟嚴重纖維化,非洲裔人種和合併 HIV 感染者治療效果更差。因此,近幾年來為了改善 SVR 成功率,均致力於研發可以直接作用之抗病毒藥品 (direct-acting antiviral, DAA)。2011年5月,第一代直接抗病毒藥品 telaprevir (TVR, Incivek) 和 boceprevir (BOC, Victrelis) 被美國食品及藥物管理局 (Food and Drug Administration, FDA) 核准上市後,將 HCV-1的治療率從40-44%提高到68-75%2,因為容易產生病毒抵抗性,所以此兩種藥品均不可以單獨使用,必須與 Peg-IFN 和 RBV 合併成三合一療法 (triple therapy) 才可以。在2013年11及12月,FDA 再次核准 simeprevir (SMV, Olysio) 和 sofosbuvir (SOF, Sovaldi) 這兩種 DAA 上市,Simeprevir 與 telaprevir 及 boceprevir 同是屬於蛋白酶抑制劑 (NS3⁄4A protease inhibitors)。而 sofosbuvir 也稱為 GS-7977,本篇將綜述此藥品的臨床治療資訊。
貳、適應症和用法劑量
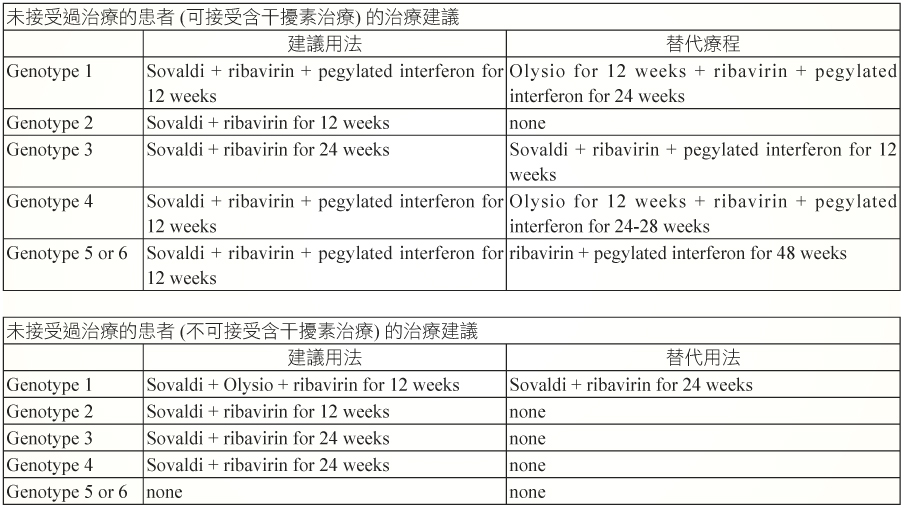
FDA 於2013年12月6日核准 sofosbuvir (400 mg/tab) 上市,治療適應症是用於慢性C型肝炎的治療3,可以合併 Peg-IFN/RBV 用來治療 HCV-1,4,5或6患者,療程為12週,對於 HCV-2患者,可以使用 SOF 合併 RBV治療12週,HCV-3患者,可以使用 SOF 合併 RBV 治療24週,或是使用 SOF 合併 Peg-IFN/RBV 治療12週4。以下 (表一) 是美國肝病醫學協會 (American Association for the Study of Liver Diseases, AASLD) 針對所有基因型的治療建議5。
表一 AASLD 針對慢性C型肝炎所有基因型的治療建議
參、藥物動力學
Sofosbuvir 是2-deoxy-2-fluoro-2-C-methyluridine monophosphate 的前驅藥物2,需要在肝細胞內經過兩次磷酸化才具有活性,它是 HCV 病毒聚合酶 (NS5B polymerase inhibitors) 的特定核苷酸抑制物,分類上屬於 Nucleoside NS5B polymerase inhibitors,抑制此聚合酶後會造成病毒的基因組複製週期終止,SOF 是這分類中第一個上市的藥品。研究顯示每日服用一次400 mg 具有最佳抑制 HCV 效果4,空腹或飯後服用皆可,不受食物影響,藥品吸收快速,服藥後到達最高血中濃度的時間 time to peak concentration (Tmax) 約0.5-3小時,排除半衰期 (elimination half-life) 約0.4小時,但其代謝物 GS-331007排除半衰期可長達27小時6,SOF 約有76%是在腎臟清除,中重度腎功能不良的患者不需要調整劑量,對於嚴重腎功能不良 (eGFR < 30 mL/min/1.73 m2) 或是末期腎臟病 (end-stage renal disease, ESRD) 患者的安全性尚未建立,所以不建議使用。輕度至重度肝功能的患者不需要調整劑量。SOF 因為不是經由 CYP3A4路徑代謝,所以比較沒有藥物交互作用,對於治療 HIV 用藥,如:核苷酸反轉錄酶抑制劑 (nucleoside reverse transcriptase inhibitors; NRTIs),ex: tenofovir and emtricitabine、非核苷酸反轉錄酶抑制劑 (non-nucleoside reverse-transcriptase inhibitors; NNRTIs),ex: efavirenz and rilpivirine,或蛋白酶抑制劑 (protease inhibitors; PIs),ex: darunavir or ritonavir,臨床上皆無顯著的交互作用7。
肆、臨床試驗
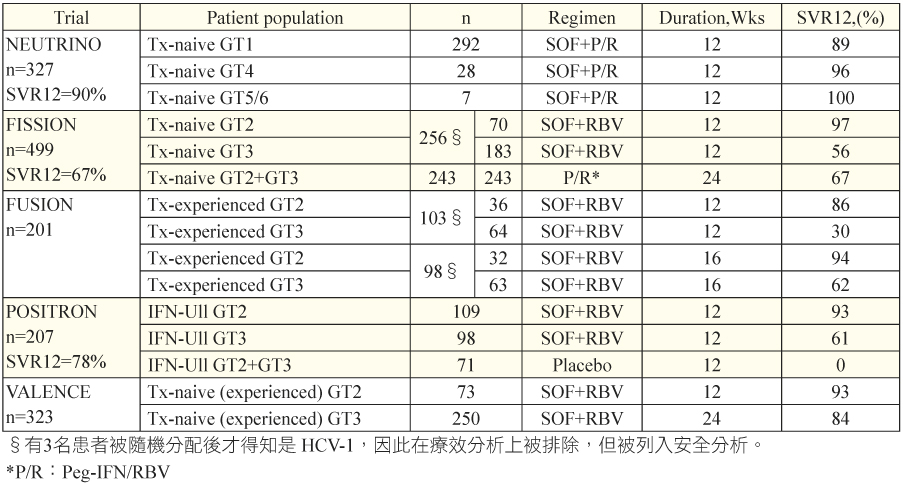
到目前為止已經有五個 SOF 的第3期臨床試驗發表,其研究的均是 CHC 患者服用400 mg 的 SOF 與標準療法的療效分析,接下來將分享這些臨床試驗 (表二、圖一)7。
表二 Phase III studies of sofosbuvir
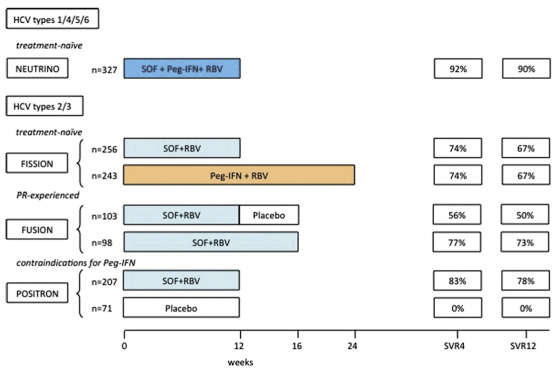
圖一 Phase III studies of sofosbuvir
一、NEUTRINO study8
此研究屬於 open-label, multicentered study,收錄了327名之前未接受過標準療法的 CHC 患者,包括了基因型1,4,5和6,評估 SOF/Peg-IFN/RBV 此組合治療12週的有效性和安全性。整體而言,有99%的患者有達到快速病毒學反應 (rapid virologic response, RVR,用藥治療4週後血清中病毒量即低於檢測極限者),最終有90%的患者有達到 SVR12 (停藥後12週在血清中未再驗出病毒量)。分析各個基因型,HCV-1有89% (其中 HCV-1a 有92%,高於 HCV-1b 的82%)、HCV-4有96%和 HCV-5,6 (儘管數量不多) 有100%達到 SVR12。對於非洲裔人種,有87%達到 SVR12。針對肝硬化患者,有80%達到 SVR12 (圖二),此組合治療對於肝硬化患者有較安全的治療效果。SOF 的耐受性良好,並未增加標準療法的副作用,報告中最常見的副作用是疲勞 (59%)、頭痛 (36%)、噁心 (34%)、失眠 (25%)。
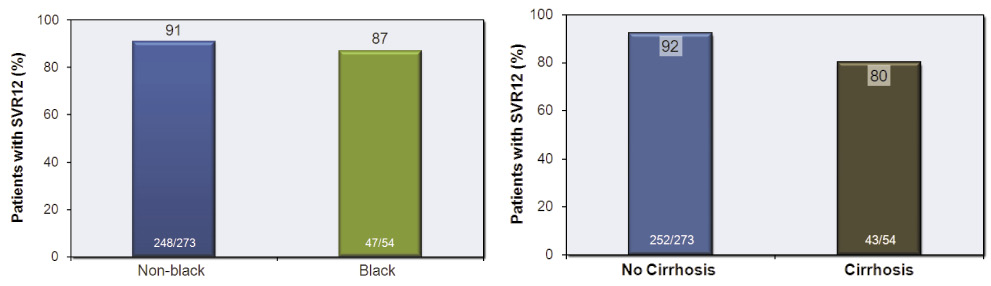
圖二 NEUTRINO 非洲裔人種及肝硬化患者的治療率
二、FISSION study8
此研究屬於 randomized,open-label,non-inferiority study,收錄了499名 HCV-2和3之前未接受過標準療法的 CHC 患者,比較 SOF/RBV 治療12週與 Peg-IFN/RBV 治療24週的療效,其中 SOF/RBV 治療12週的療程是不含干擾素的治療 (IFN-free regimen)。研究中雖然兩組的 RVR 有明顯的差別 (分別為99%和67%),但是兩組的 SVR12均為67%。單獨來看 IFN-free 這組,HCV-2有97%有達到 SVR12,HCV-3則只有56%,HCV-2的療效比 HCV-3高。無肝硬化患者有72%有達到 SVR12,肝硬化患者則只有47%,但是還是比 Peg-IFN/RBV這組的38%來的高 (圖三)。SOF/RBV 這組的副作用組顯著比 SOC 來得少,就血色素下降方面,SOF/RBV 這組有9%的患者下降至10 g/dL 以下,比 SOC 這組的14%來的低。此研究告訴我們,就 HCV2/3而言,全口服藥療程的療效與 SOC 相似,但副作用卻來比較低。
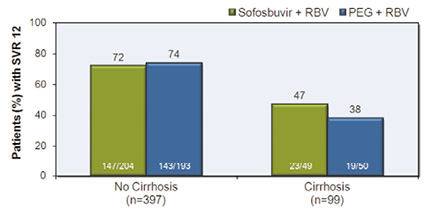
圖三 FISSION 肝硬化患者的治療率
三、POSITRON study9
此研究屬於 randomized, double-blind, placebo-controlled study,收錄了278名 HCV2/3患者,收錄患者為對干擾素是禁忌、無法忍受干擾素的副作用、或是不願意接受干擾素治療者,以3:1比例分配成兩組接受 SOF/RBV 或 Placebo 治療,療程皆為12週,治療組 (SOF/RBV) 是屬於 IFN-free regimen。整體上,治療組有78%達到 SVR12,對照組則無人達到。此研究,同樣是收錄 HCV2/3患者,但是整體的治療率卻高於 FISSION study (78% v.s. 67%),分析可能原因是此研究裡面 HCV-2的患者比例較高 (53% v.s. 27%),而 HCV-2的治療成功率比 HCV-3來的較高。分析治療組裡兩種基因型的療效,HCV-2和 HCV-3的 SVR12分別是93%和61%。對31名肝硬化患者而言,整體 SVR12是61%,而HCV-2是94%,但是 HCV-3卻只有21%,顯示此療程對 HCV-3肝硬化患者治療率差 (圖四)。最常見的不良反應為疲勞 (44%)、噁心 (22%)、頭痛 (21%)、失眠 (19%) 和瘙癢 (11%)。血色素下降方面,只有7%的患者下降至10 g/dL。
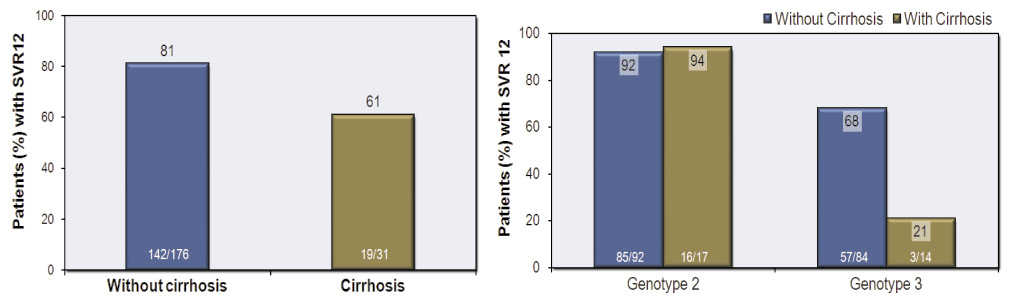
圖四 POSITRON 肝硬化患者的治療率
四、FUSION study9
此研究屬於 randomized, double-blind,, active-control study,收錄以前對 Peg-IFN/RBV 治療失敗的 HCV2/3患者,接受 IFN-free regimen 的治療,患者隨機被分配到治療12週或16週療程,此研究主要是在比較治療16週是否比12週的療效好。整體而言,治療16週的 SVR12顯著優於12週 (73% v.s. 50%),分析兩種基因型,跟 FISSION 與 POSITRON 結果一樣,此療程對於 HCV-2的療效高於 HCV-3,分析治療週數,治療16週的療效優於12週 (HCV-2:94% v.s. 86%;HCV-3:62% v.s. 30%)。分析肝硬化患者的治療結果,在兩組治療組中 (12週與16週),無肝硬化患者的療效分別是61% v.s. 76%,肝硬化患者則是31% v.s. 66% (圖五)。就 HCV-2而言,無肝硬化患者的療效分別是96% v.s. 100%,肝硬化患者則是60% v.s. 78%,就 HCV-3,無肝硬化患者的療效分別是37% v.s. 63%,肝硬化患者則是19% v.s. 61% (圖六),再次印證,肝硬化及 HCV-3對於治療有較差的結果,然而,延長治療時間可顯著改善療效,副作用卻沒有因此而增加。此研究有一點令人振奮的訊息是,如果患者是 HCV-2且無肝硬化,是有可能百分之百將慢性C型肝炎治癒的。
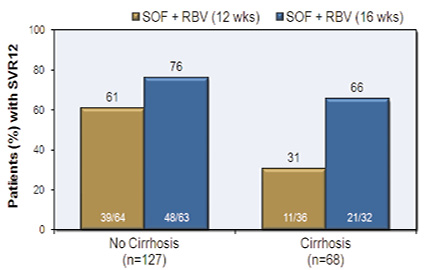
圖五 FUSION 肝硬化患者的治療率 (依治療時間)
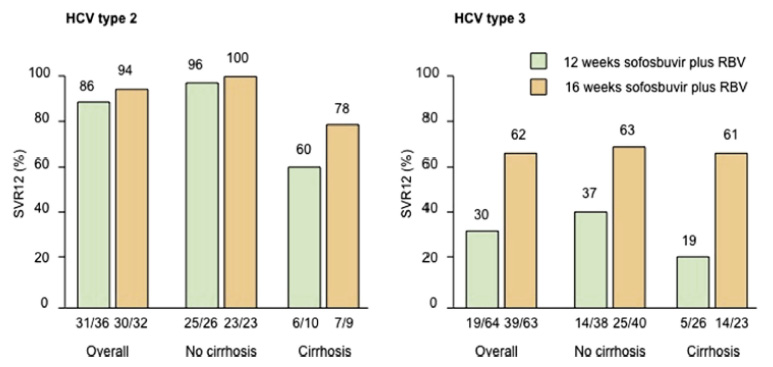
圖六 FUSION 肝硬化患者的治療率 (依基因型)
五、VALENCE study3
此研究屬於 randomized, double-blind, multinational study,收錄未接受過治療或有治療經驗的 HCV2/3患者,依基因型分成兩組接受 IFN-free regimen 的治療,評估 HCV-2接受12週治療及 HCV-3接受24週的療效。HCV-2的 SVR12是93%,未接受過治療與有治療經驗的 SVR12分別是97%和91%;HCV-3的 SVR12是84%,未接受過治療與有治療經驗的 SVR12分別是93%和77%。由 FISSION、POSITRON、FUSION 與 VALENCE 四個研究發現,SOF/RBV 組合無論何種療程,對於 HCV-2的療效高於 HCV-3,但我們也發現,對於 HCV-3患者,延長治療週期從12週到24週,SVR12明顯增加。
伍、不良反應
雖然 TVR 和 BOC 將 HCV-1的治療率提高到68-75%,但是此三合一療法也同時提高副作用及較差的藥物耐受性,然而臨床研究顯示,我們發現 SOF 的耐受性良好,幾乎沒有不良反應的報導。不管是 SOF 單一治療或是 SOF/RBV 二合一療法中,較少患者因為藥物不良反應而中斷治療。以 FISSION study 為例,SOF/RBV (不含干擾素) 這組中斷治療的患者約1%,而 Peg-IFN/RB 這組卻有11%。另外,憂鬱症是使用干擾素治療時常見的副作用,在 FISSION 研究中,SOF/RBV 這組發生率約5%,而 Peg-IFN/RBV 這組卻是14%8。與 RBV 相關的不良事件是常見的,如疲勞,失眠和貧血,而頭痛副作用也常有報導。在血液學異常方面,如嗜中性白血球低下 (neutropenia),貧血 (anemia),血小板過低 (thrombocytopenia),我們觀察到療程中有包括長效型干擾素時,這些副作用皆會出現,如果是 IFN-free 治療時,只有出現貧血而已。雖然上市後的數據尚未公佈,SOF 似乎有良好的安全性和耐受性。
陸、總結
未來,治療慢性C型肝炎將是朝向 IFN-free regimen,多種直接抗病毒藥品搭配使用的「雞尾酒療法」,接下來幾年,陸陸續續將有好幾種 DAA 藥品向美國食品及藥物管理局 (FDA) 申請上市,這些藥品將更安全有效的治癒慢性C型肝炎,治療療程也大幅縮短,不需要再打針,只需要口服使用幾顆抗病毒藥品,造福一些對干擾素有禁忌、肝硬化患者及對現行標準療法無效或再復發的患者。全世界認為根除C型肝炎病毒感染如今已成為一個很接近而可實現的目標。因此,我們需要向民眾宣導,使民眾可以及早就醫治療,將可成功預防肝臟功能進一步惡化,提高存活率。
Sofosbuvir for the Treatment of Chronic Hepatitis C Infection
Wei-Ting Shen1, Chun-Nan Wu1, Chun-Che Lin2Department of Pharmacy, Chung-Shan Medical University Hospital1School of Medicine, Chung-Shan Medical University2
Abstract
Treatment of chronic hepatitis C (CHC) is currently undergoing a significant change. Traditional interferon-based therapy has been limited by both efficacy and tolerability, and many direct acting antiviral (DAA) drugs are emerging. Sofosbuvir was approved for use by the Food and Drug Administration in December 2013 for the treatment of chronic hepatitis C. It belongs to nucleotide inhibitors of viral polymerase NS5B and acts as a chain terminator during the HCV replication process, exhibiting pan-genotypic antiviral activity with a high barrier to resistance. In clinical trials, 12 weeks of SOF with concomitant Peg-IFN and RBV therapy in treatment-naive HCV genotype 1 patients resulted in SVR rates of > 90%. An all-oral regimen of SOF/RBV is highly effective for genotype 2 and 3 patients. SOF was found to be tolerable with minimal adverse effects (AEs). This article provides an overview of SOF features and the main clinical trials, discussing key results and potential future developments.
參考資料:
1.Guidelines for the screening, care and treatment of persons with hepatitis infection. World Health Organization, 2014 April.
2. Stedman C. Sofosbuvir, a NS5B polymerase inhibitor in the treatment of hepatitis C: a review of its clinical potential. Therap Adv Gastroenterol. 2014 May; 7(3): 131-40.
3. Rose L, Bias TE, Mathias CB, et al: Sofosbuvir: A Nucleotide NS5B Inhibitor for the Treatment of Chronic Hepatitis C Infection. Ann Pharmacother. 2014 May; 48(8): 1019-1029
4. Micromedex 2.0
(http://www.micromedexsolutions.com/micromedex2/librarian/ND_T/evidencexpert/ND_PR/evidencexpert/CS/DBB1AE/ND_AppProduct/evidencexpert/DUPLICATIONSHIELDSYNC/18AD61/ND_PG/evidencexpert/ND_B/evidencexpert/ND_P/evidencexpert/PFActionId/evidencexpert.DisplayDrugpointDocument?docId=930837&contentSetId=100&title=Sofosbuvir&servicesTitle=Sofosbuvir&topicId=dosingAndIndicationsSection&subtopicId=adultDosingSection)
5. Recommendations for Testing, Managing, and Treating Hepatitis C. American Association for the Study of Liver Diseases, 2014.Feb.
6. Degasperi E, Aghemo A. Sofosbuvir for the treatment of chronic hepatitis C: between current evidence and future perspectives. Hepat Med. 2014 Apr 29; 6: 25-33.
7. Mariño Z, van Bömmel F, Forns X, et al: New concepts of sofosbuvir-based treatment regimens in patients with hepatitis C. Gut. 2014 Feb; 63(2): 207-215.
8. Lawitz, E., Mangia, A., Wyles, D., et al: Sofosbuvir for previously untreated chronic hepatitis C infection. N Engl J Med. 2013 May; 368(20): 1878-1887.
9. Jacobson IM, Gordon SC, Kowdley KV, et al: Sofosbuvir for hepatitis C genotype 2 or 3 in patients without treatment options. N Engl J Med. 2013 May; 368(20): 1867-1877.

