摘要
新生兒持續性肺高壓 (persistent pulmonary hypertension of newborn, PPHN) 臨床表現特色為出生後肺血管阻力持續增加、由動脈導管及/或卵圓孔右至左分流的變化,儘管近年來對此疾病的認識及治療技術都有新進展,但是與 PPHN 相關的死亡率仍高達10-15%,存活嬰兒中有7-20%可能留下:聽力受損、慢性肺疾病、神經學發展障礙等後遺症,是臨床不可輕忽的常見新生兒徵候群。PPHN 治療目標在於降低肺血管阻力、維持體循環血壓、並導正右向左分流之胎兒循環模式及改善氧合狀態,必須盡早介入治療以防止嚴重低血氧與預防短期及長期的罹病率。
關鍵字: 新生兒持續性肺高壓、持續性胎兒循環、新生兒徵候群、persistent pulmonary hypertension of the newborn、persistent fetal circulation、neonatal syndrome
壹、前言
新生兒持續性肺高壓乃屬新生兒徵候群,被證實已超過三十年,主要發生在足月或過期分娩嬰兒身上,典型在出生後12-24小時內即出現症狀,臨床表現特色為存在肺血管阻力增加,並持續動脈導管及/或卵圓孔右至左分流的胎兒循環模式,故又稱之為持續性胎兒循環 (persistent fetal circulation, PFC)1,2。儘管目前對 PPHN 的認識及治療都有新進展,但與 PPHN 相關死亡率仍高達10-15%,存活嬰兒中有7-20%可能留下如:聽力受損、慢性肺疾病、神經學發展障礙等後遺症,是臨床不可輕忽的常見新生兒徵候群2。
貳、病因學1-3
正常人體血液循環仰賴肺循環與體循環來維持運作,胎兒時期因肺泡塌陷造成很高的肺血管阻力,嚴格限制了肺血管的血流,所以胎兒時期並沒有肺循環。胎兒血流藉由心房之間的卵圓孔,右心房血流可直接送至左心房,或透過介於肺動脈與主動脈之間的動脈導管來接通兩條主動脈血流運行,此右至左分流的循環模式即為胎兒循環模式 (圖一)。
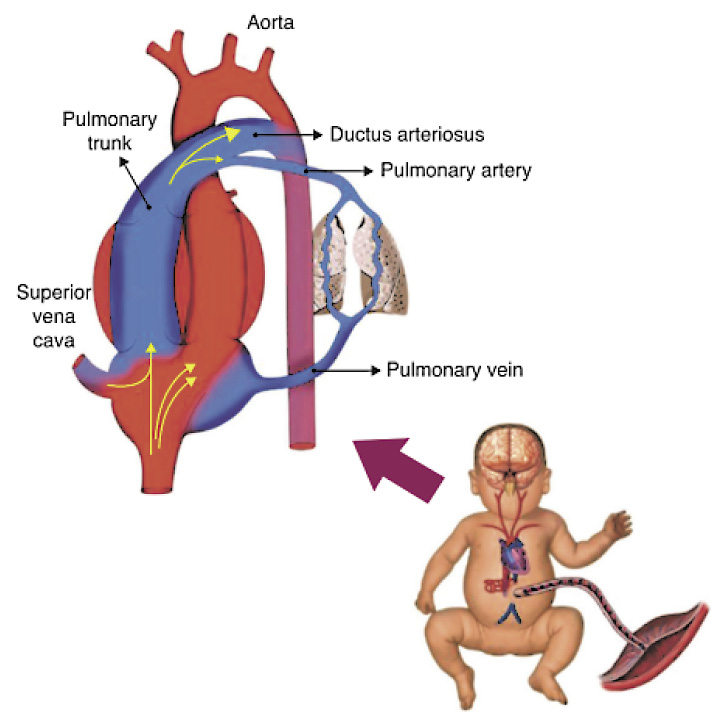
圖一 胎兒循環1
新生兒出生後開始行呼吸作用,在氧分壓上升、氧合作用使肺泡擴張後,肺血管阻力會快速下降,當阻力下降失敗則可能造成 PPHN。PPHN 即肺血管阻力大於體循環所致的生理現象,定義為肺血管阻力增加並存在動脈導管及/或卵圓孔右至左分流變化,亦即維持胎兒循環模式,PPHN 相較於成人其差異性比較 (表一)。
表一 新生兒與成人肺高壓比較1
|
新生兒 |
成人 |
定義 |
肺血管阻力增加並持續經由動脈導管及/或卵圓孔右至左分流 |
運動時肺動脈壓 > 25或30 mmHg 及肺動脈楔壓 < 15 mmHg |
盛行率 原發性 家族性 |
1.9/1,000活產嬰兒 |
2-3/百萬 0.2-0.3/百萬 |
女:男 |
男性占優勢 |
> 2:1 |
病人發生的年齡 |
新生兒時期 |
36歲 |
病因 |
多重因素 |
多重因素 |
基因突變 (BMPRII)* |
未知 |
75%家族性;10-40%原發性 |
臨床進程 |
通常是短暫的 |
慢性病程漸進性惡化 |
5年存活率 |
90% (15-20%伴隨神經學上缺損) |
30-40% (老人);50% (成人) |
* BMPRII 為 bone morphogenetic protein receptor II
PPHN 致病因可能是多重因素造成,一般認為可能跟母親的狀態 (如:肥胖、糖尿病、服用 NSAIDs 藥物)、人種有關,研究發現過期分娩嬰兒有較高發生率。PPHN 跟分娩前胎兒缺氧有很密切相關性,美國統計發現 PPHN 常合併胎便吸入徵候群 (42%),其次為原發性 (27%),其它還包括:呼吸窘迫症候群、敗血症、窒息等情況1。
參、PPHN 的分類4
依可能致病機轉概分為四類:
一、肺血管適應不良型
(Maladaptation)
因周產期時壓力 (如缺氧、胎便吸入) 導致肺血管收縮,增加肺血管阻力所致。
二、 血管壁肌肉肥厚型
(Excessive muscularization)
肺泡組織中動脈血管壁肌肉肥厚增生,增加肺血管阻力而導致肺高壓。
三、 肺組織發育不良型
(Hypoplastic lung)
肺組織發育不全可能造成肺高壓。
四、 肺血管血流阻塞型
(Flow obstruction)
血液黏稠度增加可能造成肺血管血流阻塞而產生肺高壓的症狀。
造成 PPHN 原因通常是多重因素,上述四種類型彼此也可能互有關聯,必需全面性考量。
肆、臨床診斷
一、 臨床表徵1
典型症狀會出現呼吸急促、發紺等情形,症狀可能持續數天至數星期不等。血液氣體分析血氧分壓會明顯下降,呈現酸血症,胸部X光顯示心臟通常無異常。
二、 高氧試驗 (Hyperoxia test)5
以100%氧氣吸入5-10分鐘,若屬肺實質疾病則可輕易提升動脈血氧分壓至100 mmHg,若無法顯著提升則可能為 PPHN。
三、 動脈導管前後氧壓差值測量4
動脈導管前後氧分壓差值 > 20 mmHg 表發生動脈導管右至左分流情形,確認為 PPHN;氧分壓無明顯差異亦不能排除 PPHN,應進一步行心臟超音波確認。
四、 心臟超音波5
可排除先天構造異常之心臟疾患。計算右心室收縮時間比值 (右心室收縮前期/右心室射出時間),若 > 0.5可能為 PPHN。
伍、PPHN 治療
治療目標在降低肺血管阻力、維持體循環血壓、導正右至左分流之胎兒循環模式及改善氧合狀態,治療包括以下組成:
一、一般處置2
維持正常體溫、迅速矯正電解質異常、代謝性酸中毒、低血氧等症狀是最基本的。最初呼吸器設定即應給予100%的氧氣,氧氣是最好的肺血管擴張劑,以降低肺血管阻力、確保足夠的氧合作用,但維持高氧濃度即使只是短時間仍可能造成肺損傷,因此應將 PaO2目標維持在50-90 mmHg (血氧飽和度 > 90%)。存在實質肺疾病時,應考慮插管以改善肺泡擴張情形,若懷疑有肺泡表面作用劑缺乏 (如:新生兒呼吸窘迫、胎便吸入徵候群) 則應給予 surfactant6。
氧合指標 (oxygenation index, OI) 評估可指引吸入性 NO 或 extracorporeal membrane oxygenation (ECMO) 的介入時機。OI 計算如下:OI =﹝平均氣道壓力 (MAP) × 吸入氣體氧分壓 (FiO2) ÷ 動脈導管後氧分壓 (PaO2)﹞× 100。
氧合指標越高表低血氧越嚴重,當 OI ≧ 25應考慮使用吸入性 NO (合併高頻震盪呼吸器 high frequency oscillatory ventilation, HFOV) 或 ECMO 治療2。
二、血液動力學維持1
PPHN 循胎兒循環模式,使心輸出量減少,因此血壓低時需要使用強心劑。(一)Dopamine 最常使用於新生兒,建議劑量2.5-10 mcg/kg/min,目標維持平均動脈壓於45-55 mmHg。(二)Dobutamine 可改善心輸出量,但並未確實增加新生兒血壓,建議劑量5-20 mcg/kg/min。(三)Epinephrine 可增加平均動脈壓及左心室輸出量,建議劑量0.05-2 mcg/kg/min。(四)在小型觀察型研究中發現 norepinephrine 會同時增加體循環及肺動脈壓,改善左心室輸出量,降低肺動脈壓/體循環動脈壓比值,減低氧需求量7。建議劑量0.5-2 mcg/kg/min。
三、常見肺血管擴張劑 (表二)1
表二 肺血管擴張劑使用劑量及機轉1
藥物 |
投予劑量 |
機轉 |
Nitric oxide |
吸入5-20 ppm |
作用於血管內皮細胞,增加肺平滑肌細胞內 cGMP 以達血管擴張作用 |
Prostaglandins |
Prostacyclins 持續輸注或吸入 Iloprost: 吸入0.5-2 mcg/kg /dose |
作用來自 arachidonic acid,增加肺平滑肌細胞內 cAMP 以達血管擴張作用 |
Sildenafil
|
注射或口服0.5-2 mg/kg/dose/6h |
抑制 phosphodiesterase enzyme type V,源自於 cGMP 降解 |
Milrinone |
注射0.3-0.8 mcg/kg/min |
抑制 phosphodiesterase enzyme type III,源自於 cAMP 降解 |
Bosentan |
口服劑量: 依體重制訂如文中說明 |
非選擇性拮抗血管內皮素 (endothelin) A及B接受體 |
(一) 吸入性 NO (inhalation nitric oxide, iNO)
iNO 是當前考慮的標準治療方式,iNO 到達肺泡區並擴散至肺動脈平滑肌,藉增加 cGMP 達血管擴張作用。自1997年開始便有許多臨床試驗證實 iNO 可顯著改善氧合作用並減低需要 ECMO 治療的比例及減低 > 34週有嚴重呼吸衰竭症狀的新生兒死亡率8,9。建議初始劑量最高為20 ppm,更高劑量並未顯示有更好的效果,反而增加高變性血紅素血症 (methemoglobinemia) 發生。由於 NO 與 O2作用後可產生 NO2、N2O2等具自由基之氧化物,高濃度下可能造成急性肺損傷,且 NO 於血液中會快速與血紅素結合而產生變性血紅素 (methemoglobin, MetHb),MetHb 本身無攜氧能力,會加重病嬰缺氧症狀,雖血紅素內存在變性血紅素還原酵素,為防止 MetHb 濃度過高需密切監測 MetHb 濃度維持在 < 5%,以避免造成傷害。iNO 只能當成治療的一部分,目的在於救急、改善病況,考量其可能的副作用及毒性,不可長期依賴此治療方式,當病況獲得改善應考慮儘速及早脫離10。
(二)Prostaglandins
吸入或注射 prostacyclin 對於 iNO 治療失敗時可能會是有效的介入,但缺乏足夠的證據來證明其療效及安全性,並不建議長期使用1。
(三)Sildenafil
臨床上約30%患者可能對 iNO 治療反應不佳,可以 phosphodiesterase inhibitors 如:sildenafil、milrinone 來改善肺血管系統高濃度 phosphodiesterases 的狀態,達降低肺血管阻力的作用。有許多臨床研究證實 sildenafil 成功治療 PPHN,在一系統性回顧文獻中收納77位 PPHN 新生兒,收納對象皆為 iNO 治療不佳者,研究發現口服給予 sildenafil 比對照組顯著降低死亡率且每治療3位就有1位可得到好處 (RR 0.20, 95% CI 0.07-0.57; Number needed to treat 3, 95% CI 2-6),氧合作用在投與第一劑 sildenafil 後即穩定改善,也未發現臨床重要的副作用,作者建議在醫療資源有限的機構中以 sildenafil 治療 PPHN 可能帶來顯著的益處,但仍需更大型試驗來確認其療效及安全性11。目前台灣健保核准 sildenafil (Revatio 20 mg/tab) 用於成人原發性肺動脈高壓、結締組織病變導致或先天性心臟病併發之肺動脈高壓 (Eisenmenger 症候群) 運動能力差 (WHO Functional Class III 及 IV) 之患者,未核准用於 < 18歲兒童。2012年美國 FDA 提出警告 sildenafil 不應用於治療小兒肺動脈高壓 (pulmonary arterial hypertension, PAH),報告指出投予高劑量 sildenafil 於1-17歲小兒研究發現較低劑量 sildenafil 組,發生較高非預期性死亡風險,大部分致死原因皆因肺高壓及心衰竭所致,相對而言低劑量則無法達到改善運動能力的效果12。總結上述的結論,雖然 sildenafil 研究證實其治療是有希望成功的,但研究證據力仍顯不足,因此若 iNO 治療有效則不建議使用 sildenafil,除非有大型隨機對照實驗能更進一步確認其療效及安全性。
(四)Milrinone
小型研究證實 milrinone 在 iNO 治療反應不佳的新生兒中可改善氧合作用,但發現有病嬰出現心室內出血症狀,其安全性仍需進一步研究來確認13。
(五)Bosentan
Bosentan (Tracleer) 是 endothelin receptor antagonist,具收縮血管特性。在一收納47位 PPHN 新生兒 (iNO 及 ECMO 治療不佳) 研究中指出短期使用 bosentan (1 mg/kg 一天兩次),對改善 OI 及血氧飽和度都比對照組 (placebo 組) 效果來得好,且減低需機械通氣的時間,研究指出 bosentan 用於治療 PPHN 是有效且安全的14。目前台灣健保核准 bosentan 經事前審查核准後用於原發性肺動脈高壓之治療。Bosentan 用於兒童經驗有限,依現有資料建議於 ≧ 3歲患者劑量為:體重 > 40 kg 最初4週起始劑量62.5 mg/一天二次,維持劑量125 mg/一天二次;體重20-40 kg 最初4週起始劑量31.25 mg/一天二次,維持劑量62.5 mg/一天二次;體重10-20 kg 最初4週起始劑量31.25 mg/一天二次,維持劑量31.25 mg/一天二次。
(六)MgSO4
初始劑量200 mg/Kg 輸注20-30分鐘以上,維持劑量20 mg/kg/hr4。
四、 鎮靜劑
新生兒哭鬧會增加肺血管阻力,臨床可能會使用 opioid analgesic 來使新生兒安定。治療選擇包括 morphine sulfate (初始劑量100-150 mcg/kg 輸注 > 1小時,維持劑量10-20 mcg/kg/hr) 或 fentanyl (1-5 mcg/kg/hr)。但 narcotics 常會有導致低血壓副作用,因此應盡量維持在最低有效劑量,並於症狀改善後儘速停藥1,2。
五、 ECMO
已給予最高劑量 iNO 治療仍無法改善 PPHN 低血氧症狀,則應考慮 ECMO 治療,目標在於維持組織有足夠的氧供給並避免不可逆的肺損傷。在一收納2000-2010年案例的大型研究中指出 ECMO 治療存活率達81%15。
陸、結論
PPHN 是新生兒急症,必須盡早介入治療以防止嚴重低血氧、預防短期及長期罹病率,治療除上述組成之外,最主要還是需針對潛在疾病加以治療。現今醫療的進步讓 PPHN 死亡率雖有降低趨勢,但仍高達10-15%,是不容小覷的新生兒徵候群。對於可能遺留神經學發展障礙或造成慢性疾患風險的嬰兒,出院後皆應長期追蹤。
Advances in the Treatment of Persistent Pulmonary Hypertension of the Newborn
Ju-Chun Shiao1, Kai-Lun Sheu2,3, Chien-Ying Lee1,3
Department of Pharmacy, Chung Shan Medical University Hospital1
Department of Family and Community Medicine, Chung Shan Medical University Hospital2,
School of Medicine, Chung Shan Medical University3
Abstract
The clinical feature of persistent pulmonary hypertension of the newborn (PPHN) is typically characterized by marked elevation of pulmonary vascular resistance (PVR) which causes right-to-left intracardiac shunting of blood across the ductus arteriosus and/or foramen ovale. In recent years, clinical practitioners have accomplished great progress in understanding this disease and its treatment; however, relevant mortality of PPHN can still reach 10-15%. Among those surviving newborns, 7-20% may have following post-term disorders such as hearing loss, chronic lung disease, and neuro - developmental impairment. PPHN is a common neonatal syndrome that could not be ignored. The therapeutic goals of PPHN include reduction in the PVR, maintenance of normal blood pressure of the systemic circulation, and correction of the right-to-left shunting in order to improve oxygenation. These procedures should be carried out as soon as possible to prevent severe hypoxemia and thus decrease both the short-and long-term morbidity.
參考資料:
1. Joaquim E. B.Cabral, Jaques Belik: Persistent pulmonary hypertension of the newborn: recent advances in pathophysiology and treatment. J Pediatr (Rio J) 2013;89:226-42.
2. Ru-Jeng Teng,Tzong-Jin Wu: Persistent pulmonary hypertension of the newborn. Journal of the Formosan Medical Association 2013; 112: 177-84.
3. Steven H. Abman: Recent advances in the pathogenesis and treatment of persistent pulmonary hypertension of the newborn. Neonatology 2007; 91: 283-90.
4. 黃富源,李宏昌編著:臨床兒科學,第六版。台灣:嘉洲出版社,2001;207-9。
5. Mohammed Puthiyachirakkal, Maroun J. Mhanna: Pathophysiology, management, and outcome of persistent pulmonary hypertension of the newborn: a clinical review. Frontiers in pediatrics 2013; 1: 1-6.
6. Lotze A, Mitchell BR, Bulas DI, et al: Multicenter study of surfactant (beractant) use in the treatment of term infants with severe respiratory failure. J Pediatr 1998; 132: 40-7.
7. Tourneux P, Rakza T, Bouissou A, et al: Pulmonary circulatory effects of norepinephrine in newborn infants with persistent pulmonary hypertension. J Pediatr 2008; 153: 345-9.
8. The Neonatal Inhaled Nitric Oxide Study Group: Inhaled nitric oxide in full-term and nearly full-term infants with hypoxic respiratory failure. N Engl J Med 1997; 336: 97-604.
9. Clark RH, Kueser TJ, Walker MW, et al: Low-dose nitric oxide therapy for persistent pulmonary hypertension of the newborn. N Engl J Med 2000; 342: 469-74.
10. Albert J, Harbut P, Zielinski S, et al: Prolonged exposure to inhaled nitric oxide does not affect haemostasis in piglets. Intensive Care Med 2007; 33: 1594-601.
11. Shah PS, Ohlsson A: Sildenafil for pulmonary hypertension in neonates. Cochrane Database Syst Rev 2011; CD005494.
12. FDA Drug Safety Communication: FDA recommends against use of Revatio in children with pulmonary hypertension. http://www.fda.gov/Drugs/DrugSafety/ucm 317123.htm (Accessed on August 31, 2012).
13. Bassler D, Choong K, McNamara P, et al: Neonatal persistent pulmonary hypertension treated with milrinone: four case reports. Biol Neonate 2006; 89: 1-5.
14. Mohamed WA, Ismail M: A randomized, double-blind, placebo-controlled, prospective study of bosentan for the treatment of persistent pulmonary hypertension of the newborn. J Perinatol 2012; 32: 608-13.
15. Lazar DA, Cass DL, Olutoye OO, et al: The use of ECMO for persistent pulmonary hypertension of the newborn: a decade of experience. J Surg Res 2012; 177: 263-7.

