摘要
因重症進入加護病房的病人,通常都需要同時使用多種藥物。病人本身的危險因子、藥物動力學的改變、藥物交互作用都會增加腎毒性的發生。臨床人員應了解藥物劑量需依藥物動力學進行調整、隨時監測藥物療效及毒性、知道哪些藥物具腎毒性、能在早期察覺急性腎損傷的發生,才能有效降低或減少加護病房藥物引起腎毒性的風險。
關鍵字: 腎毒性、藥物動力學、加護病房
壹、前言
加護病房患者常因病情嚴重,需使用多種藥物。雖然多種藥物的使用對疾病的控制有益,但藥物不良反應也可能隨之產生,如急性腎損傷、肝毒性、神經功能障礙、心肺毒性等,其中以急性腎損傷最為常見。因此,加護病房的臨床人員需了解重症的病人在使用哪些藥物會造成腎臟的毒性,而且疾病本身也會改變藥物動力學,所以藥物劑量的使用應審慎,才能減少或避免副作用的發生。急性腎損傷一旦發生,會增加患者住院的時間、增加併發症的發生,甚至發展成慢性腎病變,嚴重到需要短期或長期洗腎。
貳、加護病房病人增加腎損傷的因子
因急性嚴重症狀進入加護病房的病人,通常都有潛在的慢性疾病 (表一),在醫療過程,病人常會因此引起多項併發症。併發症伴隨急性病症,同時也會增加急性腎臟損傷。
表一 加護病房病人常見的慢性病症

加護病房內造成藥物引起腎臟損傷的危險因子 (表二)1,2,其導致腎臟傷害的機制包括3:一、改變腎臟的血液動力平衡 (hemodynamics);二、改變藥物的動力學 (pharmacokinetics);三、直接誘發腎臟損傷。
表二 加護病房內造成藥物引起腎臟損傷的危險因子

參、加護病房病人藥物動力學的改變
加護病房病人的藥物動力學,不論是吸收、分佈、代謝或排泄都會受到病人的生理或疾病狀態影響 (表三)4。藥物動力學的改變常常是因為器官功能不全 (尤其是肝和腎)、病症的急性期反應、藥物的交互作用以及治療處置過程 (包括輸液補充、診斷流程和多種藥物的使用)5,6。
表三 加護病房病人的藥物動力學變化

肆、 加護病房病人因藥物引起腎毒性的類型
藥物本身的毒性、腎臟血液灌流異常、潛在的腎臟疾病以及藥物動力學改變都可能增加腎毒性的發生,常見的腎毒性類型如下7,8。
一、急性腎損傷
NSAIDs (nonsteroid anti-inflammatory drugs) 會抑制具血管舒張的 prostaglandin 生成,造成腎血管收縮及腎臟缺血。Renin-angiotensin-aldosterone 系統在體液減少時,會居中調節入球動脈收縮維持腎絲球微血管過濾所需之壓力,當促血管緊縮的 angiotensin 合成受到血管張力素轉化酶抑制劑 (angiotensin converting enzyme inhibitors, ACEIs) 的抑制或 angiotensin 的活性受到血管張力素受器阻斷劑 (angiotensin II receptor blockers, ARBs) 的阻斷,入球動脈將擴張,導致腎絲球過濾率下降,腎功能下降。高劑量的血管收縮劑和免疫抑制劑 calcineurin inhibitors 會增加內皮素 (endothelin) 及交感神經活性,導致血管收縮,增加入球動脈阻力,造成腎臟缺血損傷。一旦懷疑患者腎功能衰退有藥物引起的可能性存在,應停用可疑藥物,腎功能多半會逐漸恢復。
二、急性腎小管壞死
此類藥物造成腎毒性大多與劑量有關,例如:aminoglycosides、amphotericin B、cisplatin、顯影劑等。大量輸液的補充、適當劑量的調整及血中濃度的監測可以預防此類藥物造成的腎毒性。
三、滲透壓性腎炎
Mannitol 為高滲透性利尿劑,過快的滴速可能導致腎小管上皮細胞損傷,出現尿量減少,甚至急性腎功能衰竭。病理表現為腎小管上皮細胞腫脹,空泡形成。免疫球蛋白 (intravenous immune globulin, IVIG) 相關的腎損傷,絕大部分不是 IG (immune globulin) 引起的,而是作為 IVIG 製劑穩定劑的蔗糖引起的滲透性腎病。這類藥物可藉由放慢輸注速率,降低滲透壓差來減少腎損傷。
四、結晶沈澱
快速靜脈注射 (IV push) 高劑量的acyclovir 會造成腎小管內結晶沉積,若在腎實質組織內有嚴重的結晶沉積,經常導致腎臟間質腫脹與出血,進而阻礙腎臟間質間血流暢通,最後會使通過腎絲球間血流減少而讓腎絲球過濾速度下降。Triamterene、sulfonamides 與 methotrexate 都是弱酸,所以在酸性尿液的環境下會增加結晶沉澱的機會。化學治療後也可能因腫瘤溶解症候群 (tumor lysis syndrome) 導致尿酸或磷酸鈣的沈澱。通常來說,急性腎衰竭的病程是可逆的,大多數的病人在輸液治療與停藥後都能恢復腎功能,然而有些病人仍然需要暫時性的透析治療。
五、急性腎間質腎炎
沒有證據證明腎間質腎炎與藥物過敏有直接絕對的關聯。但 β-lactams、quinolones、sulfonamides、diuretics、anticonvulsants、anti-ulcer agents、allopurinol 等藥品皆曾有造成過敏性間質性腎炎的報告。
伍、加護病房病人藥物劑量的調整
加護病房病人的藥物動力學會有個別性的差異,所以在進行藥物處方時需審慎思考,藥物劑量的使用應以達到最佳的療效及最低的毒性為目標。圖一是藥物的速效劑量 (loading dose) 及維持劑量 (maintenance dose) 的簡易調整原則。速效劑量主要受分佈體積 (volume of distribution, Vd) 影響9,所以速效劑量的調整為標準的速效劑量x (病人的 Vd/正常的 Vd)。相對地,維持劑量主要受肝臟代謝和腎臟排泄影響,維持劑量的使用可依據腎功能肌酸酐清除率 (creatinine clearance, CrCl) 進行劑量或使用頻率的調整。維持劑量的劑量調整為標準劑量x (病人 CrCl/正常 CrCl),維持劑量的使用頻率調整為標準使用間隔x (正常 CrCl/病人 CrCl)。當然也可以同時調整劑量及使用頻率。若病人進行腎臟替代療法 (renal replacement therapy, RRT) 時,藥物劑量的調整需估計藥物因此療法可能被移除的劑量,同時要考量因腎臟替代轉換而改變的肝代謝10。臨床人員若能認識藥物的特性及急慢性病症對藥物動力學的影響,伴隨密切的病情監測,病人的藥物使用就能維持在安全的劑量範圍。個案分享,一敗血休克的患者為了拉高血壓會先灌流6公升的食鹽水,但病人有水腫、寡尿以及血清肌酸酐 (serum creatinine) 上昇的情形,而且病人因感染需使用抗生素藥物,藥物劑量的調整會是水溶性藥物的速效劑量增加因為 Vd 變大,然而維持劑量降低因為腎排泄減少或因肝代謝功能不全。
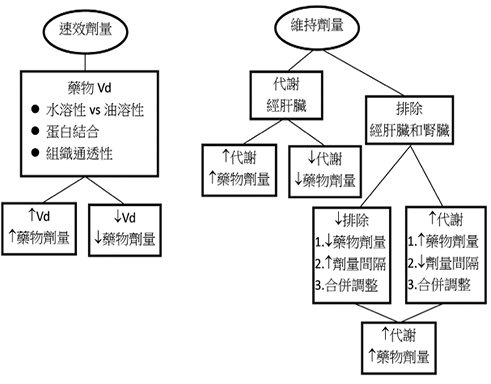
圖一 藥物的速效劑量及維持劑量的簡易調整原則
陸、結論
為了避免加護病房病人因藥物引起腎毒性,首要是要清楚病人潛在的危險因子,然後要避免高危險患者使用具有腎毒性的藥物,並且隨時監測病人腎功能,進行藥物劑量的調整,若懷疑腎毒性的發生與藥物有關,要暫停所有可能引起腎毒性的藥物。如此一來,才能降低或減少加護病房藥物引起腎毒性的風險。
Drug-Induced Nephrotoxicity in the Intensive Care Unit
Ching-Ying Liao
Department of Pharmacy, Taiwan Adventist Hospital
Abstract
Numerous medications are prescribed to seriously ill patients in the intensive care unit. Comorbid conditions, altered drug pharmacokinetics, and drug–drug interactions enhance the risk of nephrotoxicity. Hence, it is crucial that clinicians caring for these patients use appropriate drug dosing based on the knowledge of altered pharmacokinetics, vigilant monitoring of drug efficacy and toxicity, recognition of drugs with nephrotoxic potential, and early identification of drug-induced acute kidney injury when it develops.
參考資料:
1.Perazella MA: Drug use and nephrotoxicity in the intensive care unit. Kidney Int 2012;81:1172-8.
2. Naughton CA: Drug-Induced Nephrotoxicity. Am Fam Physician 2008;78:743-50.
3. Nolin TD, Himmelfarb J: Mechanisms of drug-induced nephrotoxicity. Adv Drug reactions 2010;196:111-30.
4. Boucher BA, Wood GC, Swanson JM: Pharmacokinetic changes in critical illness. Crit Care Clin 2006;22:255-71.
5. Vilay AM, Churchwell MD, Mueller BA: Drug metabolism and nonrenal clearance in acute kidney injury. Crit Care 2008;12:235-43.
6. Schmith VD, Foss JF: Inflammation: planning for a source of pharmacokinetic/pharmacodynamic variability in translational studies. Clin Pharmacol Ther 2010;87:488-91.
7. 蘇純慧、謝右文、高純琇等:臺灣藥物不良反應為腎毒性之案例分析。藥物安全簡訊2007;19:14-22.
8. Pannu N, Nadim MK: An overview of drug-induced acute kidney injury. Crit Care Med. 2008;36:S216-23.
9. Verbeeck RK, Musuamba FT: Pharmacokinetics and dosage adjustment in patients with renal dysfunction. Eur J Clin Pharmacol 2009;65:757-73.
10. Schetz M: Drug dosing in continuous renal replacement therapy: general rules. Curr Opin Crit Care 2007;13:645-51.

