摘要
原發性肺纖維化 (Idiopathic pulmonary fibrosis, IPF) 是間質性肺炎的一種,發生原因不明,發病過程屬慢性、漸進性。輕度時常造成患者乾咳、呼吸困難、中重度時會讓咳嗽加劇、體力衰弱、肺功能逐漸喪失。發生率和年齡成正相關,主要發生在50歲以上的老年人。早期認為是慢性發炎導致肺間質纖維化,在治療藥物選擇降低發炎反應及免疫調節劑,後來研究發現肺泡上皮細胞和纖維母細胞間質有功能異常現象,而且和活化細胞訊息傳遞有關,因此造成纖維細胞異常增生和組織重塑 (remodeling)。2014年10月15日 FDA 核准 nintedanib 上市,屬於新型治療原發性肺纖維化藥物,可以阻斷細胞內的訊號傳遞、抑制纖維母細胞的增生、轉移和改變,減少用力肺活量 (forced vital capacity, FVC) 的下降率,延緩疾病的進程,降低肺功能的惡化速率。
關鍵字: 原發性肺纖維化、nintedanib、idiopathic pulmonary fibrosis
壹、前言
美國胸腔學會 (American Thoracic Society, ATS)、歐洲呼吸學會 (European Respiratory Society, ERS) 和美國胸腔醫師學院 (American College of Chest Physicians, ACCP) 於2000年對原發性肺纖維化的診斷和治療提出共同聲明,並於2010年依據實證醫學的方法,提供臨床醫師具體的診斷和治療的建議。原發性肺纖維化的發生原因不明、診斷不易,發病過程屬慢性、漸進性肺功能惡化,主要發生在50歲以上老年人,臨床症狀為不明原因的乾咳、呼吸困難、有囉音、杵狀指、男性多於女性,且多數患者有吸菸史。診斷時須排除已知原因的間質性肺病,例如工作環境毒性、藥物毒性、結締組織疾病。在高解析度電腦斷層 (high-resolution computed tomography, HRCT) 影像呈現纖維化,若進行肺臟病理切片,更能確證纖維化程度1。流行病學方面,依據美國大型醫療賠償資料庫健康者計畫研究估計,原發性肺纖維化的罹病率每10萬人中約14-42.7人,年發病率為每10萬人中約6.8-16.3人2,在英國則是每10萬人中約7.4人,且有逐年上升的趨勢3。
貳、致病機轉4
到目前為止,對原發性肺纖維化的病理機轉尚未完全瞭解,有證據顯示,肺泡上皮細胞不正常的發展途徑和外觀的改變在原發性肺纖維化扮演重要的角色。纖維化是不正常的肺泡上皮細胞活化,產生介質,在間質細胞藉由纖維母細胞及肌纖維母細胞異常增生,刺激間質細胞改變。纖維母細胞及肌纖維母細胞分泌過多的細胞外基質,主要是膠原,造成肺部結構遭到破壞產生疤痕,形成纖維化。
參、Nintedanib 藥品5,6
一、化學性質和結構式 (圖一)
Nintedanib (OFEV),成分 nintedanib esylate 亮黃色粉末,化學式 C31H33N5O4•C2H6O3S,分子量649.76 g/mol,有100 mg 和150 mg 兩種劑量可供選擇服用。
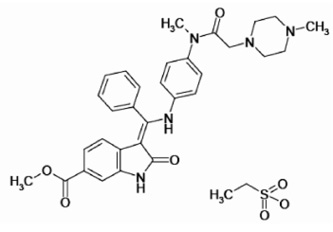
圖一 Nintedanib 結構式
二、作用機轉
Nintedanib 是屬於一種小分子,可以抑制多種酪胺酸激酶接受體 (receptor tyrosine kinase, RTKs) 和非酪胺酸激酶接受體 (nRTKs),它抑制的 RTKs 包含血小板衍生性生長因子接受體α和β (platelet-derived growth factor receptorα和β, PDGFRα、PDGFRβ),纖維母細胞生長因子接受體1-3 (fibroblast growth factor receptor 1-3, FGFR1、FGFR2、FGFR3),血管內皮生長因子接受體1-3 (vascular endothelial growth factor receptor 1-3, VEGFR1、VEGFR2、VEGFR3) 和類 Fms 酪胺酸激酶-3 (Fms-like tyrosine kinase-3, FLT3)。其中,FGFR、PDGFR、VEGFR 和原發性肺纖維化的發病機制有關。Nintedanib 會競爭性的和三磷酸腺苷 (adenosine triphosphate, ATP) 結合位的接受體結合,並且阻斷細胞內的訊號傳遞、纖維母細胞的增生、轉移和改變,這些是原發性肺纖維化病理機制的基本表現。另外,nintedanib 抑制的 nRTKs 包含:Lck、Lyn、Src 激酶。目前仍不清楚抑制 FLT3和 nRTK 是否對原發性肺纖維化有幫助。
三、劑量與藥物動力學
Nintedanib 的建議口服劑量為150 mg 每天兩次,間隔約12小時,服用時搭配食物和足量的水,整粒吞服,每天最大劑量為300 mg。服用後發生不良反應,可以將劑量調降為100 mg 每天兩次或停用。此藥口服後,約2-4小時達到最高血中濃度,連續服用一星期可達穩定血中濃度,在健康志願者,口服100 mg 的絕對身體可用率為4.7%,食物會延遲吸收,並增加20%的藥物曝露量。97.8%會與血漿白蛋白結合,經由肝臟酯酶水解,CYP 和 UGT 酵素進行代謝,中重度肝功能不全者 (Child-Pugh class B和C) 不建議服用此藥。正常肝功能者,服用 nintedanib 150 mg 每天兩次後,若 AST 或 ALT 比正常值升高3倍至5倍,調整劑量至100 mg 每天兩次或停藥,待數值回復正常,停藥者重新給予100 mg 每天兩次,並視情況將劑量調高至150 mg 每天兩次。若患者無法耐受則停藥;AST 或 ALT 比正常值升高5倍或升高3倍伴隨嚴重肝損傷者,須停藥。Nintedanib 主要經由糞便和膽汁排除 (93.4%),經腎臟排除量很低 (0.65%),從體內排除90%以上,約需4天。輕度到中度腎功能不全者 (CrCl ≥ 30 mL/min),不需調整劑量,重度腎功能不全者 (CrCl < 30 mL/min),目前無相關臨床研究報告。
四、副作用
最常見的副作用:腹瀉 (62%)、噁心 (24%) 、腹痛 (15%)、肝指數上升 (14%)、嘔吐 (12%)、食慾降低 (11%)、體重減輕 (10%)、頭痛 (8%)、高血壓 (5%)。嚴重不良反應包括:支氣管炎 (1.2%) 和心肌梗塞 (1.5%)。曾經導致死亡的不良反應:肺炎 (0.7%)、肺惡性腫瘤 (0.3%)、心肌梗塞 (0.3%)。
五、交互作用
(一)與P-醣蛋白和 CYP3A4抑制劑併用,例如:ketoconazole、erythromycin 會增加 nintedanib 的曝露量,其中 ketoconazole 會增加60%,對於合併使用發生副作用,建議調降 nintedanib 劑量或停藥。
(二)與P-醣蛋白和 CYP3A4誘導劑併用,例如:rifampicin 會減少 nintedanib 曲線下面積達50.3%及最高血中濃度達60.3%。而 carbamazepine、phenytoin、聖約翰草 (St. John's wort) 則避免合併使用。
(三)Nintedanib 是 VEGFR 抑制劑,併用抗凝血劑,可能會增加出血的風險,請監測是否有出血傾向,必要時請調整劑量。
肆、臨床研究
目前在新英格蘭醫學期刊 (New England of Medicine, NEJM) 有一個第二期和兩個第三期臨床試驗發表,以下介紹這三個試驗之設計、主要結果及其相關性。
一、TOMORROW 試驗7
為期12個月,收錄432位 (最終完成試驗423位),隨機、雙盲、安慰劑對照組第二期臨床試驗,在全球25個國家,92個地點進行口服 BIBF 1120 四種劑量之安全性和有效性比較,召募對象為40歲以上、五年內確診為原發性肺纖維化的患者、近一年內做過胸部 HRCT 確診,隨機分配為五組:1.安慰劑,2. BIBF 1120 50 mg 每天一次,3. BIBF 1120 50 mg 每天兩次,4. BIBF 1120 100 mg 每天兩次,5. BIBF 1120 150 mg 每天兩次。
(一)主要終點指標為用力肺活量 (FVC) 的年平均下降率,結果在 BIBF 1120 150 mg 每天兩次試驗組與安慰劑組對照比較,BIBF 1120 150 mg 每天兩次試驗組每年下降了0.06公升 (95% CI, -0.14到0.02),安慰劑組則下降了0.19公升 (95% CI, -0.26到-0.12) (圖二)。
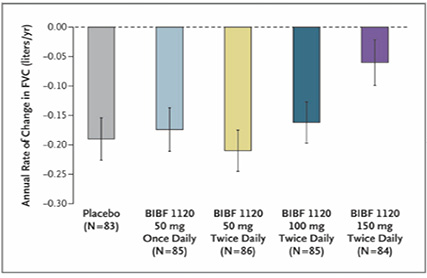
圖二 TOMORROW 試驗
(二)次要終點指標包含:急性發作、聖喬治呼吸問卷 (St. Georges Respiratory Questionnare, SGRQ) 評量生活品質和肺活量。急性發作定義:原發性肺纖維化不明原因惡化、或在30天內進展為呼吸困難、胸部X光呈現新瀰漫性肺浸潤、和/或 HRCT 發現實質異常、無氣胸或胸腔積液症狀、排除急性感染、左心衰竭、肺栓塞、急性肺損傷等。BIBF 1120 150 mg 每天兩次試驗組與安慰劑組在急性發作對照比較,BIBF 1120 150 mg 每天兩次試驗組平均每年每100人急性發作2.4次,安慰劑組則是15.7次 (P = 0.02)。聖喬治呼吸問卷分數有些微下降,代表生活品質提高。
副作用在 BIBF 1120 150 mg 每天兩次試驗組,比起安慰劑組,在腸胃道症狀中斷給藥機率較高,在肝指數升高機率也較高。
二、 INPULSIS 試驗:INPULSIS-1和 INPULSIS-28
延續 TOMORROW 試驗的結果設計 INPULSIS 試驗,以相同的設計做重複的兩個試驗,為期52週,隨機、雙盲、安慰劑對照組第三期臨床試驗,評估 nintedanib 150 mg 每天兩次的有效性及安全性,共收錄1066位,依 nintedanib 與安慰劑為3比2比例隨機分配,INPULSIS-1試驗 515位 (最終完成試驗513位),INPULSIS-2試驗 551位 (最終完成試驗548位),各分為兩組:nintedanib 150 mg 每天兩次試驗組和安慰劑。
(一)主要終點指標為用力肺活量 (FVC) 的年平均下降率,結果與 TOMORROW 試驗一致,INPULSIS-1試驗:nintedanib 組每年下降114.7毫升,安慰劑組則下降239.9毫升 (差異125.3毫升;95% CI, 77.7到172.8;P < 0.001) (圖三)。INPULSIS-2試驗:nintedanib 組每年下降113.6毫升,安慰劑組則下降207.3毫升 (差異93.7毫升;95% CI, 44.8到142.7;P < 0.001) (圖四)。
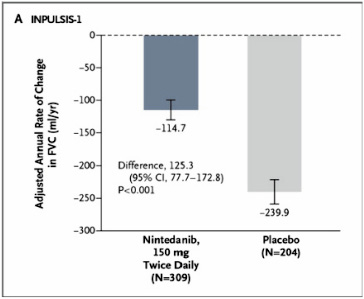
圖三 INPULSIS-1試驗
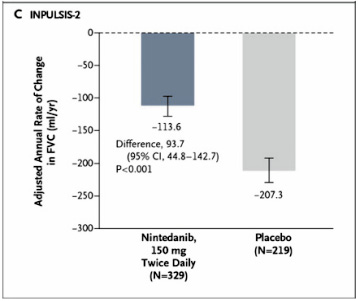
圖四 INPULSIS-2試驗
(二)關鍵次要終點指標:至第一次急性發作的時間及聖喬治呼吸問卷。1.至第一次急性發作的時間:在 INPULSIS-1試驗 nintedanib 組與安慰劑組並無明顯差異,(nintedanib 風險比1.15,95% CI,0.54到2.42,P = 0.67);在 INPULSIS-2試驗 nintedanib 則有明顯增加至第一次急性發作的時間 (風險比0.38,95% CI ,0.19到0.77;P = 0.005);2.聖喬治呼吸問卷分數在 INPULSIS-1試驗兩組並無差異,在 INPULSIS-2試驗 nintedanib 組則有些為下降。
在兩個試驗中最常見的副作用是腹瀉,在 INPULSIS-1試驗:nintedanib 組發生率61.5%,安慰劑組18.6%,在 INPULSIS-2試驗:nintedanib 組發生率 63.2%,安慰劑組18.3%,兩個試驗造成試驗中斷機率小於5% (INPULSIS-1試驗4.5%,INPULSIS-2試驗4.3%),嚴重副作用為缺血性心臟病,兩組相似,但在心肌梗塞部分,nintedanib 組有較高比率。
伍、結論
原發性肺纖維化屬於致死性疾病,nintedanib 於2014年10月15 日FDA核准上市,屬於新型治療原發性肺纖維化藥物,雖然無法治癒、提升病人存活率,但臨床試驗結果證實 nintedanib 可以減少 FVC 的下降率,延緩疾病的進程,有效降低肺功能惡化速率,提高病人生活品質。目前在台灣 nintedanib 尚未核准上市,希望未來提供原發性肺纖維化病人另一項治療藥物的選擇。
Nintedanib Treating Idiopathic Pulmonary Fibrosis
Yu-Chin Liu1, Chiu-Jen Wu2
Department of Pharmacy, Miao-Li General Hospital, Department of Health1
Department of Pharmacy, College of Pharmacy & Health Care, Tajen University2
Abstract
Idiopathic pulmonary fibrosis is a specific form of chronic, progressive, fibrosing interstitial pneumonia of unknown causes, occurring in adults. In the past, treatment was aimed for anti-inflammation and immune modulation. Current evidence indicates that it arises from an aberrant proliferation of fibroblasts and tissue remodeling due to the abnormal function and signaling of alveolar epithelial cells and interstitial fibroblasts. Since October 15, 2014 FDA approved nintedanib, it is a new type of drug for treatment of idiopathic pulmonary fibrosis. It can blocks the intracellular signaling which is crucial for the proliferation, migration, and transformation of fibroblasts. Nintedanib significantly reducing the annual rate of FVC decline, delaying progression of the disease and reducing the rate of deterioration of lung function.
參考資料:
1.Raghu G, Collard HR, Egan JJ, et al: An official ATS/ERS/JRS/ALAT statement: idiopathic pulmonary fibrosis: evidence-based guidelines for diagnosis and management. Am J Respir Crit Care Med. 2011;183(6):788-824.
2. Raghu G, Weycker D, Edelsberg J, Bradford WZ, Oster G. Incidence and prevalence of idiopathic pulmonary fibrosis. Am J Respir Crit Care Med 2006;174:810e6.
3. Navaratnam V, Fleming KM, West J, Smith CJ, Jenkins RG, Fogarty A, et al: The rising incidence of pulmonary fibrosis in the UK. Thorax 2011;66:462e7.
4. King TE Jr, Pardo A, Selman M. Idiopathic pulmonary fibrosis. Lancet 2011;378:1949-1961.
5. Nintedanib: Detail evidence–based information (DRUGDEX ®). Available at : http://www.micromedexsolutions.com/micromedex2/librarian/
6. Ofev(nintedanib)[ Prescribing Information]. Ridgefield, CT: Boehringer Ingelheim Pharmaceuticals, Inc; October 2014
7. Richeldi L, Costabel U, Selman M, et al: Efficacy of A Tyrosine Kinase Inhibitor in Idiopathic Pulmonary Fibrosis. N Engl J Med. 2011;365(12):1079-1087.
8. Richeldi L, du Bois RM, Raghu G, et al: Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N Engl J Med. 2014;370(22):2071-2082.

