摘要
看不見的危險最危險,如何建構預防風險的環境,落實人本照護的核心價值,是一個需要被關心的公共政策議題。我國藥政一國兩制,以兩套不同體系管理藥品的現況包括 (1) 兩套藥品許可證核證體系、(2) 兩套臨床試驗標準、(3) 兩套 GMP、(4) 兩套不良反應通報體系、還有 (5) 政府擬提的兩套藥師制度,正是製造人民身體體系風險 (造病) 與社會體系風險 (藥物流行病學) 的源頭。
本文從「人吃藥」的科學及倫理概念闡述 (1) 身體只有一個,不會分中藥/西藥/食品(含健康食品),切割式的藥食科學不科學,在身體會造病;(2) 臨床藥學是詮釋藥與身體的夥伴關係,不懂得讀身體的人沒有能力詮釋藥學。進而闡述 (1) 物本的藥政管理應轉型到人本的風險管理以及預防風險的環境建構;(2) 建構安全藥食環境的責任在政府;(3) 維繫藥品交易及藥事服務的程序正義,才能保障人權。最後以體系管理及環境建構為軸,針對已呈現的體系風險,提出解決之道:(1) 翻轉藥政一國兩制的亂源:藥事法第103條;(2) 翻轉一國兩制的施政,中藥如果是藥,就併入食品藥物管理署統一管理;(3) 中藥調劑應屬正規臨床藥學藥師養成教育中的內加專業 (add-on professional training along uni-track clinical pharmacy education);(4) 藥師只有一種,反對政府設置「中藥師」,用兩種藥師製造消費者身體1+1>2的未知風險。
關鍵字: 藥政一國兩制、兩套藥品許可證、兩套藥品不良反應通報體系、兩套藥師制度、bilateral regulatory systems、pharmacovigilance planning
壹、前言
2015年6月15日衛福部中醫藥司開會研商建立「中藥師」制度,本人代表學界出席,驚覺茲事體大,提出以下看法。
這兩年「人吃東西」的風險像海嘯一般襲捲台灣,檯面上吵到足可翻覆一個政權,未上檯面的不表示沒有問題。未爆彈還有中藥/西藥切割管理、多重用藥及過度用藥 (包括健康食品) 可能潛藏的問題。就藥品來說,藥事法第103條促成中藥、西藥一國兩制的藥政管理,包括兩套藥品許可證核證體系、兩套臨床試驗標準、兩套 GMP、兩套不良反應通報體系、還有現在擬提的兩套藥師制度,正是製造藥食風險的源頭1-6。
貳、一國兩制的藥政管理
1995年藥事法第103條修法,促成衛生署中醫藥委員會的成立,開啟中藥/西藥分流,用兩套藥政管理體系照顧人民的身體。分流管理呈現的現狀包括:(1) 西藥實施 GMP,藥廠從500家淘汰到現在的100家,藥品從1995年的21,870項淘汰到2006年的5,620項,例如最近許多藥品下架,就是實施原料 GMP 過程中掃蕩劣幣的必然措施,使得西藥許可證數量持續下降;(2) 中藥有不同的 GMP,到現在還說不清楚重金屬/不純物限量標準,許可證卻從1995年的7,057張增加到2006年的11,107張 (表一),其中中藥處方藥許可證十年間成長一倍,處方藥潛藏的風險值得關注;(3) 西藥、中藥兩套不良反應通報體系,病人吃西藥出問題找食品藥物管理署,吃中藥出問題找中醫藥司,至於中藥加西藥一起吃,在身體交互作用吃出問題,就自求多福;(4) 吃西藥出了問題有藥害基金救濟,吃中藥出了問題就自力救濟;(5) 藥害救濟補償正當使用西藥產生的不可預期藥害,中藥併用西藥的交互作用如果屬於已知的風險,一旦在身體吃出問題,非屬正當使用西藥產生的藥害,在法律上不符合藥害救濟。
表一 藥品許可證統計
|
西藥 |
西藥成藥 |
中藥 |
中藥成藥 |
1969-1995 |
14,718 |
7,152 |
2,394 |
4,663 |
1969-1995合計 |
21,870 |
7,057 |
||
1996-2006 |
4,235 |
1,385 |
4,663 |
6,444 |
1996-2006合計 |
5,620 |
11,107 |
||
雙軌式的藥品管理,對產業及人民造成極為複雜的影響,其中潛藏的風險,從藥物流行病學的報告可以得到答案,其中反應的是政府違反科學與違背人本的施政7。2005年行政院規畫部會改組,是讓西藥中藥管理合流的契機。筆者時任衛生署藥政處長,負責草擬衛生福利部食品藥物管理署組織法,將所有食品、藥品、管制藥品、醫材與化粧品業務納歸食品藥物管理署管理 (意即「五合一」組織改造)。然而,2009年食品藥物管理署成立時,組織法第一條明示掌理所有食品、藥物與化粧品,卻不包括中藥 (四合一組織改造)。以此邏輯推演,在中華民國政府的定義中,中藥顯然不是藥8。
參、中藥西藥理論殊途同歸
其實,中醫西醫的用藥思維及理論殊途同歸9。中醫「辯證論治」是用藥之前先掌握身體運勢,對生命體系做評估,才能讓外來物在體內有最優的行為表現。中醫掌握外來物與身體的夥伴關係的理論與現代醫學裡藥物動力學的理論不謀而合 (圖一)10。
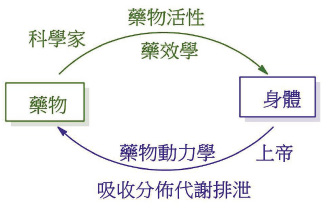
圖一 安全用藥取決於藥物動力學與藥效學的整合評估
再者,老祖宗的「藥食同源」用現代語言來說,是身體不會分中藥/西藥/食品。藥食來源千百種,各有專精理論,對身體來說,吃到肚子裡都一樣,都是外來物。外來物的有效成分 (active pharmaceutical ingredient,API,原料或藥材) 好比灰姑娘,未經過化學或藥劑學的優化,難以成為公主 (finish product,圖二)。
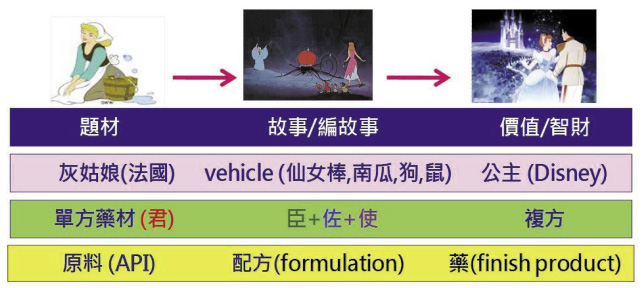
圖二 藥的美學示意圖 (外來物與身體的夥伴關係):原料或藥材成為藥品的優化過程顯示中藥西藥理論殊途同歸
中藥、西藥都是外來物 (API),都需要經過增效減毒的優化過程,在中藥稱為「君臣佐使」複方,在西藥稱為配方 (formulation),配方也是複方。優化的目的在於讓外來物的行為表現與身體達到最好的夥伴關係 (formulation for pharmacokinetic and phamacodynamic optimization),優化過程隱含著去蕪存菁千分之一的成功率,創新的精髓 (know-how) 則隱含著百億美金以上的投資及智慧財產價值。也就是說,原料或藥材都只是原料,原料不分來源只問結果,是否能成為藥?評估準則唯品質、安全及療效是問 (risk benefit assessment)。這是維繫藥品科學品質的普世價值及共同認知 (pharmacovigilance plan and risk minimization plan, PVP/RMP,圖三)11,12。
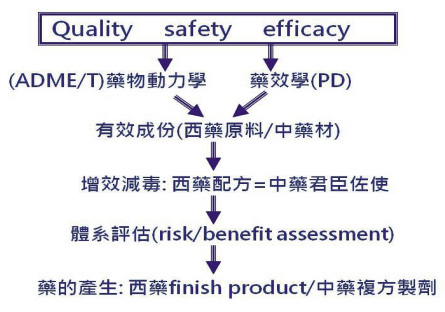
圖三 藥品產生的過程取決於品質、安全及療效的整合評估
肆、切割的科學不科學
二十一世紀的台灣,「藥食同源」變成了中藥/西藥/食品切割,各行其是。由於高等教育缺少整合式的思維訓練,「藥學是詮釋外來物與身體夥伴關係的科學」在台灣從來不被重視,致生命科學領域的畢業生只有「藥分為中藥/西藥」的物本認知,進入政府體系後,在科員政治的格局裡缺少尊重生命的思維,只會自掃門前雪。於是,在藥事法103條加持下,主管單位順理成章建立兩套中藥/西藥法令規章,也就不令人奇怪了 (圖四)。
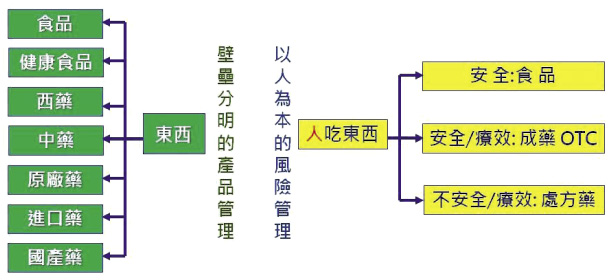
圖四 物本的產品管理 (綠色) 無法讓台灣成為進步社會 (黃色,人本的風險管理)
在科員政治的管理格局下,「人吃東西」如此簡單的概念中,主詞「人」不見了,「怎麼吃」不重要了,受詞「東西」最大,成為主詞,讓藥食生態在台灣變得極其複雜,以我國衛生體系的 GMP (Good Manufacturing Practice) 為經典:藥政處管轄的藥品 GMP 是體系管理,食品處管轄的食品 GMP 則是產品認證,中醫藥委員會 (現在的中藥司) 則有另一套不同標準的中藥 GMP13。
這幾年食安風暴已帶給國人極大警訊,國人尚未警覺的則是另外一個藥品管理潛藏的問題。政府棄「藥食同源」的風險思維如蔽履,在藥事法第103條立法之後,又任由中藥/西藥產業各憑本事,用人民的身體拼經濟。可見的例子包括:廠商西藥許可證不好申請,就改申請中藥許可證;廠商以研發中之標的新藥通過臨床試驗許可 (IND) 為訴求而申請上櫃,上櫃後就以健康食品上市;以8%酒精浸泡中藥材的藥酒 (保力達、維士比) 是限藥局販賣的醫師藥師指示藥,由食品藥物管理署發證,而以28%酒精浸泡的藥酒則是中醫藥司核准發證的成藥,超商就可販售14。
我們必須指出,切割式管理正以現在進行式在製造經常性的風險,身體體系的風險是造病,社會體系的風險是肝病、洗腎等藥物流行病學,讓國人活在造病的風險中而不自知15。民以食為天,違背人本的施政嚴重到足以動搖國本,政府能不汗顏16,17?
伍、兩套藥師制度違背人權
唯物的、切割的科學是藥食不安全的影武者,這樣的社會走向令人不安。在藥師是服務人而非服務產品的前提下,藥學教育以培養懂得讀身體的藥師為目標,而不是培養服務藥品的藥劑師 (patient care rather than pharmaceutical care)。懂得讀身體的藥師為人民做用藥的風險把關,就益形重要18-20。
中藥調劑應是藥師養成教育中的內加專業 (add-on professional training along uni-track clinical pharmacy eduction),當下衛生福利部擬提案設置「中藥師」,用兩套制度讓中藥、西藥藥師分流,管理消費者的身體。兩套體系不僅扭曲臨床藥學的核心價值:人的照護,還潛藏著隱憂,製造消費者身體1+1>2的未知風險。分流制度陷人民於複雜且未知的用藥風險中,是違背人權的施政21-23。
陸、藥政管理的演進趨勢
看不見的危險最危險,如何建構安全用藥的環境,是先進國家人本照護的核心價值。國際藥事法規協合平台 (International Conference of Harmonization, ICH) 早已提出指引,從物本的管理轉型到人本的風險管理,再到預防風險的環境管理 (conceptual change from pharmacovigilance to pharmacovigilance planning)。從 ICH 用藥安全到建構用藥安全環境的演進史,可以看到先進國家的施政具有憂於未形恐於未熾 (宋朝范文正公靈烏賦) 的思想與視野。只談用藥安全,不談預防風險的環境建構,台灣離進步國家還很遠 (圖五)24-27。
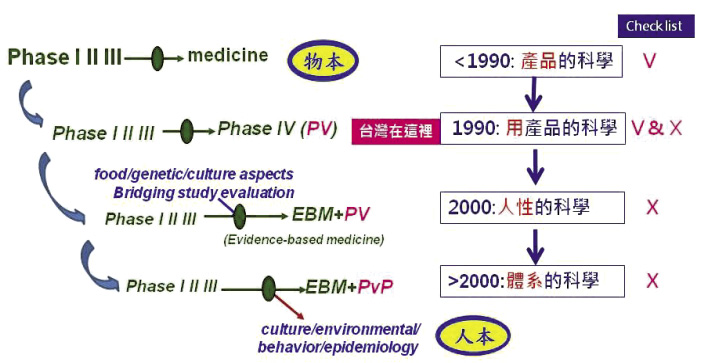
圖五 ICH 從產品經濟到知識經濟的用藥思維演進: 從用藥安全到用藥安全環境建構
筆者要向消費者說的是 (1) 身體只有一個,不會分中藥/西藥;(2) 切割式的藥食科學不科學,在身體會造病;(3) 不要相信西藥有毒/中藥安全這回事,藥就是毒,用藥要依賴藥師;(4) 不懂得讀身體的人沒有資格照顧我的身體,要相信正規臨床藥學教育才能產生懂得讀身體的藥師;(5)「人吃東西」這件事應從產品管理轉型到人本的風險管理以及預防風險的環境管理28-30。
維繫程序正義,建構以人為本的安全藥食環境的責任在政府 (圖六)。台灣的施政者本應看到環境管理預防風險是現代化國家藥食管理的主流趨勢,卻還停留在中藥/西藥各行其是的物本的、切割式的對立中。藥政一國兩制可能是讓藥食 (健康食品) 風險形已成,熾未滅的源頭,我們必需指出,這一切源於藥事法第103條。
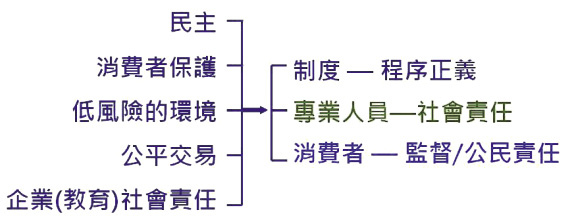
圖六 政府有維繫程序正義,建立低風險社會的責任
柒、結論
藥是知識經濟產品,但知識看不見,而看不見的危險最危險。藥品不只是科學的議題,更是風險管理與環境建構預防風險的議題。不合理的制度陷人民生命於用藥的環境風險,還有制度造成產業用人民身體拼經濟,則是人權議題。台灣如要走向人本的社會,已到了該被檢驗的時候。我們期待政府以蒼生為念,讓藥物管理走向一元化,台灣才有程序正義。
人民有免於恐懼的自由,建立低風險社會,人民也有責任。親愛的同胞,為了自己的身體站出來,(1) 翻轉藥政管理的亂源,廢除藥事法第103條;(2) 翻轉一國兩制的施政,中藥如果是藥,就該併入食品藥物管理署統一管理;(3) 藥師只有一種,「中藥師」制度造成兩種藥師,兩套管理制度會撕裂及戕害我的身體。政府不可一錯再錯,做對不起人民的事。
Risk Analysis on the Bilateral Regulatory Systems of Taiwan Pharmaceutical Administration
Hui-Po Wang
College of Pharmacy, Taipei Medical University
Abstract
As declared by the International Conference of Harmonization, proactive risk management on pharmacovigilance planning and risk minimization planning (PVP/RMP) is now a global trend for system building of safe medication. PVP/RMP is especially important in societies like Taiwan where irrational medication is ridiculously practiced. This article analyzes factors that undermine the medication risk in Taiwan from aspects of the bilateral regulatory systems of governmental pharmaceutical administration. There are two regulatory bodies in regulating drug affairs, Taiwan Food and Drug Administration in charge of western medicine and the Department of Chinese Medicine and Pharmacy in charge of traditional Chinese medicine (TCM). There are bilateral drug approval panels, two different GMP systems and bilateral adverse drug event reporting systems. The bilateral regulatory and administrative systems might lead to irrational medication undetectable and render standard tools for pharmacovigilance monitoring inapplicable. As a considerable large portion of patients in Taiwan under drug treatment tend to take TCM without notification to professionals, a due process of risk benefit assessment of medication is thus important in order to eliminate safety threats from irrational drug-TCM co-medication. The bilateral regulatory systems that are considered non-ethical from PVP/RMP point of view need to be seriously reviewed and reformed.
參考資料:
1.Chung VC, Lau CH, Yeoh EK & Griffiths SM: Age, chronic non-communicable disease and choice of traditional Chinese and western medicine outpatient services in a Chinese population. BMC Health Serv Res 2009; 9: 207.
2. Tarirai C, Viljoen AM & Hamman JH : Herb-drug pharmacokinetic interactions reviewed. Expert Opin. Drug Metab Toxicol 2010 ; 6 (No.12): 1515-1538.
3. Kindla J, Fromm MF & König J: In vitro evidence for the role of OATP and OCT uptake transporters in drug-drug interactions Expert Opin Drug Metab Toxicol 2009; 5 (No.5): 489-500.
4. Tirona RG & Bailey DG: Herbal product-drug interactions mediated by induction. Br J Clin Pharmacol 2006: 61 (No.6): 677-681.
5. Wojcikowski K, Johnson DW & Gobe G: Medicinal herbal extracts - Renal friend or foe? part one: The toxicities of medicinal herbs. Nephrology 2004; 9 (No.5): 313–318.
6. Zhou SF, Xue CC, Yu XQ & Wang G: Metabolic activation of herbal and dietary constituents and its clinical and toxicological implications: An update. Curr Drug Metab 2007; 8 (No.6): 526-553.
7. 王惠珀:由人本出發做對的決策,藥政簡史:pp 278-284.行政院衛生署食品藥物管理局編印, 2012.
8. 中華民國行政院衛生福利部食品藥物管理署組織法,中華民國102年6月19日公布.
9. 王惠珀:身體只有一個,藥檢局慶特刊 2009.
10. Wang HP, Wang CL, Yu WN, Huang YW, Lin YL, Leu YL & Lee CY: From pharmacovigilance to pharmacovigilance planning - The system building for safe medication, J Food Drug Anal 2007; 15: 377-86.
11. 王惠珀:GMP之後,衛生署實施GMP 二十五年專刊 2007.
12. Guidance on format of the risk-management plan in the European Union, Risk-management plans, European Medicines Agency, first published 2012. 08.11. http://www.ema.europa.eu/ema/index.jsp?curl=pages/regulation/document_listing/document_listing_000360.jsp
13. 王惠珀:生命科學的不科學性,中國時報2008.07.08.
14. 王惠珀:中藥療效與安全性,科學月刊 2004.03.06.
15. Wang TC, Huang LJ, Liang YS, Wang HP: Pharmaoepidemiology of Habitual Medicated Liquor Drinking in Taiwan. J Food Drug Anal 2015: in press.
16. Chiang HM, Fang SH, Wen KC, Hsiu SL,Tsai SY, Hou YC, Chi YC & Chao PD: Life-threatening interaction between the root extract of Pueraria lobata and methotrexate in rats. Toxicol Appl Pharmacol 2005; 209 (No.3):263-268.
17. 王惠珀:一口中藥一口西藥腎臟受不了,聯合報2003.07.29.
18. Cockayne NL, Duguid M & Shenfield GM: Health professionals rarely record history of complementary and alternative medicines. Br J Clin Pharmacol 2005; 59 (No.2): 254-258.
19. Sim SN & Levine MAH: An evaluation of pharmacist and health food store retailer's knowledge regarding potentional drug interactions associated with St. John's wort. Can J Clin Pharmacol 2010; 17 (No.1): E57-E63.
20. 何藴芳、王四切、王惠珀:台灣藥事服務的環境分析,藥學雜誌 2013; 29(1): 8-17.
21. 王惠珀,科技與人文對話是藥師的生活美學,藥學雜誌2014;30 (1): 7-11.
22. 王惠珀:科學與人文對話之旅,朱子文化2012;第一期:19-20.
23. 王惠珀:藥師分中西,中西藥一起吃找誰,聯合報2015.06.17.
24. Tsintis P and La Mache E: CIOMS and ICH initiatives in pharmacovigilance and risk management: overview and implications. Drug Saf 2004; 27(8): 509-17.
25. 王惠珀:優質用藥的環境建構(PVP) - 談藥物知識經濟的風險管理,王民寧基金會/中國藥學會-兩岸交流研討會2006.09,廣州/上海/北京.
26. 王惠珀:從用藥安全到用藥安全環境建構,藥學雜誌2011; 27(1): 2-9.
27. Hartford CG, Petchel KS, Mickail H, PerezGutthann S, McHale M, Grana JM & Marquez P: Pharmacovigilance during the pre-approval phases: An evolving pharmaceutical industry model in response to ICH E2E, CIOMS VI, FDA and EMEA/CHMP risk-management guidelines. Drug Saf 2006; 29 (No.8): 657-673.
28. 王惠珀、林淑梅、陳瓊雪、洪永泰:社區價值—防疫的後勤思考,pp197-205,疾病與社會,蔡甫昌、江宜樺主編,台大醫學院出版,2012.
29. Wang HP, System building for safe medication, Risk Management Trends, Giancarlo ed. pp189-202, ISBN978-953-307-314-9, InTech Open Access Publ Co. Brussel, EU, 2011.
30. 王惠珀、陳瓊雪、林淑梅、洪永泰、民主化之後的台灣社會,啟蒙‧狂飆‧反思-保釣運動四十年,謝小岑主編,清華大學出版,2010。
31. 王惠珀:用藥一國兩制後患無窮,中國時報 2009.01.09.

