摘要
中華民國行銷暨管理協會 (Taiwan Pharmaceutical Marketing & Management Association;TPMMA) 推動醫藥行銷師認證歷經二十年,其目的為提升藥品行銷人員素質,增進整體醫療品質,保障國人身體健康,並期望藉由 MR 認證制度的推展,樹立完善的醫藥行銷倫理,建立世界水準的醫藥行銷體制,提升國家形象與競爭力。
做對的事,做對國家社會有利的事,需要立法諸公、政府、衛生福利部及醫藥業界大家支持,包括修訂藥事法第33條、懇請衛生福利部補助基礎教育訓練費用或協助爭取勞動力發展署基礎教育訓練費用補助、醫藥業界認同有共識、積極行動、共同推動 MR 認證制度。
關鍵字:醫療供應鏈、醫藥行銷師、MR、用藥安全、藥事法第33條
壹、 醫藥行銷師在醫療供應鏈扮演的角色
醫療包含診斷與治療,治療有百分之八十需依賴藥物,隨著科技的進步,醫療方式日新月異,新的疾病不斷地被發現,新的治療技術與藥物也不斷地被研發。與藥物治療相關的流程,除了研究開發,製造與臨床應用,藥物資訊的傳遞管道也非常重要,這個醫療供應鏈 (圖一) 傳遞的流程需要一位非常重要的角色即醫藥行銷師 (Medical Representative;MR),透過醫藥行銷師的說明,將藥物相關資訊正確地傳遞給醫護人員,達到疾病正確診治、病人用藥安全的目的。
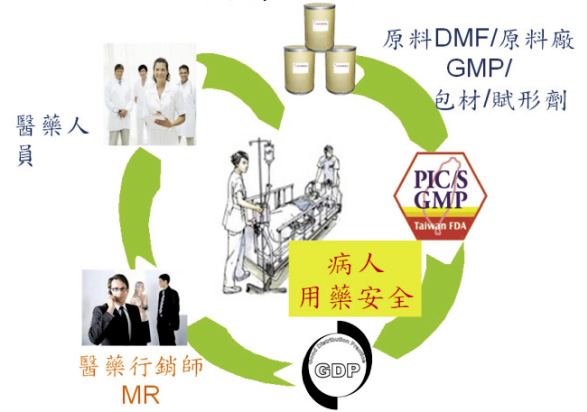
圖一 醫療供應鏈
貳、醫藥行銷師認證制度
世界醫療先進國家,對醫藥專業行銷人員都設定基本之認證要求,他們認定醫藥專業行銷人員的工作乃是整體醫療至為重要的一個環節,要求從事藥物行銷工作者需具備相關之專業知識與行銷倫理觀念,由於他們對每一環節的重視,才得以維持高水準的醫療,病患生命可以得到更大的保障。
台灣醫藥行銷師認證制度於1995年由中華民國藥品行銷暨管理協會之傑出藥品專業經理聯誼會所推動,其目的為提升藥品行銷人員素質,增進整體醫療品質,保障國人身體健康,並期望藉由 MR 認證制度的推展,樹立完善的醫藥行銷倫理,建立世界水準的醫藥行銷體制,提升國家形象與競爭力。
我國食品藥物管理署 (Taiwan Food and Drug Administration;TFDA) 以守護飲食用藥安全、引領科技全新紀元、創造安心消費環境為使命,並以捍衛全民健康、邁向食品藥物管理新紀元為願景,強調打造一個藥求安全,食在安心的健康台灣新環境。用藥安全是政府施政的使命,與用藥安全相關的每一個環節實不容忽視。
藥物安全監視 (Pharmacovigilance),以確保民眾用藥安全是世界潮流,也是先進國家永遠追求的目標,更是 TFDA 施政的使命。硬體與軟體必須兼備、缺一不可,硬體管理方面,原料主檔案 (Drug Master File;DMF)、原料廠實施優良製造規範 (Good Manufacturing Practice;GMP)、包材、賦形劑,國際醫藥品稽查協約組織藥品優良製造規範 (Pharmaceutical Inspection Co-operation Scheme/Good Manufacturing Practice;PIC/S GMP),藥品優良運銷規範 (Good Distribution Practice;GDP) 等已具備,但是軟體監督如醫藥行銷師的資格認定,藥事法第33條已不合時宜、落伍了,醫療供應鏈必須環環緊密相扣,不可鬆動。
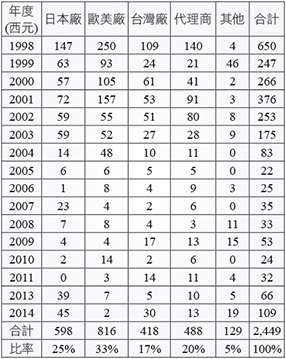
MR 認證制度的推動,歷年來受到衛生主管機關包括衛生福利部,食藥署、健保署,縣市衛生局與醫療院所等認同並多方協助,單位主管均親臨擔任認證訓練講師,表示對 MR 認證制度肯定與支持。目前我國之 MR 認證證照屬於個人資格且是業界自主,由 TPMMA 頒發。取得 MR 認證後5年內需接受72小時之持續教育,才能持續保有 MR 資格。MR 認證制度截至2014年底已有2,449位 (表一、圖二) 醫藥專業行銷人員取得 MR 認證資格。
表一 醫藥行銷師認證人數 (廠商)
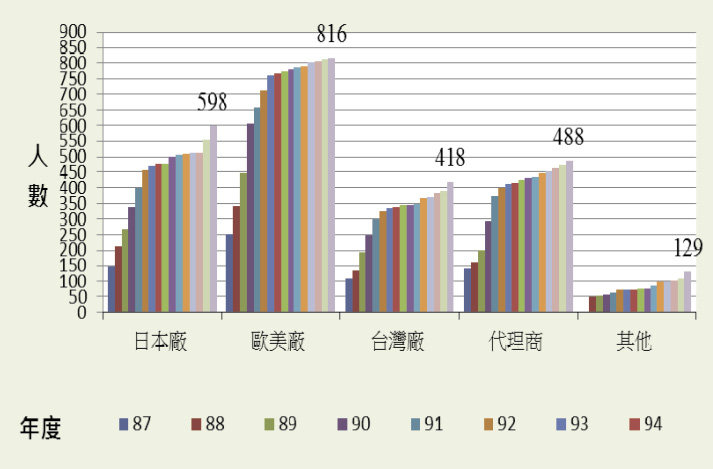
圖二 醫藥行銷師認證人數 (廠商)
參、MR 認證制度全面推動的迫切性
醫藥分業之後,由於藥師在醫院與藥局工作的待遇優渥且工作的相對穩定,近年來從事醫藥行銷工作者越來越少 (表二、圖三),而一般科系畢業生卻有逐漸增加趨勢 (表二、圖三)。藥品非一般商品,從事藥品行銷工作事關「用藥安全」至鉅,需要具備一定的基礎教育與專業知識,以免因知識不足而造成藥品危害,增加家庭與社會的負擔,對某些受害者或許造成終身遺憾。
表二 醫藥行銷師認證人數 (教育背景)
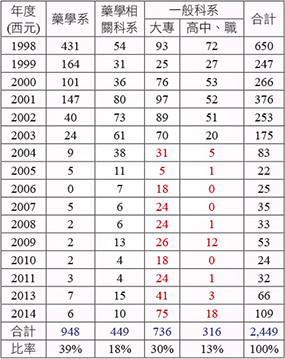
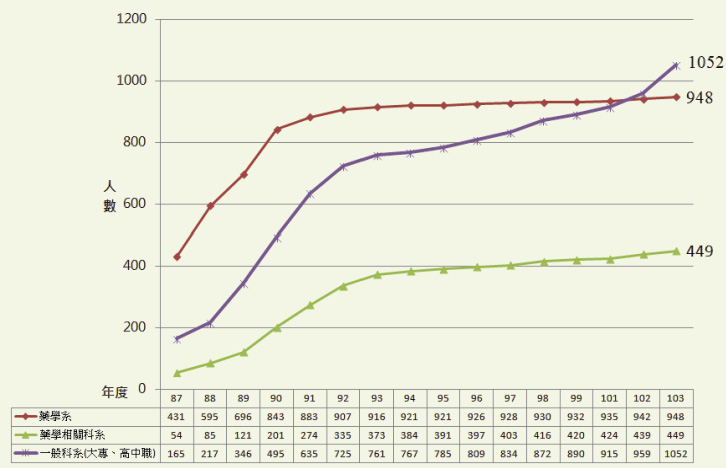
圖三 醫藥行銷師認證人數 (教育背景)
為什麼 MR 認證制度對用藥安全那麼重要?因為醫藥專業人員 (醫師、藥師、護理師) 獲取產品知識的來源大致從幾個方面:一、醫藥專業科系的教育背景,二、自行查詢醫學網站/藥品公司網站 (Global or local),三、閱讀醫藥學雜誌,四、參加醫學會議或研討會 (International/regional/local),五、透過醫藥行銷師相互傳遞訊息,而最後一項是最快速、最便捷,也是最主要的窗口。
所有商品只有藥品成立「藥害救濟基金」,此基金係由藥業捐助,每年支付金額約2,500-3,000萬元,且有逐年增加的趨勢,101年度支付7,600萬元,102年度與103年度支付2,700-3,000萬元 (圖四),減少藥害發生是每位從事醫藥相關工作者都需肩負的責任,也是社會大眾的期待。
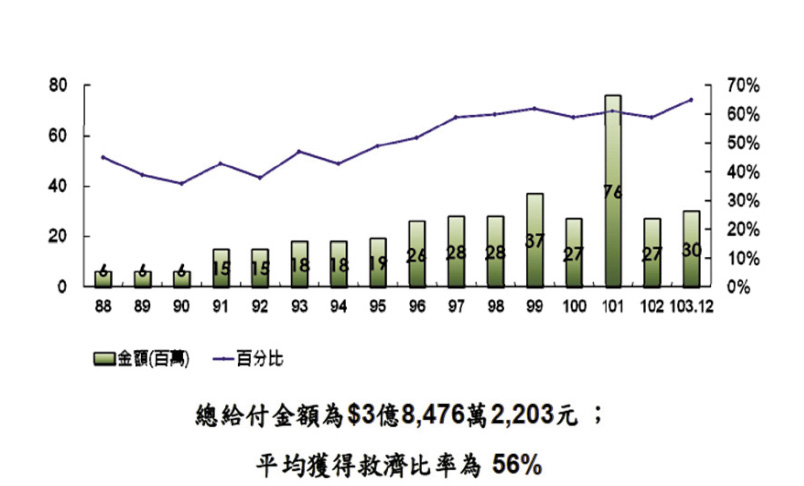
圖四 歷年通過藥害救濟之金額與給付率
肆、MR 認證制度訓練內容
一、基礎教育訓練
(一)課程內容:基礎生理學、藥理學、藥品行銷學、藥事法規與醫藥倫理學、配伍禁忌 (存刪討論中)。(二)課程時數:120小時。(三)學分數:5-6 (課程與學分數各校依實際安排調整)。(四)參加對象:非藥學相關科系畢業,從事藥品行銷工作或對藥品行銷工作有興趣者。(五)授課學校:台北醫學大學、中國醫藥大學、高雄醫學大學。
二、認證資格考試
(一)凡是要參加 MR 認證訓練,均需通過認證資格考試。(二)考試科目:基礎生理學、藥理學、藥品行銷學、藥事法規與醫藥倫理學、配伍禁忌 (存刪討論中)。(備題庫:每科200題,考50題)。(三)參加資格:1.醫、牙、藥、護科系大專以上院校畢業者。2.完成基礎學程訓練結業者。3.藥學相關科系:大專以上院校畢業修習過生理學、藥理學、藥事法規、配伍禁忌、藥品行銷學共六學分以上者。
三、認證訓練
(一)訓練時數:16小時。(二)訓練課程:藥政管理方針、最新藥業行銷趨勢、醫藥專業行銷人員認證制度、醫師看 MR、臨床藥學與藥局管理、全民健保藥價政策、醫藥行銷規範、藥物經濟學、藥事法規、如何將醫療觀念注入行銷、健保用藥規範新趨勢、品質確保計劃、MR 的生涯規劃。(以上課程視實際需要調整)。(三)參加對象:通過認證資格考試者。
四、持續教育
凡取得醫藥行銷師 (MR) 認證資格者,5年需接受72小時 (研議比照藥師持續教育6年150小時) 醫藥專業或行銷管理相關科目之持續教育,始能保有醫藥行銷師 (MR) 資格。
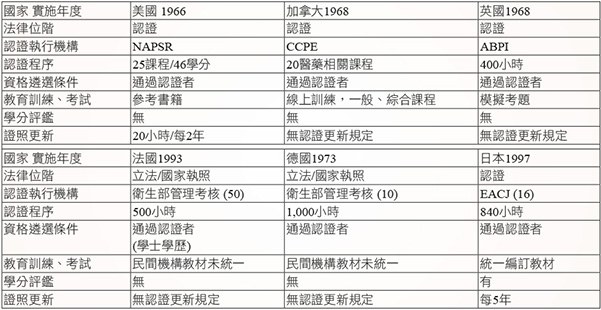
伍、世界各國的 MR 認證制度 (表三)
表三 各國認證制度
一、中國醫藥行銷師 (圖五)
(一)原台灣諾華總經理奉派出任中國總經理,將台灣 MR 認證制度引進大陸,於2005年實施。(二)中國國務院決定,從2006年8月起,用一年左右的時間,全國深入開展整頓和規範藥品市場秩序專項行動。為了規範醫藥行銷人員從業行為,同時提高其職業技能和職業道德水準,南京市於2005年下半年首先推出了醫藥行銷師職業資格培訓研發專案。(三)大陸醫藥行銷師相關新聞陸續刊登:醫藥代表進門必須先考證、江蘇省醫藥行業醫藥代表將持證上崗、南京首批醫藥行銷師出師,未通過 MR 認證的醫藥代表將淡出。
圖五 民眾對藥業界的期許
陸、MR 認證制度對國家社會及醫療體制所代表的意義
一、確保全民健保的醫療品質
(一)傳達正確用藥資訊。(二)減少藥物濫用及藥害的發生。(三)提昇醫療成本效益 (cost-effectiveness)。(四)建立人民對醫療品質的信心。
二、樹立完善的醫藥倫理制度
(一)提昇醫界對藥界的信賴度。(二)提昇醫師、藥師及專業行銷人員的專業形象。
三、建立世界水準的醫藥行銷體制
(一)引進歐、美、日先進國家行銷教育體系。(二)符合國情之 MR 資格制度。
四、提昇國家形象及競爭力
(一)協助建立亞太營運中心的藥業產業政策。(二)樹立台灣之醫藥國際形象。
柒、MR 認證制度對企業的利益
一、確立專業行銷人員之水準。二、確立公司制度化之專業形象。三、節約公司教育訓練費用 (職訓局補助)。四、北醫、中醫、高醫三個大學授課,品質保證。北、中、南上課方便。五、提供多元化專業醫業行銷人員人力資源。六、提昇公司與醫療界良性互動。七、提昇公司經營績效。
捌、MR 認證制度對個人的影響
一、取得進入醫藥行銷門檻的鑰匙。二、受到醫療機構肯定。三、受到醫藥企業認同。四、提高自己的專業形像。五、有利於在醫藥領域的職涯發展。
玖、 TPMMA 在 MR 認證制度推動的努力
一、二十年來陸續舉辦活動 (圖六)

圖六 繼續教育上課情形
(一)MR 基礎教育訓練:北醫24梯次、高醫4梯次、中醫6梯次 (圖六)。(二)MR 認證考試:總共44梯次。(三)MR 認證訓練:總共32梯次 (表四)。(四)網路教學79個課程 (TPMMA 15個+博士博數位人力資源 (Pospo Digital Human Resources Services Inc.) 合作課程64個)。(五)產品經理訓練、全方位經理訓練、業務經理訓練、時間管理、進階銷售、目標管理、績效考核、業務輔導、MR 十步曲、領導人的執行力、創新思維、變革管理、實質利益銷售、與高階會談、藥業領袖高峰營、全民健保研討會、兩岸醫藥行銷研討會、生技產業發展論壇、讀書會……不計其數。(六)2013年藥業公協會拜會溝通 (表五)。(七)台灣 MR 認證制度於1995年由 TPMMA 傑出經理人聯誼會發起成立,歷經兩年籌備溝通拜會衛生署、歐、美、日僑商會及各大公協會說明後,於1998年正式第一次舉辦兩天的授證前訓練課程,第一年取得醫藥行銷師認證人數為650位 (表六)。
表四 近3年各校基礎教育、認證考試與認證訓練現況
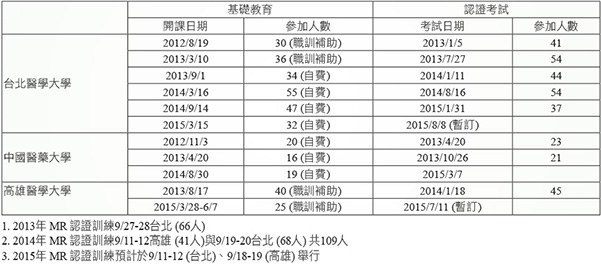
表五 藥業公協會拜會溝通
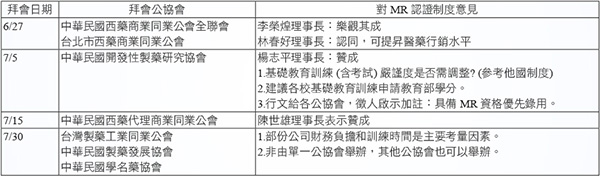
表六 TPMMA 台灣 MR 認證推廣的功臣
拾、 各行各業強調專業認證的時代與修訂藥事法第33條的必要性
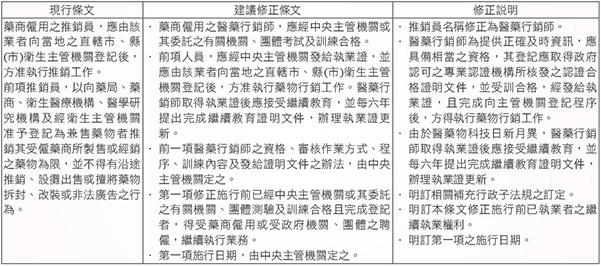
科技蓬勃發展的時代,任何行業都強調專業,唯有專業才能維持該有的品質。醫藥產業是一個關係國民健康的產業,從事醫藥產業之從業人員 (醫師、藥師、護理師、護士等),需要接受嚴謹的專業訓練,被要求具備特定資格,以確保具有維護國民健康的基本能力。從事醫藥行銷工作者,屬於醫藥供應鏈的一個環節,也是國民健康維護團隊不可或缺的一份子。當各行各業在強調專業時,實不應該獨漏醫藥行銷人員。醫藥行銷師需具備醫藥相關知識,瞭解並遵循醫藥行銷倫理,才不致於誤導醫師用藥或誤導醫護人員使用錯誤的護理方法,對於國民健康之維護關係至鉅。截至2014年底,實際取得 MR 認證人數2,449位大致僅占全體藥品行銷人員十分之一,還有相當多醫藥行銷人員沒有參加認證。為維持醫藥行銷人員之素質,維護整體醫療品質,實有必要修訂藥事法第33條 (表七),要求從事醫藥行銷工作者,得取得 MR 認證資格。
表七 藥事法第33條
拾壹、結語
做對的事,做對國家社會有利的事,需要立法諸公、政府、衛生福利部及醫藥業界大家支持:(一)修訂藥事法第33條。(二)懇請 衛生福利部補助基礎教育訓練費用或協助爭取勞動力發展署基礎教育訓練費用補助。(三)醫藥業界認同有共識、積極行動、共同推動 MR 認證制度。
An Overview of TPMMA Promoted Medical Representative Certification in Taiwan
Jack Lee
Taiwan Pharmaceutical Marketing and Management Association
Abstract
Advanced countries in the world require MRs to equip basic certification requirement as they play a very important role in medical supply chain such as medicine information transmission. Through the professional detailing and introduction by MRs, the correct medicine information can be fully transmitted to medical professions, pharmacovigilance can be ensured and right diagnosis and treatment of disease for patients also can be reached.
MR Certification in Taiwan has been promoted by TPMMA for 20 years, and a total of 2,449 of professional medical representative have been granted with MR Certification (about 10% of total pharmaceutical marketing workers only), composed of 948 (39%) graduated from pharmacy degree, 449 (18%) from healthcare related field, 1052 (43%) miscellaneous field until 2014..
In conclusion, we need to proactively communicate and coordinate with all other pharmaceutical and medical associations, government officers and legislators to reach a consensus. Do the right and good things for Taiwan, Let's make it happened to amend the "Pharmaceutical Affairs Act 33" law and fully implement MR Certification in the near future.
參考資料:
1.Perazella MA: Drug use and nephrotoxicity in the intensive care unit. Kidney Int 2012;81:1172-8.
2. Naughton CA: Drug-Induced Nephrotoxicity. Am Fam Physician 2008;78:743-50.
3. Nolin TD, Himmelfarb J: Mechanisms of drug-induced nephrotoxicity. Adv Drug reactions 2010;196:111-30.
4. Boucher BA, Wood GC, Swanson JM: Pharmacokinetic changes in critical illness. Crit Care Clin 2006;22:255-71.
5. Vilay AM, Churchwell MD, Mueller BA: Drug metabolism and nonrenal clearance in acute kidney injury. Crit Care 2008;12:235-43.
6. Schmith VD, Foss JF: Inflammation: planning for a source of pharmacokinetic/pharmacodynamic variability in translational studies. Clin Pharmacol Ther 2010;87:488-91.
7. 蘇純慧、謝右文、高純琇等:臺灣藥物不良反應為腎毒性之案例分析。藥物安全簡訊2007;19:14-22.
8. Pannu N, Nadim MK: An overview of drug-induced acute kidney injury. Crit Care Med. 2008;36:S216-23.
9. Verbeeck RK, Musuamba FT: Pharmacokinetics and dosage adjustment in patients with renal dysfunction. Eur J Clin Pharmacol 2009;65:757-73.
10. Schetz M: Drug dosing in continuous renal replacement therapy: general rules. Curr Opin Crit Care 2007;13:645-51.

