摘要
β-阻斷劑在心衰竭的治療主要改善左心室射出分率,可減低住院率和死亡率。臨床指引建議β-阻斷劑以低劑量開始使用,逐漸增加劑量來達到目標劑量。然而β-阻斷劑的劑量與藥物不良反應發生有相關性,因此臨床上,β-阻斷劑的劑量多未達建議劑量。此外,考量β-阻斷劑劑量的調整,當劑量低於目標劑量時,但心跳速率下降已達最大減幅,是否需再增加β-阻斷劑的劑量至目標劑量,和若心跳速率下降低幅度偏小,是否仍需將β-阻斷劑的劑量提高大於目標劑量,仍缺少臨床佐證。本文以實證方法探討臨床上使用β-阻斷劑的劑量與降低心跳速率在心衰竭患者治療療效的相關性和效益,及副作用發生的關聯性,並以實證藥學來提供臨床應用。
關鍵字:心衰竭、β-阻斷劑、目標劑量、heart failure、β-blocker、target dose
壹、前言
心臟衰竭的發生主要是心輸出量無法供應足夠的血液滿足身體的代謝,因而需提升心室充填壓力來達此目的,長期下來造成呼吸困難、運動耐受力差和長期慢性疲勞,而且其發病率和死亡率皆高1。根據美國心臟協會指出,心臟衰竭影響到近836萬美國人,佔心血管相關死亡的31.9%2。在台灣,102年心臟疾病高居十大死因的第2位,佔心血管相關死亡的38.5%3。心臟衰竭導致每年就診、住院和再入院率提高,及增加可觀的醫療費用。心衰竭出現症狀後5年的死亡率大約50%,確診後的第一年內有三分之一的患者會因嚴重的相關疾病死亡。目前藉由多重藥物治療來改善心臟功能狀態和減緩灌注功能不全的惡化,以降低死亡率1。
治療收縮性心衰竭的關鍵在於內分泌系統活化的抑制。第一線治療藥物包括血管收縮素轉換酶抑制劑 (angiotensin converting enzyme inhibitors, ACEI);若患者不能耐受時,可改為血管收縮素受體阻斷劑 (angiotensin receptor blockers,ARB) 及β-阻斷劑4。β-阻斷劑對心衰竭的預後及症狀改善有益,因此被納入心衰竭治療準則5-7。
使用β-阻斷劑治療可能因潛在房室傳導阻滯而加重心肌收縮力,導致心衰竭、誘發心肌梗塞而住院或造成代償性心衰竭8。但由於β-阻斷劑使用的劑量與臨床效果相關性目前仍不明確,在治療劑量下,可能導致心衰竭惡化或引起不良反應,因而限制了β-阻斷劑的加入治療。為了減低這些風險,治療指引中建議β-阻斷劑由低劑量開始使用,並緩慢增加至目標劑量 (表一)9,10。然而,並非所有的使用者的劑量都達到目標劑量,在 Rector TS 等人回顧性研究中,分析使用 metoprolol succinate 和 carvedilol 的劑量,分別只有4%和25%的病人達目標劑量11。因此,我們本次的研究乃藉由實證手法,收集文獻,探討使用β-阻斷劑的劑量調整,與心跳速率降低變化時,對心衰竭患者的效益相關性。
表一 β-阻斷劑用於 HFrEF Stage C 建議起始使用劑量及最大劑量9,10
藥物 |
起始使用 |
最大劑量 |
臨床上平均使用劑量 |
Bisoprolol |
1.25 mg once |
10 mg once |
8.6 mg/d |
Carvedilol |
3.125 mg twice |
50 mg twice |
37 mg/d |
Carvedilol CR |
10 mg once |
80 mg once |
N/A |
Metoprolol succinate extended release (metoprolol CR/XL) |
12.5 to 25 mg once |
200 mg once |
159 mg/d |
HFrEF, heart failure with reduced ejection fraction; and N/A, not applicable; CR, controlled release; CR/XL, controlled release/extended release.
貳、方法
依據實證方法制定臨床問題 PICO,P (patient):使用β-阻斷劑的心衰竭患者、I (intervention):使用高劑量或達目標劑量β-阻斷劑、C (comparison):使用低劑量或未達目標劑量的β-阻斷劑、O (outcome):發生心跳減緩副作用或死亡率降低。以關鍵字 heart failure、beta-blockers、target doses、adverse effects 及其同義字,搜尋 Cochrane Library、PubMed 和 CEPS 等資料庫,年限為2014年3月前所發表之相關文獻。搜索限制為「英文、人類研究和臨床試用或臨床隨機-對照試驗的研究」,篩選符合主題且屬於臨床試驗之文獻進行評析。納入分析的文獻皆需包含β-阻斷劑作用對心臟衰竭患者所有死亡原因和副作用的研究。篩選出符合條件的研究後,以敘述性方式進行比較及整合。
參、結果
根據搜索策略篩選出24篇文獻,其中篇名或摘要符合的有4篇,經過內文詳細審查與 PICO 無關後,其中有兩篇因沒有安慰劑組的試驗而被排除。最後,有2篇文獻納入研究分析。1篇為統合性分析研究文獻12和另1篇為前瞻性世代研究 (prospective cohort study)13。以下為兩篇文章的結果分析。
一、2009年 Finlay 等人的統合性分析研究,作者依據所使用的關鍵字為 adrenergic β-antagonists、heart failure 和 congestive 等,搜尋年限1966年至2008年的 Medline、EMBASE、CINAHL、SIGLE 和 Cochrane 等資料庫的相關隨機-控制試驗。並手工檢索研究近期發表的β-阻斷劑在心臟衰竭統合性分析文獻和心臟衰竭指引。搜尋後共收入23篇符合條件的隨機-控制試驗,受試者有19209人。在這些研究其中,有4篇研究報告指出,接受β-阻斷劑治療和安慰劑的患者之間,其死亡率有顯著差異 (RR 0.67,CI 0.68-0.84)。異質性檢驗顯示為中等異質性 (I2 = 30%,p = 0.09)。不同的β-阻斷劑如 carvedilol、bisoprolol 和 metoprolol 其臨床效益是相似的。
將這些研究結果中的心跳速率下降幅度分三等份,發現存活率在β-阻斷劑使用後心跳速率下降幅度最大的研究 (RR,0.64 [CI, 0.48-0.86]),比起下降幅度最小的研究 (RR,0.91 [CI, 0.83-0.99]),有更顯著效益 (圖一)。統合性迴歸證實,治療後心跳速率下降與β-阻斷劑生存獲益幅度的相關性有統計學上差異 (Wald 檢驗 p = 0.01),且心臟速率減少的異質性 I2 值為0%,心跳速率降低和β-阻斷劑的益處呈線性相關 (p = 0.006)。β-阻斷劑治療後心跳速率每降低5次/分,對於死亡的相對風險降低18% (CI, 6%至29%)。
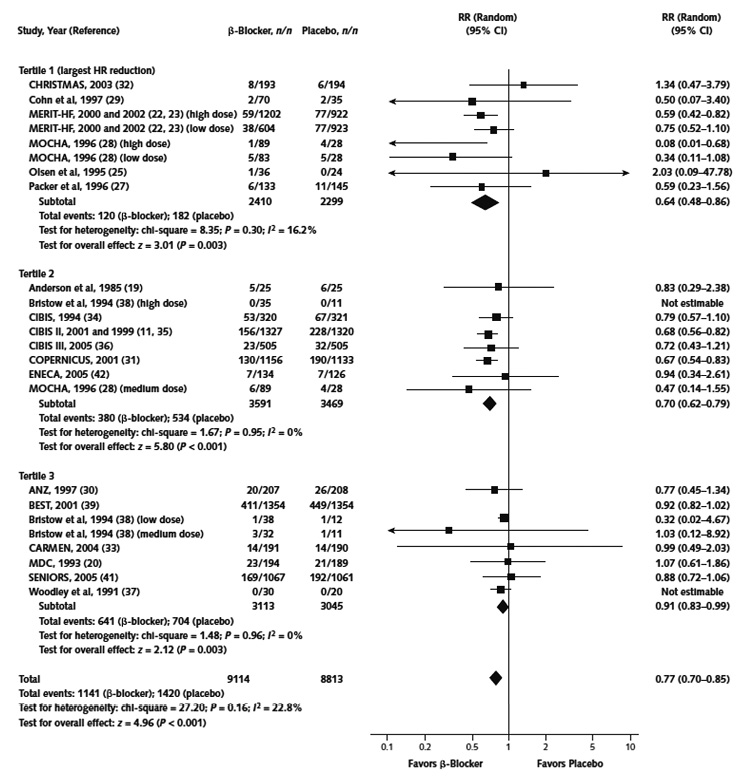
圖一 治療後心跳速率下降幅度以三分位數法分析與所有死因相關性12
HR, heart rate; RR, risk ratio.
另外研究發現,即使心跳速率降低是由基礎值的相對減少而不是絕對值的變化,心跳速率降低和死亡的相對風險之間也有類似的關係 (在心跳速率每減少5%,RR 死亡下降15% [CI,5%-25%],p = 0.007)。但由於納入的試驗中的統合迴歸分析,缺乏轉折點和心跳速率降低值,限制了研究推測β-阻斷劑的治療與心跳速率降低的“最適”幅度 (圖二)。同時,β-阻斷劑劑量的達到和全因死亡率降低的幅度之間,並無統計學上相關性 (p = 0.69)12。文獻證據等級為 Level I。
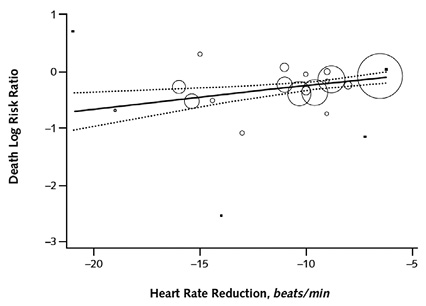
圖二 統合線性回歸心跳速率下降幅度和所有死因危險比值相關性12
二、2012年 Mona 等人藉由隨機-控制-多中心的 HF-ACTION 試驗13,再進行世代研究,其所納入門診心衰竭患者共2,331人。追蹤時間約為2.5年。β-阻斷劑的劑量轉換以 carvedilol 等值基準為標準化,並作為連續變量分析,劑量分組為0,1-13 mg,14-25 mg,26-50 mg,51-200 mg 組距。Carvedilol 劑量中位數為每天38 mg,最常使用的劑量為每天26-50 mg (36%),其次是每天14-25 mg (23%)。其中73%的患者在研究過程中,沒有改變過β-阻斷劑的劑量,6%的患者死亡,15%未完成紀錄研究,最後只有6%的患者有改變劑量。分析所有死亡/住院的因素和劑量之間的關係,校正變因後發現,與主要所有導致死亡或住院的終點變量有顯著的相關性,高劑量的β-阻斷劑仍顯著與較低主要終點有關 (HR,0.96,p = 0.02)。當β-阻斷劑的劑量和心血管不良事件之間的關係顯示,未使用β-阻斷劑患者有最多的心血管事件(45%),而每日劑量26-50 mg 組中的心血管不良事件最少 (33%, p = 0.0001)。當每日劑量提高至50 mg 內,效益為線性關係 (圖三)。且使用較高劑量的β-阻斷劑下,並沒有增加心跳過緩現象 (p = 0.35)。但研究中也發現,大約50%的β-阻斷劑劑量並沒有達目標劑量。因此,儘管治療指引推薦使用中到高劑量的β-阻斷劑,但在大型、多研究中心、隨機-對照臨床試驗報告中,很多患者的β-阻斷劑劑達到目標劑量仍是有效益14。文獻證據等級為 Level III。
肆、討論
一、首先就β-阻斷劑劑量增加幅度與治療心衰竭效益的相關性而言,在2009年 Finlay 等人的統合性分析研究發現,對於心跳速率每降低5次/分,死亡的相對危險性會減少18% (CI, 6%至29%)。因而推測β-阻斷劑使得存活率效益增加是因為心跳下降幅度而非單純的劑量增加12。但在線性統合迴歸分析中,未能發現最適的心跳速率 (即心跳速率減少的目標值)。
接著上述問題,2012年 Mona 等人世代研究中提出,當 carvedilol 每日劑量在50 mg 內,效益為線性關係 (圖三)。而且在使用較高劑量的β-阻斷劑下,並沒有增加心跳過緩現象(p = 0.35)13。似乎是β-阻斷劑在心衰竭患者使用上,除了注意劑量調整外,更應將心跳速率下降幅度納入考量。
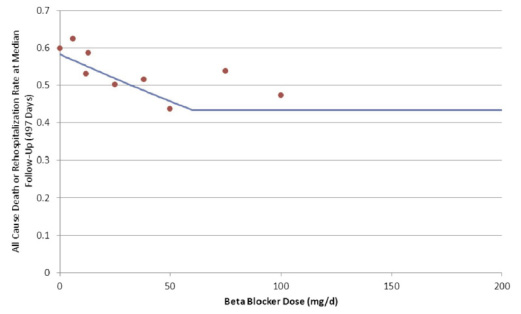
圖三 使用β-阻斷劑劑量後所有死因或再住院治療率相關性13
二、就β-阻斷劑導致的副作用而言,其副作用產生與劑量有相關性6。尤其是在老年人和有顯著併發症的患者14。β-阻斷劑常見的藥物不良反應為水腫和心衰竭惡化、疲勞、心跳過緩或心臟傳導阻滯和低血壓9。在β-阻斷劑和安慰劑組中,因不良反應而停止服藥分別為16.0%和18.0%14。不良反應事件中以心跳過緩在心衰竭患者上最受關注。其心跳過緩相對風險有顯著增加 (RR,3.62; 95% CI, 2.48-5.28)。心跳過緩每年絕對增長的風險為38/1000名患者 (95% CI, 21-54),相當於每年26名使用β-阻斷劑治療的患者有1個會發生心跳過緩現象。有研究發現,因心跳過緩而停止治療,在使用β-阻斷劑組與安慰劑組分別為0.8%和0.1%。這相當於每年治療每1000名患者,其中7人因心跳過緩停止治療6。但研究顯示β-阻斷劑在較高劑量組並未增加心跳過緩發生事件,而在中~高劑量組再經其他預測變項進行校正後,反而在未使用β-阻斷劑患者有較高的心血管和心衰竭事件發生14。觀察副作用發生時間,Gottlieb 等人指出,β-阻斷劑的藥物治療引發的任何疾病惡化的風險最大出現在治療前4至8週。當治療至8週時,β-阻斷劑組在減少死亡率/住院率有效益。Metra 等人研究顯示,β-阻斷劑的目標劑量耐受度與症狀的嚴重度和較差的預後有關15。因此,對於病情嚴重的患者,建議由低劑量開始緩慢增加劑量。
伍、結論
由此次的實證探討,證實了使用β-阻斷劑中~高劑量,可使得心衰竭病人心跳速率降的更低,達到治療效益,同時在高劑量使用下,心跳過緩的副作用發生率也無顯著增加。整體而言,β-阻斷劑治療在心衰竭患者以低劑量開始緩慢增加劑量,可增加耐受性;和安慰劑組相比,整體停止藥物治療及心衰竭惡化較少。但考量心衰患者使用β-阻斷劑的劑量和結果的證據較少,我們希望透過研究分析,未來可匯集更多心衰竭患者使用β-阻斷劑的試驗數據,來得到這些重要的問題明確的回答。
The Efficiency of Beta-Blocker Doses on Clinical Outcomes in Patients with Heart Failure
Chia-Nan Chen, Hui-Hsiung Lai, Hui-Chuan Lin
Department of Pharmacy, Ditmanson Medical Foundation Chia-Yi Christian Hospital
Abstract
β-blockers improve left ventricular ejection fraction and reduce hospitalization or mortality of patients with heart failure. Clinical guidelines suggest that patients with heart failure should take β-blockers doses from the low doses to the target doses gradually. However, since doses of β-blocker are related to their adverse effects, patients in clinical treatment usually take the under-target doses. Furthermore, two assumptions of this study need to be examined: first, if patients take the under-target doses and the heart rate reduces significantly, the physician should consider to increase the β-blocker doses to the target doses; second, if patients take the target doses and the heart rate reduces insignificantly, the physician should consider to increase the doses over the target doses. The above two assumptions still lack any clinical trial to validate. Therefore, this article conduct an evidence-based practice on efficacy and adverse effects with the β-blocker doses in patients with heart failure and offer better pharmaceutical care.
參考資料:
1.Marx, John A., Hockberger, Robert S., et al: Rosen's Emergency Medicine. In O'Brien, John F., Hunter, Christopher L., editors. Heart Failure. 8th ed. 2014 p. 1075-1090. e7.
2. Go AS, Mozaffarian D, Roger VL, et al: Executive Summary: heart disease and stroke statistics-2014 update: a report from the American Heart Association. Circulation. 2014;129(3):399-410.
3. 國人10大主要死因. 2014. at http://www.mohw.gov.tw/cht/DOS/DM1.aspx?f_list_no=812.
4. Krum H, Driscoll A. Management of heart failure. Med J Aust. 2013;199(5): 334-9.
5. Foody JM, Farrell MH, Krumholz HM. beta-Blocker therapy in heart failure: scientific review. JAMA. 2002;287(7):883-9.
6. Ko DT, Hebert PR, Coffey CS, et al: Adverse effects of beta-blocker therapy for patients with heart failure: a quantitative overview of randomized trials. Arch Intern Med. 2004;164(13):1389-94.
7. Chatterjee S, Biondi-Zoccai G, Abbate A, et al: Benefits of β blockers in patients with heart failure and reduced ejection fraction: network meta-analysis. BMJ. 2013;346:f55.
8. Barrese V, Taglialatela M. New advances in beta-blocker therapy in heart failure. Front Physiol. 2013;4(323):1-8.
9. Yancy CW, Jessup M, Bozkurt B, et al: 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation/American Heart Association Task Force on practice guidelines. Circulation. 2013;128(16):e240-327.
10. McMurray JJ, Adamopoulos S, Anker SD, et al: ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. Eur Heart J. 2012;33(14):1787-847.
11. Rector TS, Anand IS, Nelson DB, et al: Carvedilol versus controlled-release metoprolol for elderly veterans with heart failure. J Am Geriatr Soc. 2008;56:1021-7.
12. McAlister FA, Wiebe N, Ezekowitz JA, et al: Meta-analysis: beta-blocker dose, heart rate reduction, and death in patients with heart failure. Ann Intern Med. 2009;150(11):784-94.
13. Fiuzat M, Wojdyla D, Kitzman D, et al: Relationship of beta-blocker dose with outcomes in ambulatory heart failure patients with systolic dysfunction: results from the HF-ACTION (Heart Failure: A Controlled Trial Investigating Outcomes of Exercise Training) trial. J Am Coll Cardiol. 2012;60(3):208-15.
14. Whellan DJ, O’Connor CM, Lee KL, et al: Heart Failure and a Controlled Trial Investigating Outcomes of Exercise Training (HF-ACTION): Design and rationale. Am Heart J. 2007;153:201-11.
15. Metra M, Torp-Pedersen C, Swedberg K, et al: Influence of heart rate, blood pressure, and beta-blocker dose on outcome and the differences in outcome between carvedilol and metoprolol tartrate in patients with chronic heart failure: results from the COMET trial. Eur Heart J. 2005;26(21):2259-68.

