摘要
爾來,健保用藥的爭議浮上媒體,成為社會熱門議題。媒體及民間發聲團體對利益導向的藥品爭戰不求甚解,以訛傳訛,亂象浮現,讓吃藥這件事變得極其複雜,顯示台灣的藥學仍停留在產品管理的思維,尚未進入二十一世紀以實證藥學 (evidence-based-medicine) 為思維的管理層次。社會追求永續須行之以道,本文旨在闡述實證藥學的定義、科學上的立論基礎、法規 (邏輯) 的意涵、管理學上的應用、以及在藥事經濟學上的詮釋。
關鍵字: 實證藥學、藥品智慧財產權、藥事法第40條之1及之2、藥品三同政策、Hatch-Waxman Amendments、Generic Drug Law
壹、前言
近來健保用藥的爭議一一浮上台灣社會新聞版面,成為熱門議題。而媒體及社會發聲團體對利益導向的爭戰不求甚解,以訛傳訛,亂象浮現,讓吃藥這件事變得極其複雜,成為人民生病之後,還要面對用藥無所適從的沉重負擔1-2。更確切的說,醫藥界在用藥的認知及執業上,嚴重違背了現代藥學的發展,也未盡到專業的社會責任3,以致於台灣在用藥這件事上,正走向「集體不思考、集體不學習、集體不負責」的低智商社會4。追求社會永續須行之以道,本文旨在闡述二十一世紀藥學主流的道:實證藥學,並以實證藥學說明2005年我國增訂藥事法第40條之1、第40條之2的立法背景,還有2009年制訂藥品三同政策的邏輯,闡述我國建構合理用藥環境的必要性。
貳、實證藥學
實證藥學指的是有幾分證據說幾分話。不管從文字上、觀念上、科學上、歷史上、法規 (邏輯) 上、管理上、經濟學上或公民水準上,實證藥學這個字都太有意義了。
文字上:medicine 指產品 (藥),Evidence-based-medicine (實證藥學;EBM) 指知識經濟產品 (藥+仿單)。EBM 是先進國家在用藥的思維上,從產品管理轉型到體系管理的歷史演進中,極為重要的里程碑。
科學上:數百人服用外源物的數據評估 (risk-benefit assessment on xenobiotics) 讓該外源物變成新藥。新藥上市後,數百萬病人服用的數據評估讓該藥變成學名藥。有幾分證據說幾分話,藥的數據是個浮動的證據。那麼,藥的智慧財產指的是那顆藥,還是「藥+仿單」那個知識證據?是邏輯上需釐清的問題5。
歷史上:以美國、歐盟、日本三大區塊組成的國際藥事法規協合組織 (International Conference of Harmonization,ICH),代表全球80%的藥品消費市場,主導著藥學的思想演進 (conceptual change),以及隨之而來用藥管理的階段性演變。有幾分證據說幾分話,ICH 主導的思維演變,代表著藥學從專業到走出專業橋接社會,從小數據到大數據,從產品經濟到知識經濟的演進6-8。
權利上:藥的智慧財產權 (intellectual property right;IPR) 是製藥產業的命根。新藥上市前的科學證據來自於原廠的創新、努力及 (付費買來的) 自願受試者的貢獻,所以財產 (小數據) 屬於原廠,無庸置疑。新藥上市到專利到期的這段時間,科學證據 (大數據) 來自於使用該藥的病人。那麼,這個知識財屬於原廠,還是屬於病人?病人是不是該向原廠分杯羹?分財產是個很嚴肅的議題。
2004年制定學名藥法時,筆者思考藥品數據的財產權歸屬於誰,Evidence-based-medicine 就成為理論的依據。既然原廠藥上市後,科學證據來自於病人,那麼「專利過後仿單屬於公共財 (public property)」就成為藥事法第40條之1的立法基礎 (圖一)。制定法律須合乎邏輯,對吧?
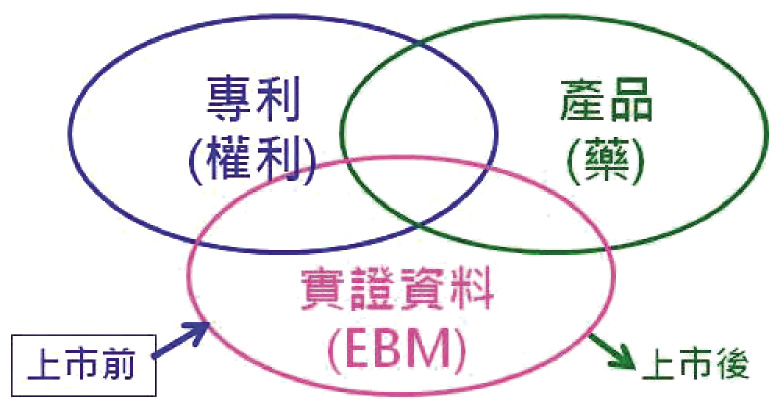
圖一 藥品智慧財產權的權利歸屬示意圖
法律上:如果仿單不是公共財,那代誌就大條了。精確的說,他廠不需做臨床試驗,只要證明等效 (bioequivalent;BE, 生物相等性),且仿單跟原廠一致,就可上市,因為藥事法第40條之1明示,為維護公共利益,學名藥不可改仿單。更精確且合乎邏輯的說法是,藥品的過程證據 (製造) 是商業機密,但結果證據 (仿單) 在專利過後屬於公共財,所以學名藥稱做 generics,原廠藥過了專利保護期是第一個學名藥。
管理上:我國藥事法第40條之2規範什麼學名藥何時可以上市,但沒有規範藥價。因此健保給付辦法中,專利過期的原廠藥是以「逾專利保護藥」類別享受著已無智財權,價格卻被保護的「永遠的長子」市場優勢。不合乎實證藥學,而且違背公平交易法第十九條第一款「無正當理由,對他事業給予差別待遇之行為」,造成國產藥70%的供給量卻只得到30%的市場報酬率。
經濟學上:價格被保護的原廠藥,在市場上具有無可取代的優勢。「高單價×高市占率」的誘因鼓勵以藥養醫,與當今集合式醫療及血汗醫護的形成有直接的因果關係。以藥養醫造成基層醫療萎縮,藥局空轉 (45%非健保特約),缺藥缺了幾十年好像也沒有人在乎。邁向高齡社會,活化社區醫療有其急迫性,政策鼓勵使用學名藥,可誘導醫院釋出處方,解決血汗醫院及基層缺藥的問題。學名藥有取代,價格去保護讓學名藥有競爭,才能創造買方市場,消彌以藥養醫的沉疴,這是經濟學上的 ABC。
參、先進國家如何落實實證藥學
一、 ICH 在實證藥學的演進及藥政法規的指引
如果以十年為一期,1990年代迄今 ICH 在藥政法規的演進上,可分為產品科學 (medicine)、用產品的科學 (medication)、「人性的科學」以及「體系管理的科學」四個層次的演化。
1990年代以前通過 phase I, II, III 臨床試驗,藥品即可上市,代表著藥品是產品科學的世代。
1990年代後期,隨著 phase IV 及 Pharmacovigilance (Pv) Specification 的宣示,先進國家對藥的管理,正式進入行為科學 (medication) 的層次。
由於個別藥品的監測有信息支離破碎的盲點,2005年國際醫學組織理事會 (the Council for International Organizations of Medical Sciences) 和 ICH 公布了 Topic ICH E2E Guidance 指引。該指引主要在識別藥物的風險以及風險的監測和預防,例如藥物基因體學、橋接評估 (Bridging Study Evaluation)、社會及文化差異對用藥風險的評估等,藥的管理進入「人性的科學」層次。
最近的演化則是以預防及降低風險為主軸,用研究工具 (藥物流行病學等) 評估環境風險,進入環境建構的「體系管理的科學」層次 (Pharmacovigilance Planning; PvP,圖二) 9。
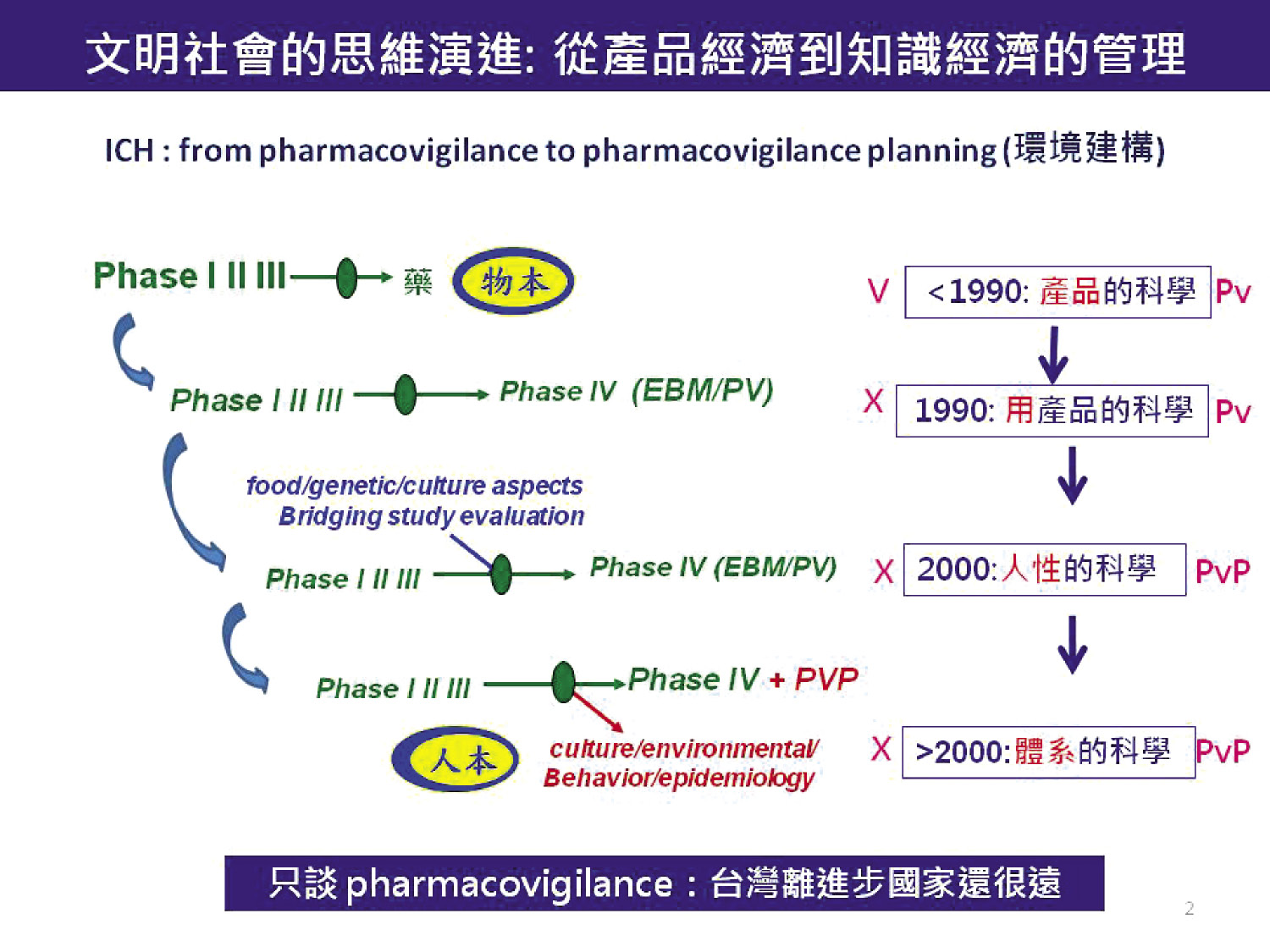
圖二 ICH 主導從小數據到大數據,從產品經濟到知識經濟的演進
二、美國如何界定新藥與學名藥
美國在1984年立法 Hatch-Waxman Act,迄今已31年。其立法精神是以智慧財產權管理藥品,達到二個面向的平衡:(一)保護:為了讓人民有新藥可用,政府鼓勵創新,以智慧財產權讓原廠藥有一定時間獨占市場,此時原廠具有賣方市場的價格優勢;(二)去保護:原廠藥專利過期就是學名藥,政府有責任讓其他學名藥儘早上市。由於藥品有取代,透過自由競爭創造買方市場,讓人民早日有便宜的藥可用,是政府的責任10。
三、 日本如何落實學名藥政策,成功翻轉醫療結構
日本二代健保也是依據實證藥學,實施學名藥政策,誘導處方釋出,達到醫療體系調結構,落實社區醫療,完成醫藥分業大工程,迄今已27年 (圖三)11。
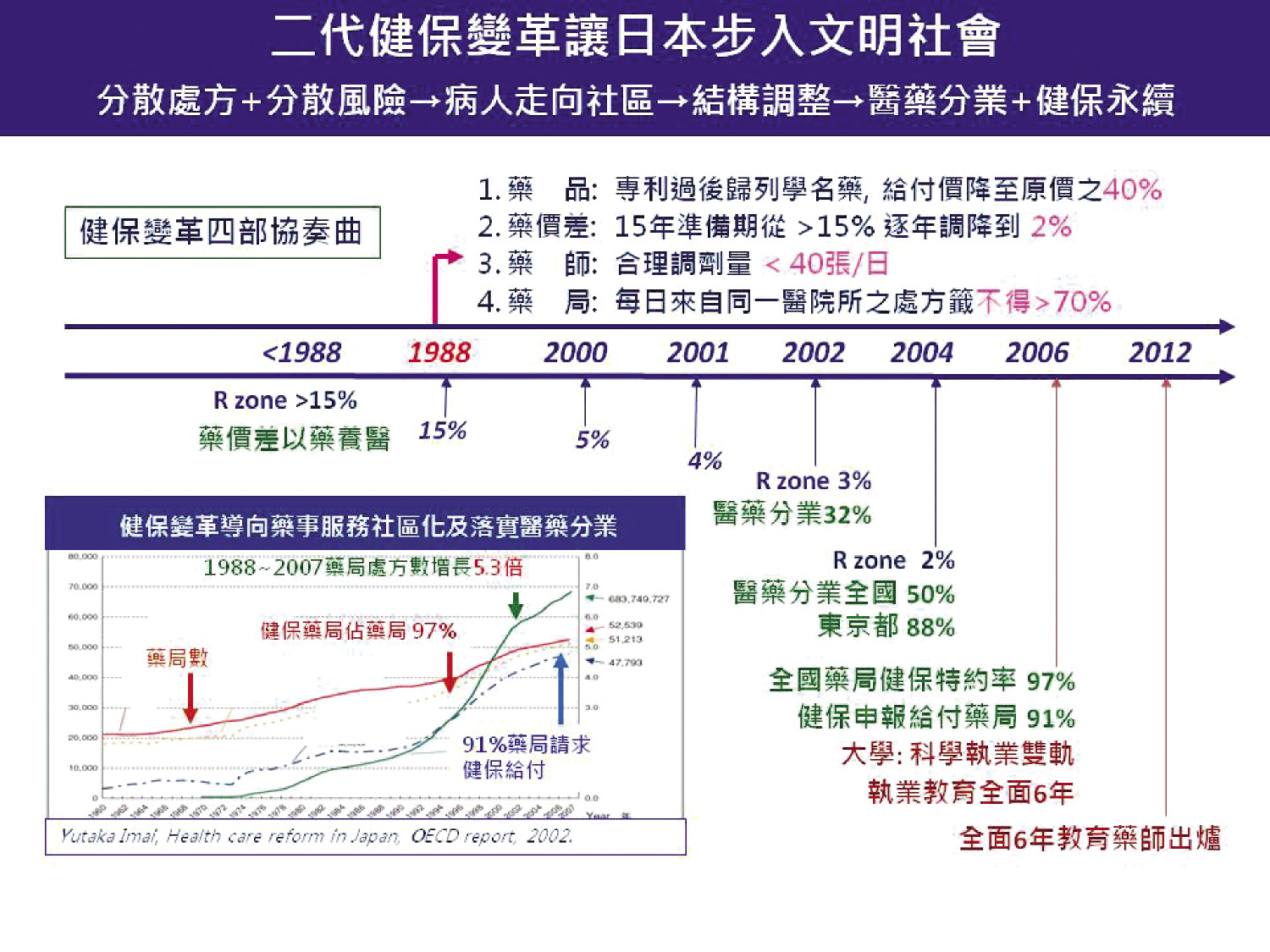
圖三 日本二代健保改革導向醫藥分業及實施六年藥學教育的因果關係示意圖
肆、我國的藥政管理
一、 以實證藥學制定新藥與學名藥的管理 (Patent Term Restoration)
我國在1988年公告 BE 學名藥的管理辦法,原廠新藥專利過期後,它廠學名藥須證明與原廠藥等效才可上市。換句話說,1988年以後上市的新藥,在專利過期後出現的藥都是等效的 BE 學名藥。
2004年初,筆者時任衛生署藥政處長。原廠藥商透過外商協會來署要求修改藥事法,增列新藥「資料專屬」權。源於先進國家對藥品智財權的管理趨勢,我國勢必要面對藥品管理的變革。筆者長期投入新藥發明,對藥品智慧財產有一定的認知,帶領藥政處同仁從智財的定義、智財保護的遊戲規則以及先進國家藥品智財管理的方式做了深入的研究,並與相關團體 (stake holders) 進行系列溝通會議。於2005年產出藥事法第40條之1 (以實證藥學界定藥品的智財保護及去保護) 以及藥事法第40條之2 (政府有責任讓學名藥儘早上市),正式宣告台灣走入以智財權管理藥品許可證的時代 (Patent Term Restoration,圖四)12。
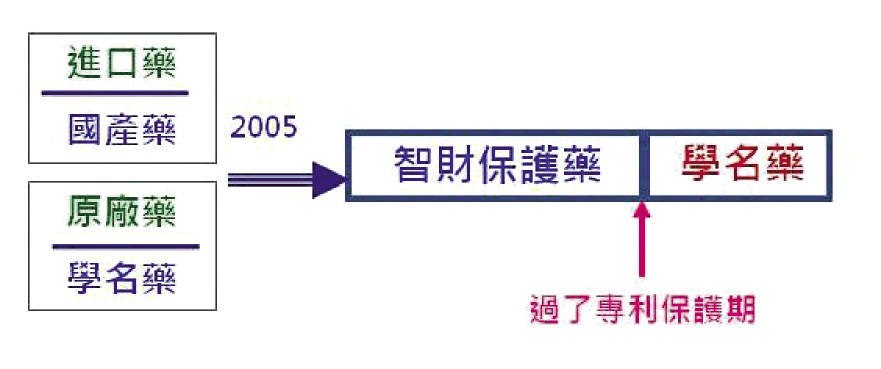
圖四 藥事法第40條之1及第40條之2界定藥品過了智財保護期就是學名藥
由於學名藥取代牽涉到人權 (以藥養醫違背人權) 以及健保納保人財產權的公平交易,該法從發展、產生到制定,導引出學名藥與原廠藥的市場品牌位移及變化,是藥事經濟學上值得探索的議題。雖然學名藥取代非原廠藥商之所願,但追求社會永續以及維繫醫療專業的尊嚴,須行之以道。學名藥法源於實證藥學,是讓台灣合理用藥行之以道的必要措施。藥事法第40條之1及第40條之2開啟我國新藥及學名藥管理的里程碑,故事極具戲劇張力,值得記下來,做為二十一世紀初台灣醫療史觀的一部分。
二、 以實證藥學落實藥價政策 (From Fixed Price to Pricing Policy)
2009年楊志良部長時代,衛生福利部公告實施同成分同品質同藥價的「三同政策」(Drug Pricing Policy),我國的藥政終於跟上美國 Hatch Waxman Act : Patent Term Restoration and Drug Pricing Policy,正式進入以智慧財產權管理藥品的層次,雖然已落後美國三十年。
「逾專利保護藥」去保護後,以單價調整估算原廠藥的給付,一年可幫人民省下73億;如以「高單價×高市占率」的市場品牌位移估算,一年可幫人民省下的更多。筆者2007年執行衛生署科技研究計畫的報告具有說服力 (光一個脈優錠就年省11個億),與有榮焉13。
三、學名藥的品質
為提昇藥品品質,我國1988年公告實施BE,將學名藥從產品的相等性 (pharmaceutical equivalent) 提昇到生物相等性 (bioequivalent)。為提昇製藥品質,我國藥廠管理從非 GMP 到 GMP、cGMP、再到當下的 PIC/S GMP。幾十年來藥廠從過去的700多家淘汰到現今約100家;也從產品 GMP 加碼到原料 GMP。爾來,未依規定使用 GMP 原料製造的藥品被食品藥物管理署勒令下架,就是政府展現落實原料 GMP 的魄力 (圖五)14。
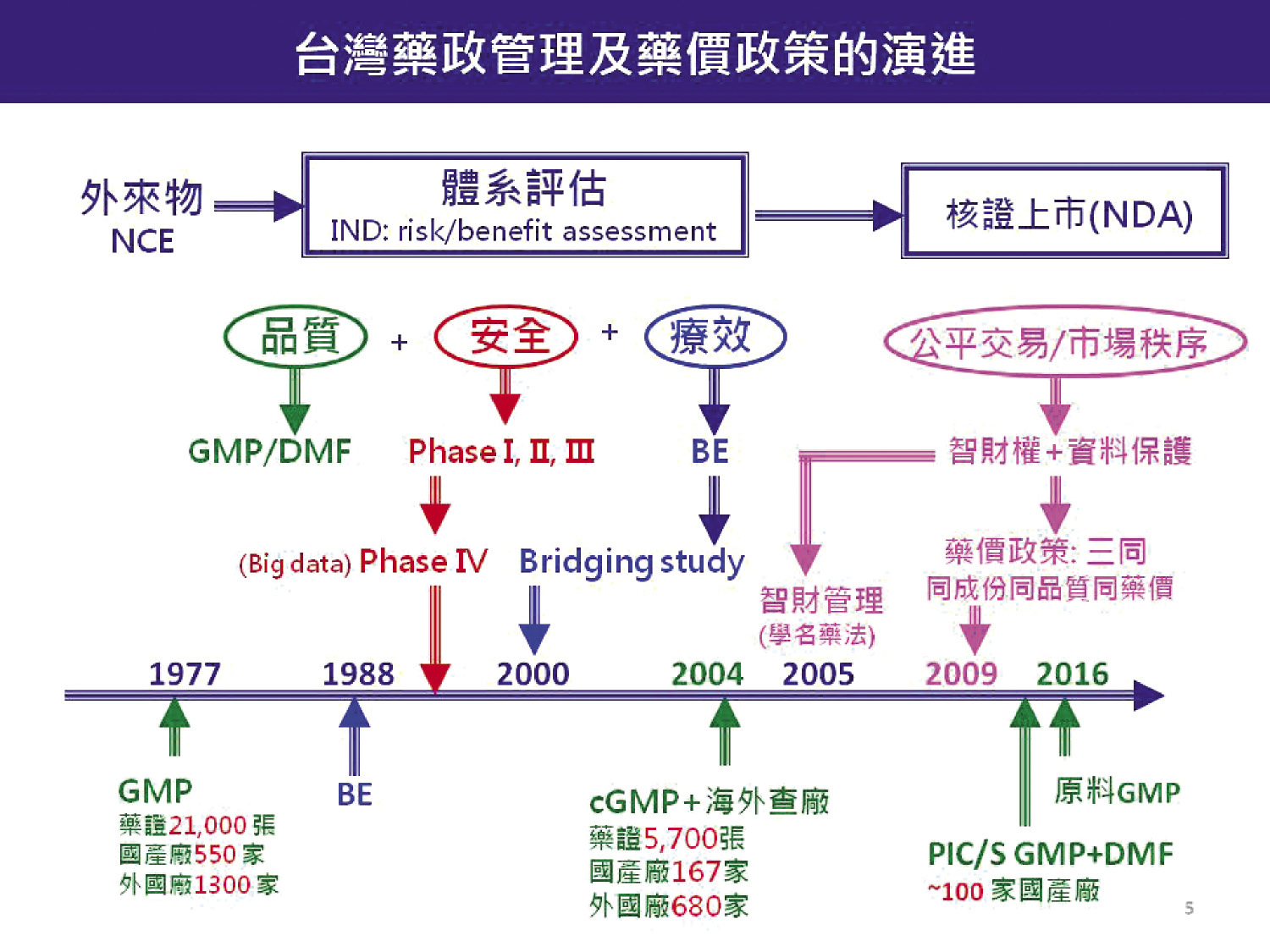
圖五 以實證藥學為基礎的藥政管理
在確保藥品品質的過程中,清理市場,去蕪存菁,讓良幣出頭,是藥政主管單位的必要作為,卻被媒體渲染成國產藥品質不良。學名藥法係追隨美國、日本,走入以智財權維繫藥品市場的公平交易,卻被媒體指控成便宜的國產藥、學名藥無效,三同政策逼使原廠藥退出台灣市場,台灣會沒有藥用。負面文宣混淆視聽,不僅違背 evidence-based-medicine 的精神,也缺乏企業社會責任,失之公允,令人汗顏。
筆者的一個電話訪查結果顯示,民眾對學名藥的認知程度與教育成正比,年輕、教育程度高及社經地位較高的族群,較願意接受學名藥取代。那麼宣稱「學名藥不如原廠藥」的媒體或公民團體,缺乏 evidence-based-medicine 的認知,是不是知識程度比較低的族群15?
伍、結論
公平交易、消費者保護、低風險環境、公民意識、以及企業社會責任是台灣要邁向進步社會的必要條件。在安全用藥的議題上,要步入這樣的社會,用藥人的人權 (風險預防) 以及生存權 (免於藥品取得障礙) 的議題,應該被嚴肅看待。落實安全用藥的環境建構,是所有用藥關係人 (藥品供應商、專業人士、病人、消費者,第三方付款人,決策者) 需嚴肅思考的議題。
Legal and Social Aspects of Pharmaceutical Evidence-based-medicine
Hui-Po Wang
College of Pharmacy, Taipei Medical University
Abstract
The transformation of pharmaceutical regulation from product management of medicine to risk management in medication is a global trend. This conceptual change, initiated by the International Conference of Harmonization, is fundamentally judged with the term evidence-based-medicine (EBM). Using Hatch-Waxman Amendments (Drug Price Competition and Patent Term Restoration Act, 1984 USA) as an example, this article described how the pharmaceutical regulatory body of Taiwan adopted the concept of evidence-based-medicine to form the Generic Drug Law. The implementation, the difficulties encountered during the implementation, and the pharmaco-economic impacts is discussed.
參考資料:
1.王惠珀:藥政管理一國兩制的隱憂,藥學雜誌2015; 31 (3): 2-7.
2. 王惠珀:從用藥安全到用藥安全環境建構,藥學雜誌2011; 27 (1): 2~9.
3. Gau CS, Chang IS, Wu FLL, et al : Usage of the claim database of national health insurance programme for analysis of cisapride erythromycin co-medication in Taiwan. Pharmacoepidemiology and Drug Safety, 2007; 16 (1): 8695.
4. 大前言一:低智商社會。 中信出版社,2010。
5. 王惠珀:落實尊重智財與合理用藥的藥物知識經濟政策研究。全民健保研究資料庫之開發與應用研討會,台北,2006。
6. Tsintis P, La Mache E: CIOMS and ICH initiatives in pharmacovigilance and risk management: overview and implications. Drug Saf 2004; 27: 509-517.
7. European Medicines Agency: Guidance on format of the risk-management plan in the European Union, first published 2012. 08.11.
http://www.ema.europa.eu/ema/index.jsp?curl=pages/regulation /document_listing/document_listing_000360.jsp
8. 王惠珀:由人本出發做對的決策。藥政簡史。台北,行政院衛生署食品藥物管理局,2012 :頁278-284
9. Bahri P & Tsintis P : Pharmacovigilance-related topics at the level of the International Conference on Harmonisation (ICH). Pharmacoepidemiol Drug Saf 2005;14:377-387
10. Drug Price Competition and Patent Term Restoration Act of 1984 (Hatch-Waxman Amendments), Statement of Daniel E. Troy, Chief Counsel, U.S. Food and Drug Administration before the Senate Committee on the Judiciary, August 1, 2003.
11. Yutaka Imai: Health care reform in Japan. OECD report, 2002.
12. 王惠珀:藥事法第40條之1及2修法始末。朱懷祖,藥物科技發展與智財產權保護,台北,景康藥學基金會,2006。
13. 王惠珀:為二代健保規範藥價遊戲規則導向合理用藥建言。藥學雜誌2012; 27(3): 2-5.
14. Wang HP: The system building for safe medication. Risk Management Trends, Giancarlo Nota ed., InTech Open-Access Publ Co, Brussell, 2011: 189-202.
15. 王惠珀:台灣藥政管理及藥事經濟面面觀。兩岸生技健康產業發展研討會,北京,2015.10.20.

