摘要
乳癌患者的輔助性賀爾蒙治療包含了 tamoxifen、芳香環酶抑制劑及卵巢根除或抑制,近期研究發現延長使用賀爾蒙治療可以持續改善乳癌的復發率及存活率,綜合分析也發現對於停經後患者使用接續治療或轉換治療可以帶來更多的效益,因此賀爾蒙治療的方式及療程非常多元,而選擇何種治療方式則是非常個人化的,此外,了解治療中可能發生的副作用,並盡早給予處置來增加患者的順服性,亦是非常重要的課題。
關鍵字:輔助性賀爾蒙治療、乳癌、tamoxifen、芳香環酶抑制劑
壹、前言
在台灣,乳癌的標準化死亡率為每十萬人11.6人,死亡年齡中位數僅58歲,潛在生命年數損失16.2歲1。而輔助性賀爾蒙治療已被許多研究證實對於荷爾蒙接受體陽性反應的乳癌患者,可以降低其乳癌的復發率及死亡率,即使已接受過化學治療的乳癌婦女,接續使用賀爾蒙治療仍具有其效益,因此本文將針對賀爾蒙治療的選擇及其療程建議進行介紹。
貳、賀爾蒙治療選擇
賀爾蒙治療有許多選擇,包含了 tamoxifen、芳香環酶抑制劑 (Aromatase inhibitors) 以及卵巢抑制 (ovarian suppression) 或卵巢根除 (ovarian ablation) 的方式 (表一)。
表一 輔助性賀爾蒙治療用藥

一、Tamoxifen
Tamoxifen 為選擇性雌激素受體調節劑 (selective estrogen receptor modulator,SERM),在乳癌細胞上屬於抗雌激素的作用,藉由與雌激素受體結合,使雌激素無法作用,因而無法刺激乳癌生長而達到抗癌的功效。使用 tamoxifen 作為輔助性賀爾蒙治療持續五年相較於未使用者,可以顯著降低39%乳癌的復發率,以及顯著降低30%乳癌的死亡率2,有趣的是,這樣的抗癌效果不單只在使用藥物期間,而會持續延長至使用藥物後的15年。
Tamoxifen 常用劑量為20 mg/天,停經前及停經後的婦女皆適用。過去受限於文獻資料不足,建議使用 tamoxifen 最多五年,但最近研究發現,延長使用 tamoxifen 至10年相較於使用5年的患者可以顯著降低乳癌的復發率 (RR 0.84, 95% CI 0.76-0.94, p = 0.002) 以及總死亡率 (RR 0.87, 95% CI 0.78-0.97, P = 0.01),尤其是在治療的10年之後,其效果更加顯著 (圖一),但延長治療可能會增加罹患子宮內膜癌的風險 (RR 1.74 , 95% CI 1.30-2.34, P = 0.0002)3。
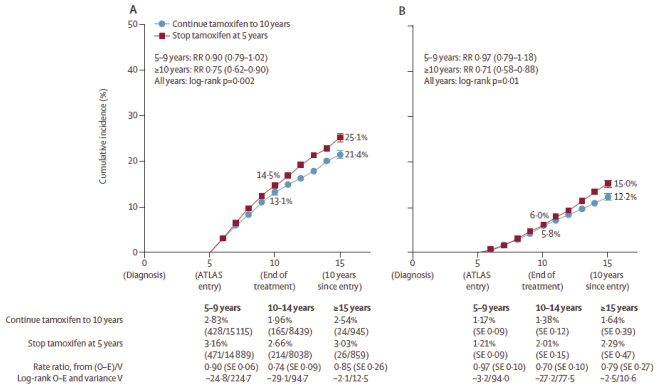
圖一 延長使用 Tamoxifen 10年相較5年者的 (A) 復發率及 (B) 乳癌死亡率3
二、 芳香環酶抑制劑 (Aromatase inhibitors)
停經前婦女的雌激素主要是經由卵巢製造,停經後則是經由腎上腺製造雄性素,再經由芳香環酶轉換成雌激素,因此此類藥物藉由抑制芳香環酶而達到阻斷雌激素生成的功效。AIs 僅適用於停經後婦女,用於停經前婦女 (即使是因接受化學治療或卵巢抑制而停經的婦女) 可能誘導卵巢再活化而生成雌激素。AIs 包含了非類固醇類的 anastrozole、letrozole 以及固醇類的 exemestane,常用劑量依序是1 mg/天、2.5 mg/天以及25 mg/天,AIs 之間的療效一般認為未具有差異性。
停經後婦女已漸漸使用 AIs 來取代 tamoxifen,有許多研究使用不同的方式來比較其與 tamoxifen 之間療效的差異,研究的方式及其結果有以下幾種。
(一)直接比較
停經後婦女起始治療選用 AIs 5年相較於選用 tamoxifen 5年者,可以再降低2.9%乳癌的復發率4。
(二)中途替換
使用 tamoxifen 2-3年之後改用 AIs 相較於持續使用 tamoxifen 5年者,可以再降低3.1%乳癌的復發率及0.7%乳癌的死亡率4。
(三)接續使用
使用 tamoxifen 5年之後接續使用 AIs 5年 (總共10年的賀爾蒙治療),相較於只使用 tamoxifen 五年者,可以顯著改善其無病存活率 (disease-free survival)(HR 0.52, 95% CI 0.45-0.61, P = 0.001) 及總存活率 (HR 0.61, 95% CI 0.52-0.71, P = 0.001)5。
依上述研究結果發現,停經後婦女建議選用 Als 治療而不是 tamoxifen,而原本已經使用 tamoxifen 的患者,停經後則可以考慮改成 Als 來接受治療,而使用 Als 治療的療程方面,目前並未有足夠的研究證實延長使用 AIs (大於5年) 可以改善乳癌的復發率與存活率,因此仍建議持續使用 AIs 最多5年。
三、終止卵巢功能
停經前的乳癌患者,可以藉由永久性或暫時性的方法來終止卵巢功能,不管是使用何種方式,目的皆是為了抑制其產生雌激素,進而減少雌激素在癌細胞的量,因而降低乳癌生長的機會。
(一)卵巢抑制 (ovarian suppression)
卵巢抑制是藉由藥物來達到暫時性抑制卵巢功能的效果,此方法不會造成不可逆的停經,使用的藥物為促黃體激素釋放激素 (luteinizing hormone-releasing hormone,以下簡稱 LHRH) 類似物,例如 goserelin、leuprorelin。
許多研究在找尋合併使用 LHRH 類似物的角色。2007年 EBCTCG 綜合分析 (meta-analysis) 顯示合併使用 LHRH 類似物及 tamoxifen 相較於單獨使用 tamoxifen,並不會改善復發率 (HR 0.85, 95% CI 0.67-1.09, p = 0.20) 及死亡率 (HR 0.84, 95% CI 0.59-1.19, p = 0.33)6。另一篇納入了3,066位停經前婦女並將其分成三組:單獨使用 tamoxifen、合併使用 tamoxifen 及 LHRH 類似物、合併使用 exemestane 及 LHRH 類似物,結果亦發現合併使用並無法改善無病存活率 (HR 0.83, 95% CI 0.66-1.04, P = 0.10),且有較高比例的不良反應發生 (包含停經症候群、憂鬱等)。在次族群研究中則發現,對於高復發風險的族群,包含曾接受過化學治療以及小於35歲即診斷出乳癌的患者,合併使用 LHRH 類似物可以改善其總存活率 (HR 0.64, 95% CI 0.42-0.96, P = 0.03)7,因此針對高風險族群,可以考慮合併使用來降低其復發的風險。
(二)卵巢根除 (ovarian ablation)
卵巢根除則是藉由手術切除卵巢或卵巢放射線治療來達到永久性的終止卵巢功能,此方式對於年輕的患者會產生長久性的健康影響,包含了心血管方面的疾病。相較於上述使用藥物來暫時性的終止卵巢功能,雖然不會造成不可逆的作用,但是否會帶來較低的效益,目前仍是未知的8。
參、臨床治療指引建議
一、停經的定義
判斷患者的經期狀態,是決定治療選擇的第一步,而「無月經」並不是一個可信賴的指標,因而美國國家癌症資訊網 (National Comprehensive Cancer Network,NCCN) 定義了以下狀態為停經婦女9:(一)曾接受過雙側卵巢切除。(二)年紀 ≥ 60歲。(三)年紀 < 60歲,且持續12個月以上無月經,並且未使用 tamoxifen、化學治療或卵巢抑制劑。
二、治療的選擇及療程
賀爾蒙治療的選擇及療程依使用情形的不同而有所差異,這些情況包含一開始所選用的藥物、中途是否有更改藥物,以及是否有接續使用他種藥物等,美國臨床腫瘤醫學會 (American Society of Clinical Oncology,ASCO) 建議10。
(一)停經前或更年期患者
1.使用 Tamoxifen 10年。2.使用 Tamoxifen 5年,再接續使用 AIs 最多5年 (適用於使用 Tamoxifen 5年後已處於停經後狀態的患者)。
(二)停經後患者
1.使用 Tamoxifen 10年。2.使用 AIs 5年。3.使用 Tamoxifen 5年,再接續使用 AIs 最多5年。4.使用 Tamoxifen 2到3年,再接續使用 AIs 最多5年。
肆、治療的時機
所有賀爾蒙接受體陽性的乳癌患者皆建議接受輔助性賀爾蒙治療,而開始治療的時機則依患者接受其他治療的狀況而有所差異。對於不建議使用其他輔助性治療 (化學治療或放射線治療) 的患者,一般是在手術後四到六個禮拜開始使用;而接受化學治療的患者則是在化學治療結束之後接續使用輔助性賀爾蒙治療;而接受放射線治療的患者,有些專家學者認為應在放射線治療的同時接受輔助性賀爾蒙治療,有些則認為在放射線治療完後再接續使用,有研究認為同時使用可能增加治療的併發症 (包含肺或乳房纖維化),但目前並未有明確的研究證據指出賀爾蒙治療的適當時機8。
伍、賀爾蒙治療藥物的副作用
Tamoxifen 最嚴重的副作用是增加子宮內膜癌及血栓栓塞的風險。而子宮內膜癌風險的增加主要是發生於年紀大於55歲者,但其發生率很低,十五年的發生率為3.8% (相較於對照組1.1%)2。其餘常見的副作用為熱潮紅、陰道分泌物增多、性功能障礙及月經不規則。
與 tamoxifen 相比,AIs 有較低的子宮內膜癌及血栓栓塞風險,但會顯著增加骨質疏鬆、骨折、高膽固醇血症及心血管疾病 (包含心肌梗塞、心絞痛及心衰竭) 的風險11。除此之外,骨骼肌肉相關症狀是造成患者停止使用 AIs 的最主要原因,這些症狀包含了關節疼痛、骨骼疼痛、關節僵硬等,發生率介於2-28.8 %之間,應及早給予適當的治療來增加患者的順服性12。
而卵巢抑制或根除的副作用則與停經症狀相似,包含了熱潮紅、盜汗、體重增加、性功能障礙等,而使用藥物來抑制卵巢功能則可能於注射部位發生不良反應,例如疼痛、紅腫等。
陸、結論
已有相當多的研究證實賀爾蒙輔助治療用於乳癌患者可以大大地降低復發率及死亡率,亦有各種不同的治療方式及療程供臨床決策者做選擇,而選擇的依據是非常個人化的,此外,如何適當的預防或處置賀爾蒙治療所產生的副作用,以提升患者的順服性,亦是一個相當重要的課題。
Adjunct Endocrine Therapy for Breast Cancer
Yi-Shan Lai, Wen-Jin Tung
Department of Pharmacy, Yuanlin Christian Hospital
Abstract
Adjunct endocrine therapy for breast cancer included tamoxifen, aromatase inhibitor and ovarian ablation or suppression. Recent studies demonstrated extended therapy consistently improves the recurrence of breast cancer and survival. Meta-analysis also showed the sequencing or switching therapy were more benefit for postmenopausal women. Therefore, the treatment approach was various and should be selected individualized. Besides, understanding the endocrine therapy induced-adverse effects and managing it early and rapidly to enhance patients' adherence were also very important.
參考資料:
1.民國101年主要死因分析. 衛生福利部 2013.
2. Davies C, Godwin J, Gray R, et al: Relevance of breast cancer hormone receptors and other factors to the efficacy of adjuvant tamoxifen: patient-level meta-analysis of randomised trials. Lancet 2011;378:771-84.
3. Davies C, Pan H, Godwin J, et al: Long-term effects of continuing adjuvant tamoxifen to 10 years versus stopping at 5 years after diagnosis of oestrogen receptor-positive breast cancer: ATLAS, a randomised trial. Lancet 2013;381:805-16.
4. Dowsett M, Cuzick J, Ingle J, et al: Meta-analysis of breast cancer outcomes in adjuvant trials of aromatase inhibitors versus tamoxifen. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 2010;28:509-18.
5. Jin H, Tu D, Zhao N, Shepherd LE, Goss PE. Longer-term outcomes of letrozole versus placebo after 5 years of tamoxifen in the NCIC CTG MA.17 trial: analyses adjusting for treatment crossover. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 2012;30:718-21.
6. Cuzick J, Ambroisine L, Davidson N, et al: Use of luteinising-hormone-releasing hormone agonists as adjuvant treatment in premenopausal patients with hormone-receptor-positive breast cancer: a meta-analysis of individual patient data from randomised adjuvant trials. Lancet 2007;369:1711-23.
7. Montemurro F, Perrone F, Geuna E. Adjuvant ovarian suppression in premenopausal breast cancer. The New England journal of medicine 2015;372:1672-3.
8. Kathleen I Pritchard M, FRCPC. Adjuvant endocrine therapy for non-metastatic, hormone receptor-positive breast cancer. UpToDate 2015.
9. network N. NCCN guidelines on breast cancer. 2015
http://www.nccn.org/professionals/physician_gls/f_guidelines.asp#breast.
10. Burstein HJ, Temin S, Anderson H, et al: Adjuvant endocrine therapy for women with hormone receptor-positive breast cancer: american society of clinical oncology clinical practice guideline focused update. Journal of clinical oncology: official journal of the American Society of Clinical Oncology 2014;32:2255-69.
11. Amir E, Seruga B, Niraula S, Carlsson L, Ocana A. Toxicity of adjuvant endocrine therapy in postmenopausal breast cancer patients: a systematic review and meta-analysis. Journal of the National Cancer Institute 2011;103:1299-309.
12. Anastrozole, letrozole, exemestane. Medication safety, adverse effects. Micromedex (R) 2015.

