摘要
失智症可謂為文明病的一種,是現代常見的退化性疾病,除了造成記憶力下降,其引發的精神相關症狀也相當常見且更為棘手。當病人出現輕度至中度躁動時,建議以非藥物治療為主,或使用助於改善認知功能的 cholinesterase inhibitors。當症狀惡化或出現攻擊行為時,就必須藥物治療介入,低劑量的非典型抗精神病藥物 olanzapine 和 risperidone 為第一線藥物。另外,選擇性血清素回收抑制劑 (selective serotonin reuptake inhibitors, SSRIs) 可以用來治療失智症患者的憂鬱症狀,而 citalopram 為第一選擇。常見的睡眠障礙建議以非藥物治療為主,改善睡眠習慣,除非必要才以藥物輔助治療。
關鍵字:失智症、認知功能、失智症的精神症狀
壹、前言
失智症是一種,甚至是多種認知功能逐漸下降、退化的疾病,例如:學習能力、記憶力、語言能力、執行力、注意力、知覺動作、社會認知等。而失智症又可分為阿茲海默症 (Alzheimer's disease)、路易氏體失智症 (Dementia with Lewy bodies)、額顳葉型失智症 (Frontotemporal dementia)、血管型失智症 (Vascular dementia) 和帕金森失智症 (Parkinson disease with dementia),其中阿茲海默症佔老年失智症的60-80%,是最常見的類型。而失智症所引發的精神相關症狀,如:妄想 (delusions)、幻覺 (hallucinations)、憂鬱、焦慮、帶有攻擊性 (aggression)、冷漠 (apathy)、易怒 (irritability)、失控 (disinhibition)、睡眠障礙等,對家人或照顧者來說,有時甚至比記憶力退化更為棘手困擾,在61-92%的失智症病人身上都可觀察到一個以上的上述症狀1,而其中在重度阿茲海默症患者中發現,妄想比幻覺更為常見1,當病人出現偏執妄想 (paranoid delusions) 時,病人會懷疑房子遭到入侵、東西被偷等,使照顧者感到非常困擾。
貳、誘發原因
目前從神經影像學中,已知人類的右半球以及右前葉與社會行為和情緒調節有關,但尚無法確立與精神症狀發生有關的神經傳導物質,因此若要了解引起病人精神症狀的原因,必須在規律的回診或訪視中觀察病人,正確地找出誘發原因,才是有效治療的關鍵。
疼痛、恐懼、困惑、睡眠不足、伴隨著其他疾病 (例如泌尿道感染或肺炎),或是藥物引起的相關反應 (特別是抗膽鹼副作用),都會引起躁動或行為異常,評估時都須列入考量。另外,當有其他的行為異常出現或認知急性改變時,則必須考慮是否有病人產生譫妄 (delirium) 症狀。
參、 輕度至中度躁動(mild to moderate agitation)
輕度至中度躁動若在早期發現時就與病人、照顧者、醫療服務者合作,並且積極主動地治療就能為病人症狀帶來很大的效益,越來越多的研究顯示出非藥物治療對這個病期就會有所助益,芳香療法、運動訓練、音樂治療、寵物療法、按摩療法都有被提出,其中規律的運動訓練對一些病人的行為治療是確實有效的,因此藥物治療不是必須的2,而 Cholinesterase inhibitors 是治療失智症的第一線藥物,對於輕度認知功能障礙也有效,也可用於輔助控制輕中度失智症患者的輕微精神相關症狀3,但是 mementine 對於輔助行為治療的效果仍有待評估。
另外有些情緒穩定的藥物對失智症的精神症狀可能有效,但是在臨床上並不一定會作為常規使用,像 carbamazepine、valproate、gabapentin、lamotrigine 等;低劑量的 methylphenidate 對冷漠有幫助,但可能會引發躁動,使用時需要特別監測4。
但有些藥物因為副作用是不建議使用,benzodiazepine 會有步態惡化、躁動、藥物依賴性問題,並不建議常規使用,僅限使用於突然出現的緊急狀況,例如:突然改變居住地,且建議使用半衰期短的藥物5;antihistamine 常被用來治療輕微的睡眠障礙,但是因為具有抗膽鹼副作用,因此也不建議用於這一類病人。
肆、 重度躁動或精神異常(severe aggression or psychosis)之藥物治療
當非藥物治療無法有效控制症狀,甚至產生更嚴重的問題或安全疑慮時,那麼藥物治療就必須介入了,不過藥物的療效不一定能完全達到,且有副作用和死亡率增加的疑慮,因此必須依據病人的症狀謹慎地選擇藥物。常用的藥品有非典型抗精神病藥物和選擇性血清素回收抑制劑。
一、非典型抗精神病藥物
典型抗精神病藥物對失智症病人的精神症狀沒有效果,除了 haloperidol 也許能夠控制攻擊症狀,但對其他的精神症狀仍沒有效果6。非典型抗精神病藥物能夠治療幻覺症狀,但卻可能增加病人的死亡率,且美國食品藥物管理局 (FDA) 也沒有核准此適應症,因此臨床上並不建議常規地、長時間地使用。但由於目前亦無其他更好的替代藥物,當臨床評估其治療效益大於風險時仍是可以考慮給予病患使用。
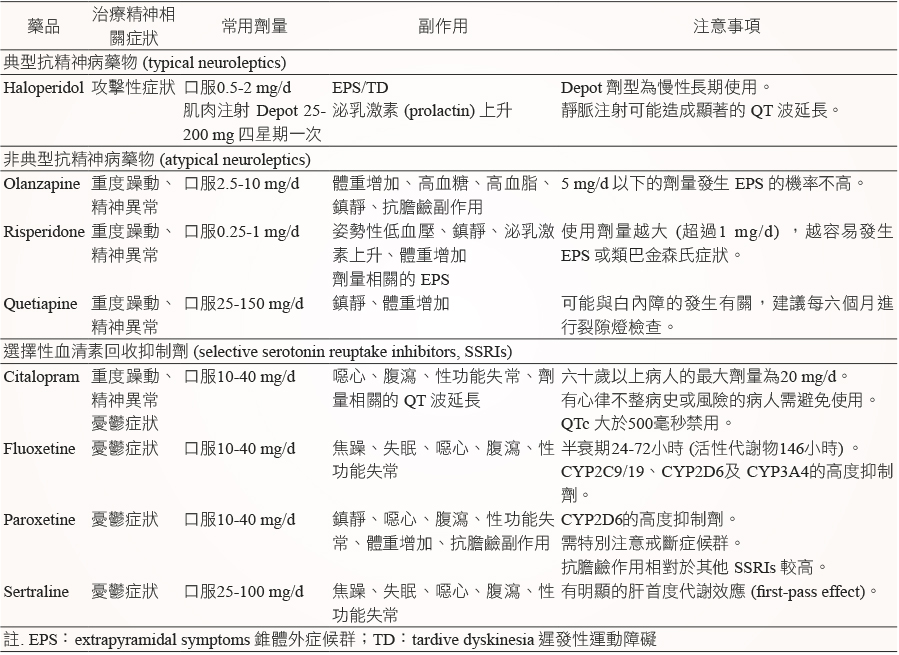
最常使用的藥物是 olanzapine 和 risperidone,olanzapine 的初始劑量是一天2.5 mg,慢慢增加到最多5 mg 一天兩次,一天5 mg 以下的劑量發生錐體外症候群的機率並不高,反而需注意的是鎮靜作用以及體重增加、高血糖、高血脂等代謝副作用;risperidone 的使用劑量不超過一天1 mg,因為高劑量的 risperidone 可能引發類巴金森氏症狀,替代的二線藥物是 quetiapine 25 mg 睡前使用,劑量可增加到最多75 mg 一天兩次,但 quetiapine 的臨床使用資料仍較少 (表一)。
這類藥品的療效並無顯著差異,藥物治療的選擇依據為考量個別病人的特性及副作用。若用藥後症狀顯著改善,則建議繼續維持治療,但有時也可考慮在規律的治療中,固定停止治療一段時間後又再繼續治療,可是必須審慎評估復發的風險以及藥物引起的不良反應。對某些病患來說,是無法停止使用抗精神病藥物的。
非典型抗精神病藥物會增加嚴重的副作用如中風、心肌梗塞、死亡的發生,當藥物劑量越高,風險也越高,雖然有文獻指出 haloperidol 發生率最高,quetiapine 最低7,但所有的抗精神病藥物都應該被考量有發生此嚴重副作用的風險。
二、 選擇性血清素回收抑制劑 (selective serotonin reuptake inhibitors, SSRIs)
SSRIs 在躁動和偏執妄想上的治療效果並不一致,但仍有一定程度的療效,尤其當症狀來自於情緒疾患時。此類藥物中臨床效益較為明確的藥物為 citalopram (表一),常用劑量為每天10-20 mg,且要注意六十歲以上病人的最大劑量為一天20 mg,有心律不整病史或風險的病人要避免使用,例如:先天性 QT 波延長的病人、低血鉀、低血鎂和其他心臟疾病,有時在治療初期會合併抗精神病藥物使用幾週,因為 SSRIs 的藥效發揮需要一段時間。若突然停用藥物,可能加劇憂鬱症狀,明顯惡化其他精神症狀,所以欲停用 citalopram 須慢慢減量,不可立即停用。
伍、憂鬱症狀
要準確診斷出失智症患者的憂鬱症狀是很困難且複雜的,首先必須鑑別診斷憂鬱症患者的假性失智症或是失智症患者的憂鬱症狀,尤其是老年人更難以判別,臨床上建議某些嚴重、難以診斷的病人,可以嘗試以抗憂鬱劑開始治療10。藥物的選擇上,因為三環抗憂鬱藥 (tricyclic antidepressants) 具有抗膽鹼副作用,且可能會惡化困惑症狀,較不適合這類病人,因此建議使用SSRIs (表一) ,而 SSRIs 的選用則可考量副作用、藥物間交互作用及價格。Fluoxetine 的半衰期較長且比起其他 SSRIs 有較多的交互作用,所以不適合老年人使用;paroxetine 在 SSRIs 中的抗膽鹼作用是最強的;citalopram 不但能夠改善精神及行為症狀且能夠治療憂鬱,但使用在老年人的劑量不超過一天20 mg;sertraline 則可作為 citalopram 的替代藥物;而非典型抗憂鬱藥物,如 venlafaxine 和 bupropion 目前在這一類病人的研究還不足。
表一 失智症的精神相關症狀治療藥物8,9
陸、疼痛的評估及治療
疼痛也是會影響失智症患者精神及行為的重要因素,因此不論是在哪個階段的失智症,都應積極地進行疼痛評估及控制。輕度至中度失智症的老年人能夠表達自己的疼痛,透過面談與觀察了解疼痛造成的影響及持續時間,或是因為遭受其他壓力所導致的疼痛。但重度失智症的患者無法自行說明疼痛,臨床醫師必須依賴照顧者描述,或使用觀察工具進行疼痛評估,其中最常使用的是晚期失智症疼痛評估量表 PAIN AD (Pain Assessment in Advanced Dementia)11 (表二),藉由五個項目的行為觀察進行評分:呼吸 (breathing independent of vocalization)、負向發聲 (negative vocalization)、面部表情 (facial expression)、肢體語言 (body language) 以及可安撫性 (consolability),每個項目最高為2分,總分為10分,分數越高表示疼痛越嚴重。
表二 晚期失智症疼痛評估量表 (PAIN AD)11

而在使用疼痛控制藥物時需要把握以下原則。一、規律地使用止痛藥,需要時使用無法達到有效止痛;二、由低效的藥物開始,若必要再逐漸地使用中效、強效;三、由低劑量開始處方,並緩慢地增加劑量至足夠即可;四、小心地監測病人藥物治療的效果和藥品副作用,此部分可由病人的精神症狀和認知功能可觀察到疼痛是否有獲得良好的控制。
柒、睡眠障礙
睡眠障礙是這類病人非常常見的症狀,影響了超過25-35%的病人12,造成的因素有很多,大致上可歸因於憂鬱、緊張、白天的活動量降低、夜尿、或是藥品引起的副作用,如 cholinesterase inhibitors 使病人多夢。一開始的治療還是傾向於非藥物治療,可以安排運動或活動計畫、盡量避免白天的睡眠時間、傍晚之後就不要飲用酒精、咖啡、飲料等、延後上床睡覺的時間,逐漸調整自己的睡眠習慣。若是真的需要使用藥物治療,可以嘗試低劑量的 melatonin (1-5 mg 單獨使用或合併 light therapy) 或 trazodone,而 benzodiazepines 及 antihistamines 皆因考量副作用不適合這類病人使用。
捌、結語
隨著失智症的罹病率不斷攀升,對病人、家人、或照顧者來說,除了對記憶力退化感到無力,失智症的精神症狀所引發的照護難題及醫療成本更應同樣受到重視,在治療過程中,除了定時追蹤病人的病程發展與治療進展外,也要特別關懷主要照顧者的身心狀態,因為照顧這類病人承受極大的壓力,甚至容易遭到病人的誤解、責罵,適時地給予照顧者支持將有助於病人居家治療並且穩定病情的發展。
Management of Neuropsychiatric Symptoms of Dementia
Ying-Chen Lu, Pei-Tzu Lin, Yu-Shih Lin
Department of Pharmacy, Chiayi Chang Gung Memorial Hospital
Abstract
Dementia is a modern plague that is usual known as a neurodegenerative disease. Neuropsychiatric symptoms are extremely common and often much more troubling than amnestic symptoms. Non-pharmacologic therapies can effective use in patients with mild to moderate agitation, and cholinesterase inhibitors may also have benefit for cognition. When the symptoms become worse or with severe aggression, pharmacologic therapy may be necessary. The low doses atypical neuroleptics of olanzapine or risperidone are first line. The selective serotonin reuptake inhibitors (SSRIs) are suggested for the treatment of depression in dementia and citalopram is often used. Non-pharmacologic strategies, including maintenance of good sleep hygiene are generally preferred in managing sleep disturbances, but pharmacotherapy can be considered if insomnia is refractory.
參考資料:
1.Mega MS, Cummings JL, Fiorello T, et al: The spectrum of behavioral changes in Alzheimer's disease. Neurology 1996;46:130-5.
2. Ayalon L, Gum AM, Feliciano L, et al: Effectiveness of nonpharmacological interventions for the management of neuropsychiatric symptoms in patients with dementia: a systematic review. Archives of Internal Medicine 2006;166:2182-8.
3. Sink KM, Holden KF, Yaffe K. Pharmacological treatment of neuropsychiatric symptoms of dementia: a review of the evidence. Journal of the American Medical Directors Association 2005;293:596-608.
4. Padala PR, Burke WJ, Shostrom VK, et al: Methylphenidate for apathy and functional status in dementia of the Alzheimer type. The American Journal of Geriatric Psychiatry 2010;18:371-4.
5. Borson S, Raskind MA. Clinical features and pharmacologic treatment of behavioral symptoms of Alzheimer's disease. Neurology 1997;48:17S-24S.
6. Lonergan E, Luxenberg J, Colford JM, et al: Haloperidol for agitation in dementia. Cochrane Database of Systematic Reviews 2002:No.: CD002852.
7. Wang PS, Schneeweiss S, Avorn J, et al: Risk of death in elderly users of conventional vs. atypical antipsychotic medications. New England Journal of Medicine 2005;353:2335-41.
8. American Geriatrics Society Guideline: Management of psychotic disorders in older adults. http://www.nhqualitycampaign.org/files/AGS_Guidelines_for_Telligen.pdf (Approved by the AGS executive committee in April 2011).
9. Press D, Alexander M. Management of neuropsychiatric symptoms of dementia. In: UpToDate, Post TW (Ed), UpToDate, Waltham, MA. (Accessed on Feb 11, 2015.).
10. Jones BN, Reifler BV. Depression coexisting with dementia. Evaluation and treatment. The Medical clinics of North America 1994;78:823-40.
11. Warden V, Hurley AC, Volicer L. Development and psychometric evaluation of the Pain Assessment in Advanced Dementia (PAINAD) scale. Journal of the American Medical Directors Association 2003;4:9-15.
12. Deschenes CL, McCurry SM. Current treatments for sleep disturbances in individuals with dementia. Current psychiatry reports 2009;11:20-6.

