摘要
免疫系統的T細胞 (T lymphocytes,T cells) 表面存在許多的受體,這些受體依照與其相對應的配體 (ligand) 結合後的免疫反應而分為兩群,一群為正向的活化免疫系統之受體 (co-stimulatory receptors) 如 CD28 (cluster of differentiation 28;白血球分化抗原28)、OX40 (TNF receptor superfamily member 4; TNFRSF4又名CD134)、4-1BB (TNF receptor superfamily 9) 等,另一群為負向的抑制免疫系統之受體 (co-inhibitory receptors) 如 CTLA-4 (cytotoxic T-lymphocyte-associated antigen 4)、PD-1 (programmed cell death 1)、LAG-3 (lymphocyte activation gene 3;又名 CD223) 等,這些調控T細胞免疫反應之活化或抑制的所有訊號統稱為免疫檢查點 (immune checkpoint)。T細胞上的免疫檢查點是調控免疫反應的重要機制,藉由活化免疫系統可對抗外來或異體的抗原,以及抑制免疫系統來維持自我耐受性 (self tolerance) 避免自體免疫傷害,最後維持免疫平衡 (immune homeostasis)1-4。
CTLA-4及 PD-1抑制劑已經開始用於部分癌症之治療,從臨床試驗數據看來效果良好。2014年唐獎第一屆生技醫藥獎頒發給研究 CTLA-4及 PD-1抑制劑來抗癌的學者艾利森 (James P. Allison) 與本庶佑 (Tasuku Honjo) 博士,表彰他們在癌症治療上的貢獻。
關鍵字:免疫檢查點、免疫檢查點抑制劑、immune checkpoint、immune checkpoint inhibitors
壹、前言
癌症免疫療法 (cancer immunotherapy) 的概念就是用各種提升癌症病人免疫能力的方法來對抗癌細胞,達到治療的目的。從1891威廉.柯里醫師 (William Coley) 提出類似概念來治療癌症患者已經有一百多年的歷史1,專家學者們嘗試了眾多的方法如注射干擾素 (interferon)、介白素2 (IL-2、Interleukin-2)、癌症疫苗 (tumor vaccine) 等等,隨著T細胞表面免疫檢查點的發現,癌症的治療露出了曙光。目前研究最多的免疫檢查點蛋白就屬 CTLA-4及 PD-1,兩者都屬於抑制性的調控免疫作用,訊號經由其所配對的配體 (ligand) 傳入後,對體內T細胞產生抑制作用。
CTLA-4最早於1987年由 Brunet JF 等學者發表於 Nature 期刊3,當時暸解到 CTLA-4屬於免疫球蛋白超家族 (the immunoglobulin superfamily) 的一員,並與同家族其他蛋白有交互作用 (interaction)。1995年美國艾利森等學者證明 CTLA-4的抗體可以阻斷T細胞抑制性訊息,而達成活化T細胞殺死癌細胞的活性,並由老鼠實驗發現 CTLA-4抑制劑具有抗腫瘤的效果,再經過多年的研究,兩個主要第三期臨床試驗證明對末期轉移性黑色素瘤患者有顯著治療效果後,2011年美國 FDA 核准了第一個 CTLA-4抑制劑 ipilimumab 上市。
1992由日本學者本庶佑的研究團隊在研究細胞程序性凋亡的相關蛋白時,在T細胞上發現 PD-1,當時暸解到 PD-1屬於免疫球蛋白超家族的一員。後續的研究將老鼠 PD-1基因剔除,老鼠產生自體免疫疾病,推測 PD-1屬於抑制性的調控免疫作用5。隨著 PD-1的配體 PD-L1及 PD-L2的發現以及多種癌症細胞表面表現著 PD-L1來抑制T細胞活性,學者們試著透過阻斷 PD-1的免疫抑制作用來活化免疫反應以之設計藥品。經過多個第三期臨床試驗後,美國 FDA 於2014及2015年各核准了一個 PD-1抑制劑 pembrolizumab 及 nivolumab 上市。
貳、免疫檢查點的免疫調節
自體抗原 (如被病毒感染的細胞、癌細胞) 的清除主要由T細胞來執行,這也是為何在癌症治療上研究如何活化T細胞顯得很重要6。在抗癌的免疫機轉中 (圖一)1,初期 (priming phase) 活化T細胞需要兩個重要訊號,首先由抗原呈現細胞 (antigen presenting cell, APC) 一般是樹突狀細胞 (dendritic cell) 於周邊組織器官藉由胞飲作用得到的癌細胞抗原,經過抗原處理 (antigen processing) 將抗原形成胜肽片段,由此促使樹突狀細胞成熟 (maturation)。之後移動到淋巴結,利用自體的主要組織相容性複合體 (major histocompatibility complex, MHC) 將此胜肽片段藉由T細胞上的受體 (T cell receptor,TCR) 呈現給T細胞,此為第一訊號。接著樹突狀細胞配體 B7-1(CD80) 或 B7-2(CD86) 與T細胞的另一受體 CD28結合,此為第二訊號。這兩個訊號活化了T細胞,並促使T細胞增殖 (proliferation) 及分化 (differentiation)。T細胞活化後,抑制性受體 CTLA-4會增加表現,避免T細胞過度活化造成自體免疫性的傷害 (圖二)3。
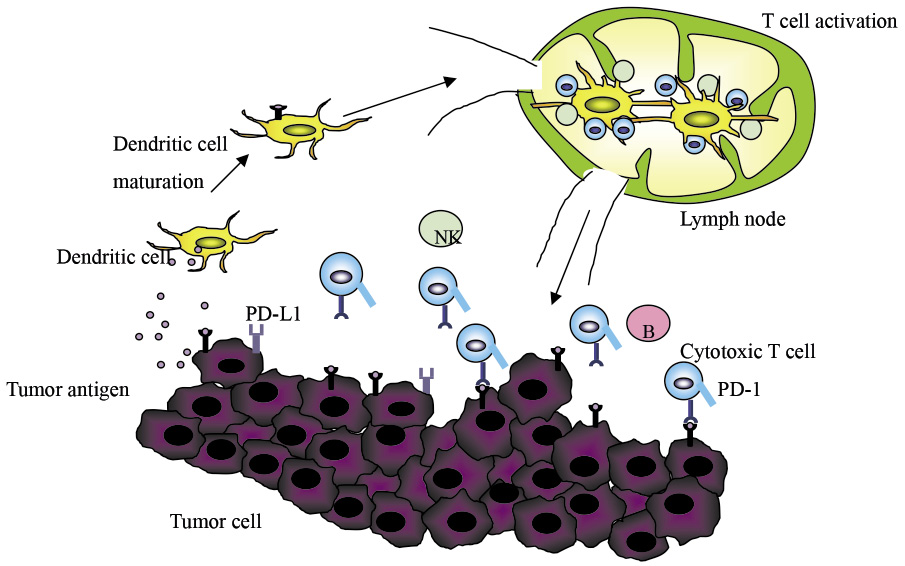
圖一 免疫系統對抗癌細胞機轉示意圖1
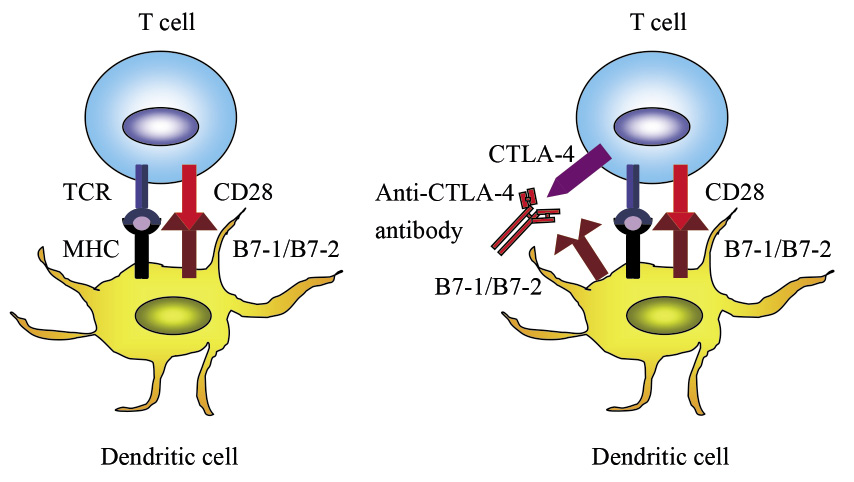
圖二 初期的免疫反應T細胞活化及抗CTLA-4抗體之作用3
活化後的T細胞離開淋巴結,隨著血液循環至腫瘤微環境 (tumor microenvironment) 後進行免疫監控 (immune surveillance),遭遇腫瘤細胞後,T細胞藉由 TCR 與腫瘤細胞上帶有抗原的 MHC 結合完成辨識後,細胞毒性T細胞 (cytotoxic T cell) 會利用自身穿孔素 (perforin)、粒酶 (granzyme)、顆粒溶素 (granulysin) 等,直接毒殺腫瘤細胞;輔助T細胞 (helper T cell) 會分泌干擾素 (IFN-γ)、細胞激素 (cytokines) 等協助對抗腫瘤細胞。
相對的腫瘤細胞也有許多的逃避免疫監控及抑制免疫系統機制6,例如表現出 PD-L1 (PD-1配體),藉由結合 PD-1來抑制免疫細胞活性就是其中的一種2。科學家們利用這些特點開發出 PD-1及 PD-L1抑制劑,讓 PD-1及 PD-L1無法結合 (圖三)3,避免T細胞失效 (anergy)。
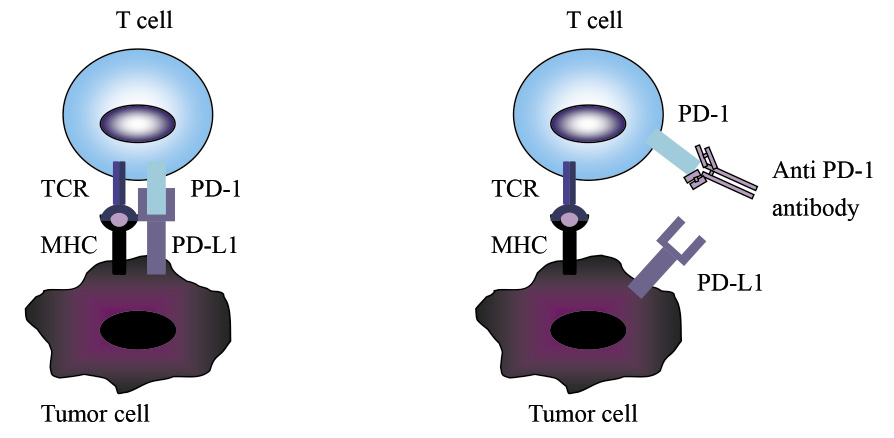
圖三 T細胞被腫瘤細胞抑制活性及抗 PD-1抗體之作用3
參、抑制性的免疫檢查點抑制劑
一、CTLA4 blocking antibody
Ipilimumab 是一個經過基因重組的人類免疫球蛋白 IgG1 kappa 同型的單株抗體,分子量約148KDa,衛生福利部核准用於治療成人曾接受其他療法之無法切除或轉移性黑色素瘤。兩個第三期臨床試驗證實了 ipilimumab 比起傳統治療方法可延長病人存活時間4,第一個臨床試驗為一個跨國、隨機、雙盲的第三期試驗,試驗對象為已接受過藥物治療,無法開刀切除的第三期或第四期黑色素瘤病人共676人,隨機分成三組,第一組使用 ipilimumab 加上癌症疫苗 glycoprotein 100 (gp 100),第二組單獨使用 ipilimumab,第三組單獨使用 gp 100。三組的整體存活期中位數 (median overall survival) 依序為10.0個月、10.1個月及6.4個月。
第二個臨床試驗為一個跨國、隨機、雙盲的第三期試驗,試驗對象為未接受過藥物治療,無法開刀切除的第三期或第四期黑色素瘤病人共502人,隨機分成二組,第一組合併使用 ipilimumab 及化療藥品 dacarbazine,第二組使用 dacarbazine 與安慰劑。兩組的整體存活期中位數分別為11.2個月、9.1個月,病人的1年存活率分別為47.3%及36.3%;2年存活率分別為28.5%及17.9%;3年存活率分別為20.8%及12.2%。
二、PD-1 blocking antibodies
(一)Nivolumab 是一個經過基因重組的人類免疫球蛋白 IgG4 kappa 同型的單株抗體,分子量約146KDa,美國 FDA 核准用於治療無法開刀及轉移性黑色素瘤、轉移性非小細胞肺癌與晚期腎細胞癌。針對不同癌症,nivolumab 進行了數個臨床試驗,本文列舉四個如下:第一個臨床試驗為一個隨機、雙盲的第三期試驗7,試驗對象為無藥物治療過,無法開刀切除的第三期或第四期黑色素瘤病人共945人,隨機分成三組,第一組使用 nivolumab 及安慰劑,第二組使用 nivolumab 加 ipilimumab,第三組使用 ipilimumab 及安慰劑。三組的無疾病惡化存活期中位數 (median progression-free survival) 依序為6.9個月、11.5個月及2.9個月。
第二個臨床試驗為一個跨國、隨機、開放性的第三期試驗8,試驗對象為疾病持續惡化的晚期麟狀非小細胞肺癌病人共272人,隨機分成二組,第一組使用 nivolumab,第二組使用化療藥品 docetaxel,整體存活期中位數分別為9.2個月、6.0個月,病人的1年存活率分別為42%及24%,與治療相關 grade 3或4不良反應發生率依序為7%及55%。
第三個臨床試驗為一個跨國、隨機、開放性的第三期試驗9,試驗對象為疾病持續惡化的晚期非麟狀非小細胞肺癌病人共582人,隨機分成二組,第一組使用 nivolumab,第二組使用化療藥品 docetaxel,整體存活期中位數分別為12.2個月、9.4個月,病人的1年存活率分別為51%及39%,與治療相關 grade 3或4不良反應發生率依序為10%及54%。
第四個臨床試驗為一個跨國、隨機、開放性的第三期試驗10,試驗對象為已接受過血管抑制 (sunitinib、pazopanib、axitinib 等酪胺酸激酶抑制劑) 治療的晚期透明細胞型腎細胞癌 (clear-cell renal cell carcinoma) 病人共821人,隨機分成二組,第一組使用 nivolumab,第二組使用口服標靶藥品 mTOR 抑制劑 everolimus,整體存活期中位數為25.0個月、19.6個月,客觀反應率 (objective response rate) 為25%、5%,無疾病惡化存活期中位數為4.6個月、4.4個月,與治療相關 grade 3或4不良反應發生率為19%及37%。
(二)Pembrolizumab 是一個經過基因重組的仿人類免疫球蛋白 IgG4 kappa 同型的單株抗體,分子量約149KDa,衛生福利部已核准用於治療無法以手術移除或轉移性黑色素細胞瘤,且在使用 ipilimumab 及 BRAF 抑制劑治療後出現疾病惡化現象的患者。
KEYNOTE-6是一個隨機有對照組的第三期臨床試驗11,試驗對象為藥物治療過,無法切除的第三期或第四期黑色素瘤病人共834人,隨機分成三組,第一組每兩週注射 pembrolizumab,第二組每三週注射 pembrolizumab,第三組每三週注射 ipilimumab;共注射四次。病人的12個月存活率依序為74.1%、68.4%、58.2%,無疾病惡化存活期中位數為5.5個月、4.1個月、2.8個月,與治療相關 grade 3到5不良反應發生率為13.3%、10.1%及19.9%。
肆、未來展望與結論
從上述的臨床試驗數據證明,在部分癌症的治療上,由於使用 CTLA-4及PD-1抑制劑,有效地延長病人存活期,不良反應的發生率比起傳統治療藥品低。而在藥品的合併使用上,無論是併用兩種免疫檢查點抑制劑,或是免疫檢查點抑制劑與化療藥品併用,效果比使用單一藥品來得好。但這只是個起點,免疫檢查點尚有數個影響免疫調控的蛋白正在研究中 (圖四)1,期待未來有更多的新藥加入及更好的效果出現。
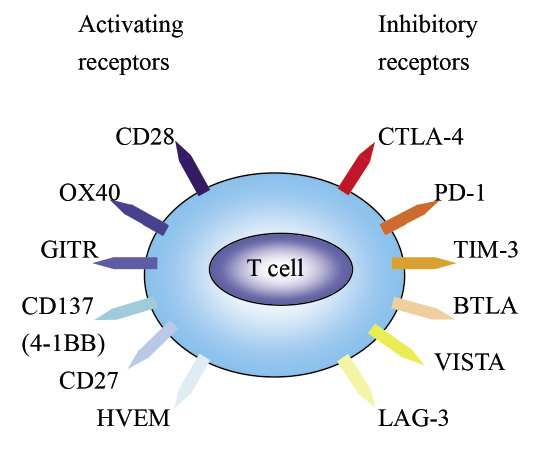
圖四 免疫檢查點免疫調控蛋白1
Immune Checkpoint Inhibitors, The New Strategy Against Cancer
Chun-Yi Chuang1, Chun-Ping Lin2, Kai-Kuang Chang3, Chin-Ning Wu4, Chiu-Jen Wu5
Department of Pharmacy, Yuanli Lee’s General Hospital, Lee’s Medical Corporation1
Department of Medical laboratory, Yuanli Lee’s General Hospital, Lee’s Medical Corporation2
Department of Radiology, Yuanli Lee’s General Hospital, Lee’s Medical Corporation3
Department of Nursing, Yuanli Lee’s General Hospital, Lee’s Medical Corporation4
Department of Pharmacy, Miao-Li General Hospital, Department of Health5
Abstract
There are a number of known receptors that exist in surface of T cells. Depending on immune responses of the interactions among the receptors and ligands, these receptors are divide into two groups. One group provides positive signals to activate immune system so called co-stimulatory receptors, including CD28, OX40 and 4-1BB. The other group provides negative signals to inhibit immune system so called co-stimulatory receptors, including CTLA-4, PD-1 and LAG-3. These co-stimulatory and inhibitory signals provided by interaction of receptors and ligands are called immune checkpoints. Immune checkpoints are crucial for the maintenance of self-tolerance and also to protect tissues from damage during the immune system responding to pathogenic infection. Finally immune checkpoints can regulate immune system to maintain self tolerance to avoid autoimmune damage and to keep immune homeostasis.
CTLA-4 and PD-1 inhibitors have been well used in cancer therapy. The 2014 Tang Prize in Biopharmaceutical Science is awarded to James P. Allison and Tasuku Honjo for their outstanding research of CTLA-4 and PD-1 as immune inhibitory molecules to lead the applications in cancer immunotherapy.
參考資料:
1. Ira Mellman, George Coukos and Glenn Danoff: Cancer immunotherapy comes of age. Nature 2011;480:480-489.
2. Drew M. Pardoll: The blockade of immune checkpoints in cancer immunotherapy. Nature Reviews cancer 2012;12:252-264.
3. Chrisann Kyi, Michael A. Postow: Checkpoint blocking antibodies in cancer immunotherapy. FEBS Letters 2014;588:368-376.
4. 張景明、張金堅: 從第一屆唐獎生技醫藥獎談癌症免疫治療的展望。台灣醫界2014;57(No.9):17-22.
5. Taku Okazaki and Tasuku Honjo: PD-1 and PD-1 ligands: from discovery to clinical application. International Immunology 2007; 19(No.7): 813-824.
6. 王聖予、李淑英、林智暉,免疫生物學免疫系統的正常與疾病第六版。新北市,藝軒圖書出版社,2005:630-642。
7. J. Larkin, V. Chiarion-Sileni, R. Gonzalez, et al: Conbined Nivolumab and Ipilimumab or Monotherapy in Untreated Melanoma. N Engl J Med 2015; 373:23-34.
8. Julie Brahmer,Karen L. Reckamp, Paul Bass, et al: Nivolumab versus Docetaxel in Advanced Squamous-Cell Non-Small-Cell Lung Cancer. N Engl J Med 2015; 373:123-35.
9. Hossein Borghaei, Luis Paz-Ares, Leora Horn, et al: Nivolumab versus Docetaxel in Advanced Nonsquamous-Cell Non-Small-Cell Lung Cancer. N Engl J Med 2015; 373:1627-39.
10. R. J. Motzer, B. Escudier, D. F. McDermott, et al: Nivolumab versus Everolimus in Advanced Renal-Cell Carcinoma. N Engl J Med 2015; 373:1803-13.
11. Caroline Robert, Jacob Schachter, Georgina V. Long, et al: Pembrolizumab versus Ipilimumab in Advanced Melanoma. N Engl J Med 2015; 372:2521-32.

