摘要
GOLD (Global Initiatives for Chronic Obstructive Lung Disease) 治療指引指出,適當的藥物治療可以減少慢性阻塞性肺病 (chronic obstructive lung disease, COPD) 症狀、惡化頻率及嚴重度,且可以改善生活型態及運動耐受性,針對 B、C 及 D 病人族群,可選擇合併使用長效蕈毒鹼性拮抗劑 (long-acting muscarinic antagonist, LAMA) 及長效乙二型交感神經致效劑 (long-acting beta-2 agonist, LABA) 給予治療。Umeclidinium/vilanterol 是美國 FDA 及歐盟核准全球第一個合併 LAMA 及 LABA 之吸入劑,1天乙次用來治療 COPD 呼吸道阻塞相關問題,許多臨床研究證實可用來改善 COPD 肺功能、呼吸困難及健康有關的生活品質,且可以降低惡化率並伴隨沒有嚴重性的副作用。
關鍵字:慢性阻塞性肺病、COPD、LAMA、LABA
壹、前言
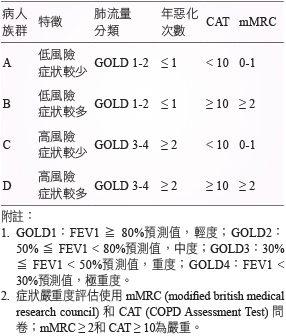
慢性阻塞性肺病是常見、可預防及可治療疾病,其特徵是呼吸氣流受到限制但不是完全可逆。肺功能量器 (Spirometry) 是常見用來作為診斷 COPD 的工具,通常在給予吸入性短效乙二型交感神經致效劑 (Short-acting beta-2 agonist, SABA),測定之第1秒用力呼氣容積 (Forced expiratory volume in 1 second, FEV1) 來評估 COPD 嚴重程度,依據全球慢性阻塞性肺病倡議組織 (GOLD) 將其程度區分 GOLD 1-4,另依 COPD 年預期惡化風險性及病人自覺症候嚴重度等結果,將病人區分 A、B、C 及 D 等四組病人族群 (表一)1。
表一 COPD 病人族群分類
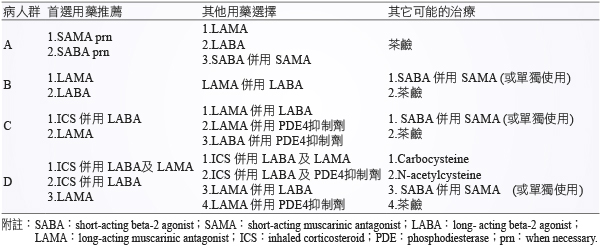
支氣管擴張劑是 COPD 第一線選擇用藥,GOLD 將 LAMA、LABA 等單獨製劑列為用來治療 COPD 病人族群 B、C 及 D 之首選推薦藥物 (表二),市面上亦有許多這些類的產品可供臨床用藥選擇。但在一個橫斷式 (cross-sectional) 研究 (n = 1,072),多數病人在使用單獨支氣管擴張器劑,如 tiotropium (TIO, 76%),formoterol (14%) 及 salmeterol (9%),結果顯示給予這些藥物1-2年後,病人仍感到呼吸困難、症狀惡化及較差之生活品質等現象2。因此,在考量不給予吸入性類固醇製劑,GOLD 建議可以併用 LABA 與 LAMA 來治療 COPD,惟在合併使用兩種不同製劑情況下,常導致病人不佳用藥順從性,進而影響治療效果。因此,新一代 LABA 併用 LAMA 吸入性固定劑量包裝產品可改善這方面的問題,並可提供臨床上較佳之療效。
表二 COPD 病人族群與藥物治療選擇
貳、 新型 LABA 及 LAMA 合併吸-umeclidinium/vilanterol (UMEC/VI)
一、藥理機轉
許多研究已顯示合併使用 LAMA 及 LABA,對於肺功能 (FEV1) 改善有很大的幫助,吸入型 UMEC/VI 為併用兩種不同藥理機轉之新一代支氣管擴張劑,UMEC 屬於 LAMA 且作用在 M3接受器,VI 則為 LABA 而作用在β2接受器,藉由減少各別藥物投予劑量,可減少副作用的產生。UMEC/VI 是美國 FDA 及歐盟全球第一個核准吸入器內有二種長效支氣管擴張劑藥物,劑量各為55 mcg 及22 mcg3。
二、藥物動力學特質
在一個 UMEC、VI 及 UMEC/VI 給藥研究中顯示,UMEC 持續以單一劑量給藥10天後可達血中穩定濃度,但 VI 則較難評估,UMEC/VI 若持續以62.5/25 μg 給藥10天,投藥後5分鐘可到達血中最高濃度,其濃度為205 pg/mL (各別為171, 245);相較給藥1日,亦可5分鐘後達最高血中藥物濃度 (Cmax),但濃度為163.8 (142, 189.1),約4小時則無法測得血中濃度,其半衰期為1.8小時4。UMEC 及 VI 蛋白質結合率各為89%及94%,UMEC 及 VI 透過肝臟 CYP2D6及 CYP3A4代謝,排除半衰期為11小時。在排除方面,小於1% UMEC 以尿液形式排除、VI 則有70%;92% UMEC 以糞便形式排除、VI 則有30%。UMEC/VI 懷孕分級為C,授乳方面尚未確定,在嚴重腎功能不全患者使用 UMEC/VI 則不須調整劑量5,雖 UMEC/VI 透過肝臟代謝,但與 CYP3A4抑制劑似乎較不會發生藥物交互作用6。
三、臨床試驗
(一)治療效果
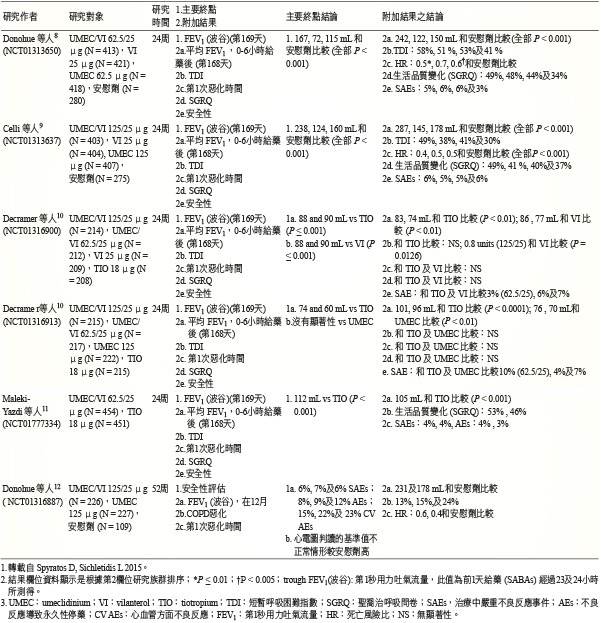
在一篇回顧性文章提及六個研究,其中五個研究為期12周,一個長達一年,合計超過6千個病人,結果顯示 UMEC/VI 可以改善肺功能、呼吸困難及有關的生活品質,且可減少惡化及無發現嚴重的副作用 (表三)7。NCT01313650研究結果顯示 UMEC/VI 62.5/25 mcg 有很好耐受性8,可提供臨床上 COPD 顯著性的肺功能改善,對於生命跡象、心電圖等沒有臨床顯著性改變8。NCT01313637研究顯示1天1次的 UMEC/VI 125/25 μg 相較 UMEC 及 VI 有較佳耐受性、肺功能、健康狀態與呼吸困難分數改善,可用來長期治療 COPD9。NCT01316900及 NCT01316913研究顯示所有實驗組皆可改善呼吸困難、健康相關生活品質,但對改善症狀、健康狀態、惡化風險則注意到沒有顯著性差異,另在生命跡象或心電圖則皆沒有差異性的改變10。NCT01777334研究顯示 UMEC/VI 較 TIO 有顯著性臨床之肺功能改善,且有較高耐受性,並對於中度及極重度 COPD 病人提供新的有效的選擇11。NCT01316887研究顯示 LABA 及 LAMA 經過12個月治療 COPD 病人,長期治療可提供較好的改善結果12。
表三 UMEC/VI 隨機對照臨床試驗
(二)安全性
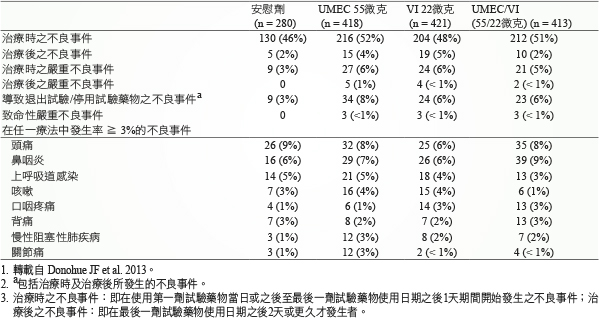
接受 UMEC/VI 治療病人所引發的不良反應 (treatment-emergent adverse events, TEAEs) 中,發生頻率最高為頭痛 (8%)、鼻咽炎 (9%) 及上呼吸道感染 (3%);導致退出試驗或停用試驗藥物之不良事件不常發生,UMEC/VI 6%、安慰劑3%;治療時發生嚴重不良反應事件中,UMEC/VI 6%、安慰劑3% (表四)8。另外,在一項為期28天研究中,UMEC/VI 一天一次給予中度至極重度 COPD 中,顯示病人對於藥物有使用不錯之耐受性,對照安慰劑,在心跳、血壓或曲線下面積 (AUC) 及 Cmax 方面無明顯差異變化13。
表四 UMEC、VI、UMEC/VI 及安慰劑不良事件比較
參、健保給付及相關規定
我國衛生福利部食品藥物管理署於103年6月30日核准 UMEC/VI 藥物許可證,劑量為55/22 mcg,另中央健保署自104年5月1日將此藥納入健保給付範圍,核准之適應症為「慢性阻塞性肺病 (COPD) 患者之氣道阻塞症狀的維持治療」,其給付規定則依照健保署公告之「成人呼吸道疾患吸入製劑給付規定表」辦理。
肆、建議劑量與注意事項
UMEC/VI (62.5/25 μg) 是美國第一個核准合併 LAMA 及 LABA 用來作為治療 COPD 的新一代藥物,包括肺氣腫、慢性支氣管炎之治療,研究結果一天乙次對於肺功能有不錯之作用,可提供 COPD 病人方便、有效及較滿意的藥物不良反應結果,對於中至重度 COPD 病人治療具有不錯之滿意效果,其中一個原因為可以改善服藥順從性14。在11個臨床試驗 (9,609病人) 顯示,此藥可較 UMEC、VI 改善肺功能及 COPD 惡化風險,但也注意到與 TIO 之間,在呼吸困難、健康狀態及 COPD 惡化風險方面,卻沒有明顯改善,另在安全性方面,後續關於不良事件、嚴重不良事件、嚴重心血管事件及死亡方面,在上市後使用方面仍需多加評估注意15。
伍、結論
COPD 病人服藥順從通常較差,主要原因在於用藥的頻率,而一天乙次服藥方式在這方面扮演很重要的角色,促使一天一次吸入劑在市面上變的更加普及,甚至併用兩種或三種這類藥物作為新藥發展已為一種趨勢,如:Glycopyrronium 合併 indacaterol;clidinium bromide 合併 formoterol;tiotropium 合併 olodaterol 等。新上市藥物 UMEC/VI 之合併,臨床許多研究顯示可用來作為長期治療 COPD 一種選擇,對於改善肺功能及避免惡化有不錯效果,惟在安全性方面,更有賴長上市後持續研究追蹤,以提供未來更多不同藥理機轉之長效型支氣管擴張劑這類藥物併用發展參考比較。
The New Combination Inhaler Umeclidinium/Vilanterol in the Treatment of COPD
Chia-Ching Shih, Chien-Cheng Li, Chun-Sheng Wei
Department of Pharmacy, Zuoying Branch of Kaohsiung Armed Forces General Hospital
Abstract
According to GOLD (Global Initiatives for Chronic Obstructive Lung Disease) guidelines, appropriate pharmacologic therapy can reduce COPD symptoms, reduce the frequency and severity of exacerbations, and improve health status and exercise tolerance. We can choose to combine long-acting muscarinic antagonists (LAMA) with long-acting beta-2 agonist (LABA) for patient group B, C and D. Umeclidinium/vilanterol received its first global approval in this indication in the USA and the European Medicines Agency an inhaled fixed-dose combination of a long-acting muscarinic antagonist and a long-acting β2-adrenergic agonist is indicated for once-daily, maintenance treatment of airflow obstruction in patients with COPD. Many clinical trials revealed that UMEC/VI can improve lung function, dyspnea, and health-related quality of life and decreased the exacerbation rate with no serious adverse events.
參考資料:
1.Global Strategy for Diagnosis, Management and Prevention of COPD, Global Initiative for Chronic Obstructive Lung Disease (GOLD) 2015. (Accessed on January 2015, at http://www.goldcopd.org.)
2. Dransfield MT, Bailey W, Crater G, et al: Disease severity and symptoms among patients receiving monotherapy for COPD. Primary Care Respiratory Journal. 2011; 20(1):46-53.
3. Umeclidinium and vilanterol. Drug information. UpToDate online. Available at http://www.uptodate.com. (cited: 14/05/2015).
4. Hu C, Jia J, Dong Ket, al: Pharmacokinetics and Tolerability of Inhaled Umeclidinium and Vilanterol Alone and in Combination in Healthy Chinese Subjects: A Randomized, Open-Label, Crossover Trial. PLoS One. 2015; 10(3): e0121264.
5. Mehta R, Hardes K, Brealey N, et al: Effect of severe renal impairment on umeclidinium and umeclidinium/ vilanterol pharmacokinetics and safety: a single-blind, nonrandomized study. Int J Chron Obstruct Pulmon Dis. 2014; 18(10):15-23.
6. Mehta R, Kelleher D: Preece A et al: Effect of verapamil on systemic exposure and safety of umeclidinium and vilanterol: a randomized and open-label study. Int J Chron Obstruct Pulmon Dis. 2013; 8:159-67.
7. Spyratos D, Sichletidis L: Umeclidinium bromide/vilanterol combination in the treatment of chronic obstructive pulmonary disease: a review. Ther Clin Risk Manag. 2015; 11:481-7.
8. Donohue JF, Maleki-Yazdi MR, Kilbride S, et al: Efficacy and safety of once-daily umeclidinium/vilanterol 62.5/25 mcg in COPD. Respir Med. 2013;107(10):1538-1546.
9. Celli B, Kilbride S, Mehta R, et al: Once-Daily Umeclidinium/Vilanterol 125/25 μg Therapy in COPD. A Randomized, Controlled Study. Chest. 2014;145(5):981-991.
10. Decramer M, Anzueto A, Kerwin E, et al: Efficacy and safety of umeclidinium plus vilanterol versus tiotropium, vilanterol, or umeclidinium monotherapies over 24 weeks in patients with chronic obstructive pulmonary disease: results from two multicentre, blinded, randomised controlled trials. Lancet Respir Med. 2014; 2(6):472-486.
11. Maleki-Yazdi MR, Kaelin T, Richard N, et al: Efficacy and safety of umeclidinium/vilanterol 62.5/25 mcg and tiotropium 18 mcg in chronic obstructive pulmonary disease: results of a 24-week, randomized, controlled trial. Respir Med. 2014; 108(12):1752-1760.
12. Donohue JF, Niewoehner D, Brooks J, et al: Safety and tolerability of once-daily umeclidinium/vilanterol 125/25 mcg and umeclidinium 125 mcg in patients with chronic obstructive pulmonary disease: results from a 52-week, randomized, double-blind, placebo-controlled study. Respir Res. 2014;15:78.
13. Feldman G, Walker RR, Brooks J, et al: 28-Day safety and tolerability of umeclidinium in combination with vilanterol in COPD: A randomized placebo-controlled trial.Pulmonary Pharmacology & Therapeutics. Pulm Pharmacol Ther. 2012; 25(6):465-71.
14. Albertson TE, Harper R, Murin S, et al: Patient considerations in the treatment of COPD: focus on the new combination inhaler umeclidinium/vilanterol. Patient Preference and Adherence. 2015; 9:235-242.
15. Rodrigo GJ, Neffen H: A systematic review on the efficacy and safety of a fixed-dose combination of umeclidinium and vilanterol for the treatment of COPD. Chest journal. 2015; doi:10.1378/chest.15-0084.

