摘要
膀胱過動症臨床症狀以尿液急迫感來表現,通常伴隨有頻尿和夜尿症,也可能伴隨急迫性尿失禁,但沒有明顯的病理疾病或是泌尿道感染。至今膀胱過動症治療藥物仍以抗毒蕈鹼藥物為主軸,近期 AUA/SUFU 於2015年發表的治療指引中,增加了第二線療法 β3-腎上腺受體作用劑和第三線的膀胱內注射肉毒桿菌毒素藥物。本文章即針對膀胱過動症的治療藥物發展近況作全面性介紹並進行討論,以提供臨床藥物選擇參考,使病人獲得最好的治療效果和最少的副作用產生。
關鍵字:膀胱過動症、overactive bladder、antimuscarinics、β3- adrenoceptor agonists、botulinum toxin
壹、前言
膀胱過動症 (overactive bladder, OAB) 是一種綜合性病徵,它不是一種疾病。臨床症狀以尿液急迫感來表現,通常伴隨有頻尿和夜尿症,也可能伴隨急迫性尿失禁,但沒有明顯的病理疾病或是泌尿道感染1。根據流行病學趨勢調查,在2008年全球約有4.55億成年人罹患膀胱過動症,預估到2018年將增至5.46億人。其中亞洲罹病人數增幅高達22.1%,盛行率為10.9%,即每十人就有一人有膀胱過動症。罹病率隨年齡增加而增加,其中女性的發生率 (11.9%) 高於男性 (9.8%)2。根據美國泌尿科學會 (American Urological Association, AUA) 和美國尿流動力及婦女泌尿學醫學會 (Society of Urodynamics, Female Pelvic Medicine and Urogenital Reconstruction, SUFU) 針對非神經性膀胱過動症所建議的治療及近期更新診療指引,其第一線療法皆為行為治療。第二線療法則以非侵入性抗毒蕈鹼藥物 (antimuscarinics) 或 β3-腎上腺接受體作用劑 (β3-adrenergic receptor agonists) 藥物治療。當第一線行為治療和第二線非侵入性藥物治療後仍未見改善,或出現無法耐受的不良反應時,可考量使用第三線療法包含神經電刺激或肉毒桿菌毒素等方式治療3,4。膀胱過動症雖然不會直接危及生命,但可能導致生活品質下降,顯著影響病人的社交、心理、職業、家庭和自尊5。因此,在本文章將針對膀胱過動症的治療藥物進行介紹及了解藥物發展近況和討論,以提供臨床給藥參考,使病人獲得最好的治療效果。
貳、膀胱排尿和儲尿生理機制 (功能)
膀胱的正常運作主要依賴於自主神經 (交感和副交感) 系統在逼尿肌對儲尿和排尿期間張力的平衡6。逼尿肌上具有M3和M2等毒蕈鹼受體來負責逼尿肌之收縮,且其中以M3受體最重要7。當引起膀胱收縮的神經傳導物質乙醯膽鹼作用在M2或M3毒蕈鹼受體時,經由結合G蛋白,活化 phospholipase C,產生三磷酸肌醇 (inositol triphosphate),進而使鈣離子從肌質網釋放,使得膀胱平滑肌收縮。M2受體則透過抑制腺苷酸環化酶 (adenylate cyclase) 活性和降低細胞內的環磷酸腺苷 (cAMP) 的濃度而導致膀胱收縮7。近年來的研究也發現,β3-腎上腺素接受體在逼尿肌細胞膜上也扮演重要的角色。在膀胱儲存尿液的過程中,刺激 β3-腎上腺接受體後,經由 cAMP 濃度增加的路徑使得逼尿肌放鬆,而抑制不自主收縮的產生8。但當膀胱脹滿尿液開始收縮時,β3-腎上腺接受體的角色便減弱,此時,膀胱是以毒蕈鹼受體所產生的收縮為主要的反應7。因此逼尿肌中藉由毒蕈鹼受體與 β3-腎上腺素接受體之間的平衡,來控制儲尿和排尿之過程8。
膀胱過動症的主要問題在於逼尿肌的活性過強,因此主要治療方法為抑制逼尿肌的收縮來調解排尿機轉6。不過每一位病人的病因並不全然由同一個機轉所造成,透過分析病人膀胱過動症的致病機轉並給與適當的治療,才能達到症狀改善。
參、治療藥物藥理分類
治療膀胱過動症的藥物至今仍以抗毒蕈鹼藥物為主,最新核准使用的藥物為 β3-腎上腺接受體作用劑和肉毒桿菌毒素 (膀胱內注射)4。下列將主要治療藥物如抗毒蕈鹼藥物、β3-腎上腺接受體作用劑、肉毒桿菌毒素和其他臨床上用於輔助治療的藥物 (表一),進行介紹及討論。
表一 膀胱過動症和急迫性尿失禁治療藥物之證據等級和建議強度4-9
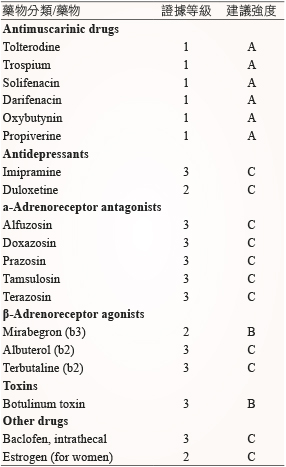
一、抗毒蕈鹼藥物
毒蕈鹼受體有五種亞型 (M1-5),存在於人體各組織器官中。膀胱中則存在M2及M3兩種受體,逼尿肌收縮主要由M3受體調控,因此抗毒蕈鹼藥物至今仍是膀胱過動症最常使用和最先被選擇的治療藥物等 (表二)9。作用機轉是抑制膀胱收縮的強度,提高膀胱容量並減少不自主逼尿肌收縮、尿急和頻尿6。
抗毒蕈鹼藥物之間因結構式和分子量的不同,產生藥物動力學上包括吸收、代謝、效力強度和對受體選擇性等的差異 (表二)7,9。抗毒蕈鹼藥物為 amine 類結構式,其中三級胺為於親脂性,容易由胃腸道吸收,故口服身體可用率佳,但較易穿過血腦障壁,產生中樞神經系統的意識混淆和視力模糊等副作用,相對於四級胺為親水性,無法穿過血腦障壁,但會影響藥物在胃腸道的吸收率。另外藥物代謝及排除途徑也會影響藥物選擇,如經肝臟 CYP-450代謝藥物容易與相同代謝途徑藥物產生交互作用,特別是容易發生在年紀大服用多種藥物的患者上。若由腎臟排除,當腎清除率下降時,則會影響藥物的排除率7。
表二 抗毒蕈鹼藥物的藥物動力學和建議劑量7,9
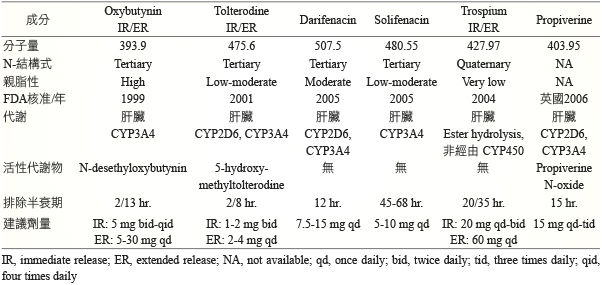
此外,抗毒蕈鹼藥物對毒蕈鹼受體選擇專一性與不良反應事件的評估中,雖然針對M3專一性的藥物,理論上可能排除部分抗毒蕈鹼對身體的副作用,但M3接受體除了存在下泌尿道組織外,往往也同時存在身體其他部位,若阻斷膀胱以外的毒蕈鹼受體,可能造成令人困擾的副作用,包括認知意識障礙、視覺模糊、口乾和便秘等6。因此治療膀胱過動症的理想抗毒蕈鹼藥物無法單由接受體選擇性來達成。如何達到只有在膀胱作用的器官及受體專一選擇性將是極待突破的領域。
2012年 Buser 等人統合分析約40,000位使用抗毒蕈鹼藥物治療膀胱過動症的病人10,評估在不同劑型和劑量對臨床療效與發生不良反應事件之間的相關性中,相對於長效劑型,短效劑型的 oxybutynin 和 propiverine 劑量增加時,雖療效相似,但副作用卻顯著增加。將 trospium 劑量由40 mg 提高至60 mg,療效並未提高。這些結論可提供臨床上使用抗毒蕈鹼藥物治療時,若出現療效不佳或副作用無法耐受時,調整藥物之權衡參考。臨床上使用抗毒蕈鹼藥物除應考量藥物副作用外,對於潛在疾病如窄角型青光眼、胃排空異常或有尿滯留病史或風險的患者,均應非常謹慎小心3。目前未有文獻建議不同抗毒蕈鹼藥物的合併使用,且抗毒蕈鹼藥物併用β3-腎上腺接受體作用劑的療效也因研究文獻有限,而無法證實4。
二、β3-腎上腺接受體作用劑
人類泌尿道上皮存在 β-腎上腺接受體,其包含 β1、β2和 β3三種亞型,但以 β3-受體為主要調節受體6。儲尿過程中,交感神經刺激 β3-腎上腺接受體,可造成膀胱鬆弛和增加膀胱張力8,使得膀胱容量增加,但不影響排尿參數如排尿壓力或殘留量6。2015年 AUA/SUFU 治療指引修訂,新增 β3-腎上腺接受體作用劑與抗毒蕈鹼藥物同為膀胱過動症的第二線治療4。
此類藥物有 mirabegron、solabegron 和 ritobegron 等9。Mirabegron 是第一個被核准治療膀胱過動症的 β3-腎上腺接受體作用劑,在日本、FDA 和歐盟分別於2011年、2012年和2013年核准使用9,11。Mirabegron 屬於高親脂性,口服後迅速吸收,其達到最高血中濃度 (Tmax) 約為3.5小時,多數經由肝臟 CYP3A4和 CYP2D6代謝,20%由尿液原型排出,排除半衰期約40小時,達穩定血中濃度約需7天,分布體積1670L,約70%與白蛋白和 α-1 acid glycoprotein 結合12。建議起始劑量為每天一次,每次25 mg,之後可視臨床需要增加至每日50 mg9。此藥物無劑量遞增作用,每日50 mg 與100 mg 臨床效果相似4,13,可顯著減少24小時的排尿和尿失禁次數13。較無抗毒蕈鹼藥物造成病人無法耐受如口乾和便秘等副作用4,13。
β3-腎上腺接受體廣泛分佈於全身,包括脂肪組織、心臟和血管系統和膀胱12,因此 mirabegron 最常見的副作用是高血壓和頭痛11,12。當病人有嚴重未控制的高血壓時 (收縮壓 ≥ 180 mmHg 和/或舒張壓 ≥ 110m),則不建議使用此類藥物6。
三、 肉毒桿菌毒素
(Botulinum toxin, BTX-A)
BTX-A 是由肉毒桿菌 (Clostridium botulinum) 所產生的毒素,有7種血清型 (botulinum toxin A-G),其中A型 (botulinum toxin A) 最常被使用,作用時間最長。FDA 於2011年核准 BTX-A 用於神經性膀胱功能異常 (neurogenic bladder),接著在2013年核准用於原發性膀胱過動症 (idiopathic overactive bladder) 的治療4,11。
BTX-A 主要作用在突觸相關蛋白25 (SNAP-25) 及突觸小泡蛋白2 (synaptic vesicle protein 2, SV2) 這兩個蛋白質接受體,可阻止體神經末梢及自主節前神經末梢富含神經傳導物質的突觸小泡和細胞膜融合,進而阻斷乙醯膽鹼在神經肌肉接頭處的釋放,產生去神經化作用,導致可逆性肌肉鬆弛麻痺14。膀胱內注射 BTX-A,將誘發逼尿肌舒張,增加其存儲容量和減少尿失禁9。常見的不良反應有排尿困難 (12.2%)、尿滯留 (5.4%) 和泌尿道感染 (5.0%)6。OnabotulinumtoxinA 每次劑量100 U 可獲得治療最佳效益和安全性,若增加劑量並不會增加症狀改善的效果,但副作用會顯著增加。療效維持約為12週至1.5年,視需要重覆給藥。配製方法為100 U 以不含保存劑的無菌生理食鹽水10 mL 稀釋,調配後應儲存於2-8℃冰箱。膀胱內注射部位約15至20處。開始注射後約3-4天,急尿、頻尿和尿失禁的症狀顯著減輕,夜尿改善較慢,約治療第一週後改善。以 BTX-A 治療膀胱過動症短期和中期的研究雖然顯示安全和有效,但仍需更多長期的研究觀察14。BTX-A 合併抗毒蕈鹼藥物或 β3-腎上腺素接受體作用劑使用,療效是否增加尚未確認,反而增加 onabotulinumtoxinA潛在的副作用,因此不建議合併使用11。
四、其他治療藥物
除了第二線療法抗毒蕈鹼藥物或 β3-腎上腺素接受體作用劑外,臨床上根據患者的症狀給與輔助治療藥物,如三環抗憂鬱劑、duloxetine 和荷爾蒙等 (表一)9。停經後婦女使用局部雌激素治療亦可改善膀胱過動症的症狀,但是長期療效並不明確,另外如給與全身雌激素療法反而可能加重尿失禁6,9。若伴隨有泌尿道出口阻塞時,抗毒蕈鹼藥物或 β3-腎上腺素接受體作用劑併用 α-腎上腺素受體阻斷劑,可增加尿道括約肌張力,減少膀胱出口的阻力,用來治療伴隨有平滑括約肌或膀胱頸功能失調導致的排尿障礙的患者,幫助提升膀胱排尿功效和提升生活品質9。目前仍有許多治療胱過動症的藥物正在研究中,但仍需更多證據來證實這些藥物的療效。
肆、非藥物治療
臨床上膀胱過動症治療常合併行為療法與藥物來控制症狀及改善生活品質。當行為與藥物治療達4至8週,甚至更長時間,仍無法獲得症狀改善,或因副作用無法耐受導致治療失敗時,應可考慮使用第三線療法。除了使用 BTX-A 外,亦可使用電刺激方法來治療嚴重反覆性膀胱過動症,如非侵入性骶神經刺激 (SNS) 和經皮脛骨神經刺激 (PTNS)。經皮脛骨神經刺激目前研究受試者人數少,時間不長,建議患者使用此治療方式時,須小心評估並讓患者充分瞭解可能發生的副作用或不適4。
伍、結論
膀胱過動症的罹病率隨年齡增加而增加,雖然不會直接危及生命,但可能導致病人生活品質下降。主要治療以緩解症狀的目標,除了提供非侵入性行為治療,早期使用抗毒蕈鹼藥物外,近期有 β3-腎上腺接受體作用劑及膀胱內注射肉毒桿菌毒素核准使用,另外也可考慮電刺激療法等多種選擇。在選擇治療方式時,應考量個體性差異,評估病人的治療順從性、治療效果和副作用的耐受性,並在治療不佳的情況下提供其他替代療法,使患者能得到適合及有效的治療,進而獲得生活品質最大改善。
New Drug Therapy in Advance for Overactive Bladder
Chia-Nan Chen, Hui-Hsiung Lai, Hui-Chuan Lin
Department of Pharmacy, Ditmanson Medical Foundation Chia-Yi Christian Hospital
Abstract
Overactive bladder (OAB) is the presence of urinary urgency, usually accompanied by frequency and nocturia, with or without urgency urinary incontinence, in the absence of a urinary tract infection or other obvious pathology. Antimuscarinics have been up to date, the mainstay of OAB treatment. Recently, AUA/SUFU guideline amendment published in 2015 introduced oral b3-adrenoceptor agonists and intravesical administration of botulinim toxin as second-line and third-line treatment respectively. This article focused on the development status and discussions of new drugs for OAB to provide physician choices of the appropriate selection agents. Further to establish treatment goals that maximize symptom control and patient quality of life while minimizing adverse events and patient burden.
參考資料:
1.Haylen BT, de Ridder D, Freeman RM, et al: An International Urogynecological Association (IUGA)/International Continence Society (ICS) joint report on the terminology for female pelvic floor dysfunction. Neurourol Urodyn. 2010;29(1):4-20.
2. Irwin DE, Kopp ZS, Agatep B, et al: Worldwide prevalence estimates of lower urinary tract symptoms, overactive bladder, urinary incontinence and bladder outlet obstruction. BJU Int. 2011;108(7):1132-8.
3. Gormley EA, Lightner DJ, Burgio KL et al: Diagnosis and treatment of overactive bladder (non-neurogenic) in adults: AUA/SUFU guideline. J Urol. 2012;188(6 Suppl):2455-63.
4. Gormley EA, Lightner DJ, Faraday M, et al: Diagnosis and treatment of overactive bladder (non-neurogenic) in adults: AUA/SUFU guideline amendment. J Urol. 2015;193(5):1572-80.
5. Aballéa S, Maman K, Thokagevistk K, et al: Cost Effectiveness of Mirabegron Compared with Tolterodine Extended Release for the Treatment of Adults with Overactive Bladder in the United Kingdom. Clin Drug Investig. 2015;35(2):83-93.
6. Jayarajan J, Radomski SB: Pharmacotherapy of overactive bladder in adults: a review of efficacy, tolerability, and quality of life. Res Rep Urol. 2013;6:1-16.
7. Abrams P, Andersson KE: Muscarinic receptor antagonists for overactive bladder. BJU Int. 2007;100(5):987-1006.
8. Ouslander JG: Management of overactive bladder. N Engl J Med. 2004;350(8):786-99.
9. Cipullo LM, Cosimato C, Filippelli A, et al: Pharmacological approach to overactive bladder and urge urinary incontinence in women: an overview. Eur J Obstet Gynecol Reprod Biol. 2014;174:27-34.
10. Buser N, Ivic S, Kessler TM, et al: Efficacy and adverse events of antimuscarinics for treating overactive bladder: network meta-analyses. Eur Urol. 2012;62(6):1040-60.
11. Andersson KE: New developments in the management of overactive bladder: focus on mirabegron and onabotulinumtoxinA. Ther Clin Risk Manag. 2013;9:161-70.
12. Bridgeman MB, Friia NJ, Taft C, et al: Mirabegron: β3-adrenergic receptor agonist for the treatment of overactive bladder. Ann Pharmacother. 2013;47(7-8):1029-38.
13. Wu T, Duan X, Cao CX, et al: The role of mirabegron in overactive bladder: a systematic review and meta-analysis. Urol Int. 2014;93(3):326-37.
14. Jambusaria LH, Dmochowski RR: Intradetrusor onabotulinumtoxinA for overactive bladder. Expert Opin Biol Ther. 2014;14(5):721-7.

