摘要
近年來慢性C型肝炎之治療有突破性的發展,從單一傳統干擾素 (interferon) 到長效型干擾素 (peginterferon alfa,PegIFN) 併用雷巴威林 (ribavirin,RBV),又進展為直接作用抗病毒藥品 (direct-acting antiviral agents, DAAs),進而讓評估慢性C型肝炎治療成效指標之持續病毒學反應 (sustained virologic response, SVR) 的比率達到90%以上1。全球感染非第一型慢性C型肝炎病人的比率占所有患者50%以上,但大部分合併 DAAs 的治療僅被核准使用於第一型慢性C型肝炎 (Hepatitis C virus genotype 1,HCV-1)2,所以發展一個可治療泛基因 (pan-genotype) 慢性C型肝炎的 DAAs 是必要的。本文針對合併使用固定劑量 (fixed dose) 的 sofosbuvir (SOF) 與 velpatasvir (VEL) 治療泛基因慢性C型肝炎 (pan-genotype chronic hepatitis C) 病人,做成效探討。
關鍵字:慢性C型肝炎、direct-acting antiviral agents、DAAs、sofosbuvir、velpatasvir
壹、前言
慢性C型肝炎是全球公共衛生的重要議題,若無妥善治療,可能會漸進的轉變成肝硬化甚至肝細胞癌。依據2015年世界衛生組織的統計,全球約有1億3千萬到1億5千萬人感染慢性C型肝炎,每年約有50萬人死於C型肝炎相關之疾病。
C型肝炎病毒依照其基因序列主要可分為六種基因型 (genotype) 及至少六十種亞型 (subtype),全球感染C型肝炎病毒的盛行率約為1.6%,最常見的感染基因型依序為HCV-1 (46%)、HCV-3 (22%)、HCV-2 (13%)、HCV-4 (13%)、HCV-6 (2%)、HCV-5 (1%),其餘3%為混合型及其他基因型。依照流行區域別,HCV-1廣泛分布世界各地,HCV-2主要分布於東亞、南美、東西非,HCV-3主要分布於南亞、東南亞、歐洲及大洋洲,HCV-4主要分布於北非、中非及中東,HCV-5主要分布於南非及莫三鼻克,HCV-6主要分布於東南亞。台灣15歲以上民眾感染C型肝炎病毒的盛行率約為4.4%,其中血清中偵測到C型肝炎病毒 RNA 的盛行率約為3.3%,主要感染的基因型為 HCV-1b (45.5%)、HCV-2 (39.5%),值得注意的是感染混合型及其他基因型的比率達10%3,比起歐、美、亞、澳等世界主要國家偏高。
目前各種基因慢性C型肝炎的治療仍以標準療法 (standard of care,SOC) 為主,即是以 PegIFN 併用 RBV 治療24-48週,但療效卻隨著所感染病毒基因型的不同而有差異。感染 HCV-1的歐美國家病人而言,僅有29-52%病人可達到 SVR,相對於感染 HCV-2與 HCV-3患者,有高達79%-84%可達成此狀態4。隨著對C型肝炎病毒的基因體、蛋白及感染流程研究越來越清晰,已經有針對病毒複製機轉的抑制劑被研發出來,甚至互相搭配以達到更好的療效,如針對第一型C型肝炎病毒 NS3/4A 抑制劑 telaprevir 或 boceprevir,與 PegIFN 以及 RBV 合併的三合一組合,將 SVR 提升到68-75%;而 NS5A 抑制劑 velpatasvir 合併 NS5B 抑制劑 sofosbuvir,對於主要基因型都有超過90%的 SVR5,6。
貳、C型肝炎病毒生活史
C型肝炎病毒屬於黃熱病毒科 (Flaviviradae),肝炎病毒屬 (Hepacivirus),直徑約為55-80奈米,病毒最外層具有套膜 (envelope),由脂雙層及兩種醣蛋白 envelope 1 (E1)、envelope 2 (E2) 組成,包圍著內層的病毒核鞘 (nucleocapsid);它包含病毒核心蛋白 (core protein) 和一段正義單股 (positive-sense single stranded) RNA 基因體 (genome),其基因組含有約9,600個核糖核酸。C型肝炎病毒是經由血液傳播,感染人體後隨著血液循環至肝臟,進入肝細胞前先附著於低密度或極低密度脂蛋白膽固醇 (LDL-C 或 VLDL-C) 形成複合體稱為病毒脂質顆粒 (lipoviroparticles, LVPs),此複合體表面上的 ApoB (apolipoprotein B)、ApoE (apolipoprotein E)、E1、E2蛋白與肝細胞表面受體 glycosaminoglycans (GAGs)、low density lipoprotein receptor (LDL-R)、the human scavenger receptor class B type 1 (SR-B1)、CD81、the tight junction proteins claudin-1(CLDN-1) 與 occludin (OCLN) 進行一連串的交互作用後7,8,胞飲 (endocytosis) 進入肝細胞 (圖一)8。在細胞質酸性環境的協助下,病毒外層套膜產生融合,病毒 RNA 釋出,經過宿主核糖體 (ribosome) 轉譯成約3000個胺基酸的多蛋白前驅物 (polyprotein precursor),再經過蛋白酶切割成10個病毒蛋白,包含3個支撐病毒結構的構造性蛋白質 (structural proteins),名稱為 Core、E1與 E2,以及7個非構造性蛋白質 (nonstructural proteins,NS),名稱為 P7、NS2、NS3、NS4A、NS4B、NS5A 與 NS5B (圖二)8。這些蛋白附著於宿主細胞粗糙內質網 (rough endoplasmic reticulum) 進行病毒各單元的複製或具備酵素功能,在脂滴 (lipid droplets) 的協助下進行病毒顆粒的組裝,最後病毒附著於 VLDL-C 形成 LVPs (lipoviroparticles),如同 VLDL-C 的模式胞吐 (exocytosis) 出肝細胞。
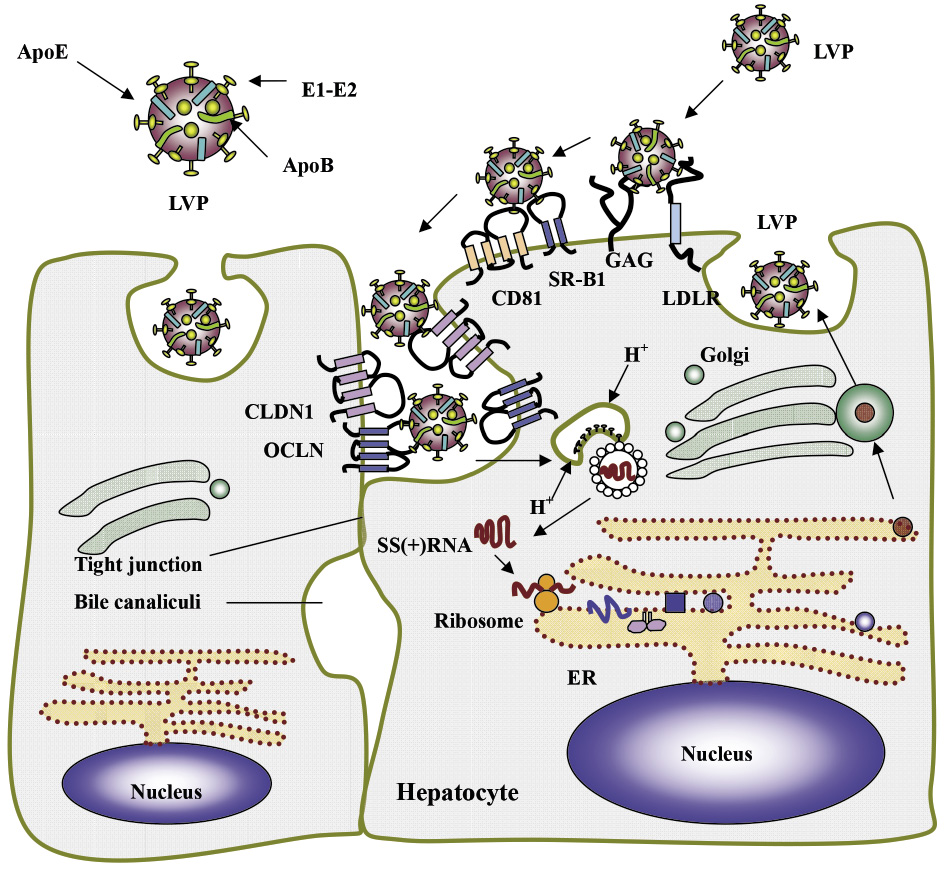
圖一 C型肝炎病毒生活史8
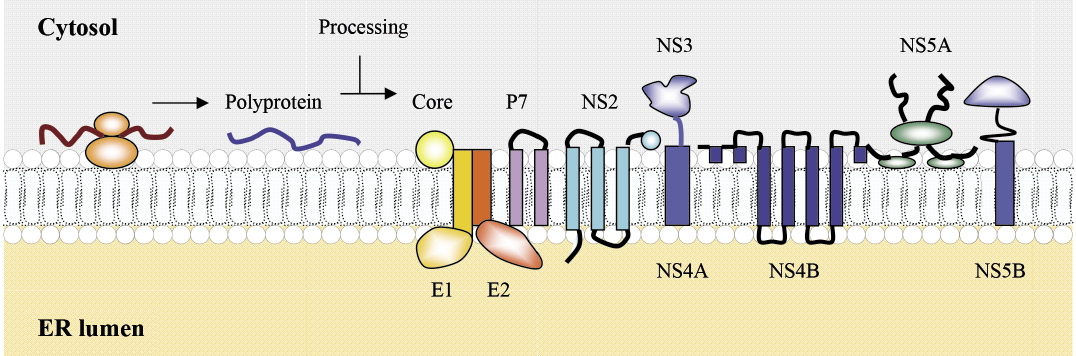
圖二 病毒 RNA 轉譯及病毒蛋白之酵素切割8
參、 Sofosbuvir 與 velpatasvir 的臨床試驗
Sofosbuvir 為一個結構類似於核苷酸的前驅藥物,化學名稱為 2-deoxy-2-fluoro-2-C-methyluridine monophosphate,需在肝細胞內代謝成三磷酸的型態,才有抑制 NS5B 聚合酶的活性,造成病毒的基因組複製終止,經臨床試驗證實具有抗泛基因 HCV 活性9。2013年美國 FDA 核准 sofosbuvir 用於慢性C型肝炎的治療,但不能單獨使用,需合併 RBV 服用,或合併 PegIFN 以及 RBV 來治療第一到第四型 HCV 感染。
Velpatasvir (GS5816) 是個具有 chroman、imidazole、naphthol、 phenylacetate、pyrrolidine 等官能基的 carbamate 化合物,其也具有抗泛基因 HCV 活性,屬於第二代 NS5A 抑制劑,在一個第一期的臨床試驗10,証實了單獨用在C型肝炎治療,於不同劑量範圍的安全性、耐受性及有效性。
學者們利用這種抗泛基因病毒特性,將這兩種藥品合併使用,經第二期臨床試驗11得到優異的療效及良好的耐受性後,於是持續進行第三期臨床試驗。ASTRAL-1~4為四個使用固定劑量的 sofosbuvir 400 mg 與 velpatasvir 100 mg 治療慢性C型肝炎的第三期臨床試驗 (表一)13,分述如下:
表一 ASTRAL-1~4臨床試驗結果摘要13
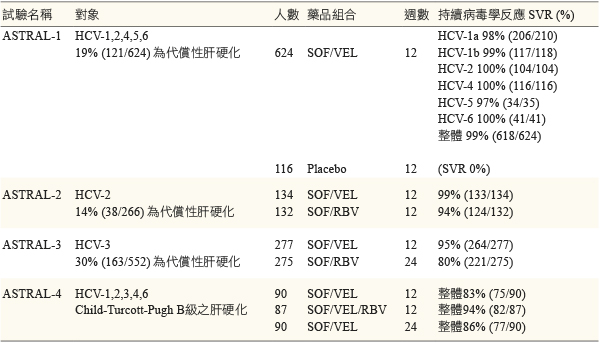
ASTRAL-1為一個跨國、隨機、雙盲、有安慰劑對照組的第三期臨床試驗 (n = 740)5,試驗對象為罹患慢性C型肝炎的成年病人,基因型涵蓋1、2、4、5與6。試驗人數依照5:1 (624:116) 分為實驗組及對照 (安慰劑) 組,實驗組裡19%的人有代償性肝硬化,32%的人曾經接受過其他C型肝炎藥物治療,服藥頻次為每日一次。主要試驗終點為受試驗病人治療達成 SVR 的比率,達到 SVR 的定義為至少接受一次藥物治療的病人,於停止治療後12週,血清中 HCV RNA 濃度低於15 IU/mL。到達試驗終點後,實驗組整體的 SVR 比率為99%(618/624),若依照基因別來看 SVR 比率為 HCV-1a 98%(206/210)、 HCV-1b 99%(117/118)、HCV-2 100%(104/104)、HCV-4 100%(116/116)、HCV-5 97%(34/35) 以及 HCV-6 100%(41/41)。在不良反應方面,實驗組與對照組間無顯著的不同,常見的不良反應為頭痛、疲倦、鼻咽炎與噁心,此外有觀測到實驗組有小於1%的病人血液指數異常,此為對照組沒有的。
ASTRAL-2為一個單國、隨機、開放的第三期臨床試驗 (n = 266)6,試驗對象為感染 HCV-2的成年病人,14%的人有代償性肝硬化,部分的人曾經接受過其他C型肝炎藥物治療。試驗人數依照1:1 (134:132) 分為兩組,第一組服用12週固定劑量 SOF 與 VEL;第二組服用12週 SOF 與 RBV (依體重調整劑量),試驗結果第一組 SVR 比率為99%,第二組 SVR 比率為94%。
ASTRAL-3為一個跨國、隨機、開放的第三期臨床試驗 (n = 552)6,試驗對象為感染 HCV-3的成年病人,30%的人有代償性肝硬化,部分的人曾經接受過其他C型肝炎藥物治療。試驗人數依照1:1 (277:275) 分為兩組,第一組服用12週固定劑量 SOF 與 VEL;第二組服用24週 SOF 與 RBV (依體重調整劑量),主要試驗終點為受試驗病人治療達成 SVR 的比率。試驗結果第一組 SVR 比率為95%,第二組 SVR 比率為80%。
ASTRAL-4為一個單國、隨機、開放的第三期臨床試驗 (n = 267)12,試驗對象為罹患慢性C型肝炎的成年病人,基因型涵蓋1、2、3、4與6,全部受試者都有 Child-Turcott-Pugh (CTP;肝硬化嚴重度分級) B級的代償性不全肝硬化,部分的人曾經接受過其他C型肝炎藥物治療。試驗人數依照1:1:1 (90:87:90) 分為三組,第一組服用12週固定劑量 SOF 與 VEL,第二組服用12週固定劑量 SOF 與 VEL 再加上 RBV (依體重調整劑量),第三組服用24週固定劑量 SOF 與 VEL,主要試驗終點為受試驗病人治療達成 SVR 的比率。試驗結果第一組整體 SVR 比率為83%,第二組整體 SVR 比率為94%,第三組整體 SVR 比率為86%。在不良反應方面,常見的不良反應為頭痛、疲倦、噁心與貧血。
肆、總結
經過學者專家的努力,慢性C型肝炎之處置從反應導引式治療 (response guided therapy,RGT),持續進步到不使用干擾素且固定劑量的 DAAs,可預期的未來會有針對泛基因型方便使用,每天僅服用一次的 DAAs 上市。從上述的臨床試驗數據看來,此兩種 DAAs 組合療效優異、耐受性佳,確定感染 HCV 後不須檢驗 HCV 基因型即可投藥,但關鍵仍在於早期發現、早期治療,若等到肝臟代償不全時,從試驗數據看來,治療的效果變差。對於特殊族群如孕婦、血液透析病人、罹患混合基因型病人等,仍須進一步的臨床試驗來證明有效性及安全性。
The Treatment of Pan-genotype Chronic Hepatitis C
Fang-Yi Cheng1, Chun-Yi Chuang1, Hung-Ying Wang2, Ho-Li Wang3, Chiu-Jen Wu4
Department of Pharmacy, Yuanli Lee’s General Hospital, Lee’s Medical Corporation1
Department of Nursing, Yuanli Lee’s General Hospital, Lee’s Medical Corporation2
Department of Gastroenterology, Yuanli Lee’s General Hospital, Lee’s Medical Corporation3
Department of Pharmacy, Miao-Li General Hospital, Department of Health4
Abstract
The treatment of chronic hepatitis C virus infection has been advancing at breakthrough speeds over the past few years. The use of medication rapidly progressed from traditionally single interferon to combine PegIFN with RBV, and finally changed to DAAs. It led sustained virologic response rate elevating to 90%. Nongenotype 1 infection accounted for over than 50% of infection globally, but almost combination of drugs therapies were approved only for genotype 1 HCV infection. Therefore, there is a need to develop pan-genotypic treating activity for DAAs. This article will discuss the efficacy and safety of fixed dose, combined sofosbuvir and velpatasvir for treatment of pan-genotype chronic hepatitis C virus infection.
參考資料:
1.Ara A. Kardashian and Paul J. Pockros: New directing antiviral therapies for treatment of chronic hepatitis C virus infection. Gastroenterology & Hepatology 2015; 11; 458-66.
2. 吳俊男、林俊哲:慢性C型肝炎治療的新進展。藥學雜誌2015;第31卷第2期:25-31。
3. Erin Gower, Chris Ester, Sarah Blach, et al: Global epidemiology and genotype distribution of the hepatitis C virus infection. Journal of Hepatology 2014; 61: S45-S57.
4. 劉俊人、許景盛、高嘉宏:慢性C型肝炎治療的新進展:從干擾素到直接抗病毒藥物。內科學誌2012;23:383-391。
5. J. J. Feld, I. M. Jacobson, C. Hézode, et al: Sofosbuvir and velpatasvir for HCV genotype 1, 2, 4, 5, and 6 Infection. N Engl J Med 2015; 373: 2599-607.
6. Graham R. Foster, Nezam Afdhal, Stuart K. Roberts, et al: Sofosbuvir and velpatasvir for HCV genotype 2 and 3 Infection. N Engl J Med 2015; 373: 2608-2617.
7. Ralf Bartenschlager, Francois-Loic Cosset, Volker Lohmann:Hepatitis C virus replication cycle. Journal of Hepatology 2010; 53: 583-585.
8. Troels K H Scheel, Charles M Rice: Understanding the hepatitis C virus life cycle paves the way for highly effective therapies. Nat Med 2013; 19(7): 837-849.
9. Catherine Stedman: Sofosbuvir, a NS5B polymerase inhibitor in the treatment of hepatitis C: A review of its clinical potential. Therapeutic Advances in Gastroenterology 2014; Vol. 7(3): 131-140.
10. E. Lawitz, B. Freilich, J. Link, et. al: A phase 1 randomized, dose-ranging study of GS-5816, a once-daily NS5A inhibitor, in patients with genotype 1-4 hepatitis C virus. Journal of viral hepatitis 2015; 22: 1011-1019.
11. Everson GT, Towner WJ, Davis MN, et al: Sofosbuvir with velpatasvir in treatment-naive noncirrhotic patients with genotype 1 to 6 hepatitis C virus infection: a randomized trial. Ann Intern Med. 2015; 163(11): 818-26.
12. Michael P. Curry, Jacqueline G. O' Leary, Natalie Bzowej, et al: Sofosbuvir and velpatasvir for HCV in patients with decompensated cirrhosis. N Engl J Med 2015; 373: 2618-2628.
13. 劉振驊:C型肝炎治療的臨床實務。臺大醫學院101講堂,2016年1月22日演講講義。

