摘要
帕金森氏病 (Parkinson's disease,PD),是與年齡相關的神經退化性疾病,常好發在高齡族群。造成 PD 的原因有可能是疾病、環境毒素、藥物、基因遺傳,導致黑質體分泌多巴胺的神經元減少或消失,而引起運動失調。依照 Modified Hoehn-Yahr 分級,PD 主要分為五期。此疾病通常以國際通用評量表 Unified Parkinson's Disease Rating Scale 來評估嚴重度。藥物治療有七大類,以左旋多巴胺為主要核心治療藥物,但因病情而需要長期服藥,長期服藥後可能出現異動症。由於藥物不能防止腦部退化,所以儘量以能控制病情低劑量的左旋多巴胺製劑,多巴胺促動劑,抗乙醯膽鹼藥物,隨病情藥物劑量也會越用越高。早期的外科治療有灼燒手術、伽瑪刀放射手術,近來的腦深層電刺激可改善 PD 的運動症狀,也逐步納入健保給付,但也無法防止腦部退化。目前研發的幹細胞移植及基因治療等都是頗具希望的創新技術。
關鍵字: 帕金森氏病、左旋多巴胺、異動症、Parkinson's disease、Levodopa、dyskinesia
壹、前言
帕金森氏病 (Parkinson's disease),簡稱 PD,是一種中腦逐漸退化的疾病,會導致運動功能障礙。此疾病通常以國際通用評量表 (Unified Parkinson's Disease Rating Scale,簡稱 UPDRS) 來評估嚴重度1,評估項目分為四大類,包括:一、心智行為情緒,二、日常生活活動,三、動作檢查,四、治療併發症。分數越高,病情越嚴重。
在美國年齡超過50歲的人,有約150萬的人口患有此病症,好發年齡在50歲到79歲。在所有年齡層年齡中發生比率為萬分之一到二,而在70歲到80歲的發生比率是千分之一,年齡超過85歲的人有一半會出現 PD 的症狀。由此可見,年齡是PD的危險因子之一2。
貳、病因區分
一、病態生理學
原發性和次發性 PD 共同的病理特徵是紋狀體多巴胺的缺乏。原發性 PD 的原因不明或源自遺傳或基因突變,產生不正常蛋白累積在黑質體 (substantia nigra) 的神經細胞而形成路易小體,繼而造成神經細胞損失或死亡。黑質體含多巴胺神經元,生產、分泌多巴胺至大腦基底核 (basal ganglia) 和其它部位。基底核調控各種正常和不正常的運動訊息。因此,黑質體神經細胞之消失會引起多巴胺分泌的降低而影響基底核不正常調控。次發性 PD 的原因可能包括疾病,毒素,藥品等因素 (表一),使黑質紋狀體通路受損減弱,黑質體神經細胞減少或流失。在次發性 PD,路易小體並不存在。另一類非典型 PD 如:多發性系統退化症、進行性上眼神經核麻痺症等對左旋多巴胺類藥物反應不明顯。
表一 引起 PD 的次發性因素

二、藥物和毒物引發帕金森氏病
廣泛使用典型抗精神病藥物如:Haloperidol、 Chlorpromazine,副作用包括:內心的緊張、折磨或像是受到化學酷刑的感覺;在抗多巴胺的副作用,包括:不寧腿綜合徵、靜坐不能、遲發性運動障礙,這些錐體外症候群可能被誤診為新的 PD 症狀或 PD 病情的惡化,造成病人開始或加重使用抗 PD 的藥物。可中止典型抗精神病藥物,觀察症狀是否改善。考慮使用非典型抗精神病藥物。Metoclopramide 胃腸驅動劑,屬於 Central dopamine blockade,會有肌肉僵硬、遲發性運動障礙的錐體外症候群的副作用。依所需可選用 peripheral dopamine blocking agent 如:Domperidone 或選擇性 serotonin 5-HT4的胃腸道驅動劑 Mosapride。MPTP 是 Meperidine 相似物,有藥癮者會造成粒腺體不全而產生類 PD。接觸一氧化碳、錳,也會造成呼吸困難和認知偏差。
三、基因遺傳
引起 PD 的原因中約有5-10%與基因有關。被發現與 PD 家族有關的基因,包括顯性遺傳致病基因 α-synuclein,以及隱性遺傳致病基因 Parkin。leucine-rich repeat kinase 2 (LRRK2) 是北美和歐洲 PD 病人最常見的致病基因,這些基因在特定核苷酸發生多形性或突變。在北非阿拉伯人和高加索人 PD 患者,發現 LRRK2的變種基因 G2019S,在亞洲人則是 G2385R 和 R1628P 等3。
參、臨床表現
PD 是緩慢漸進式的,早期症狀很難和正常老化區分。大部份病人的初期表現包括: 休息時,手部出現螺旋式震顫、搓藥丸狀顫抖,在疲勞或緊張時可能更嚴重,當有意圖地移動手時,這種震顫會減少,在睡覺中則完全消失。主要症狀包括:逐步的動作緩慢,僵直,震顫,步態不穩。PD 依 Modified Hoehn-Yahr 分級 (表二)4。
表二 Modified Hoehn-Yahr 分級

隨著病情嚴重,病人日常生活能力逐漸減退,需要他人扶持,終至完全需人照顧的失能狀態,最後可能因呼吸道、泌尿道、褥瘡之感染而死亡。
肆、藥物治療
一、藥物作用及副作用
目前有七大類藥物,用來治療 PD。其作用機轉及副作用 (表三)5。
表三 抗 PD 的藥物分類及作用機轉及副作用
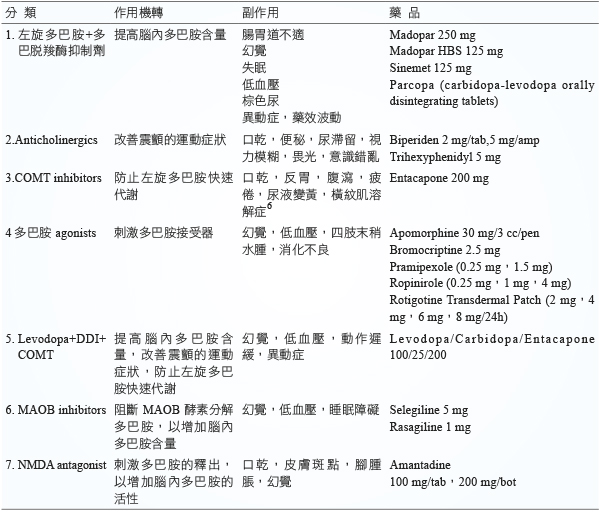
(一)第1類
左旋多巴胺/多巴脫羧酶抑制劑。左旋多巴胺是多巴胺的前驅物,可補充腦內不足的多巴胺,是治療 PD 最主要的藥物。但容易在周邊即代謝成多巴胺。為了減少左旋多巴胺在中樞神經系統以外代謝成多巴胺,加上多巴脫羧酶抑制劑 Carbidopa,Benserazide 可減少左旋多巴胺用量。左旋多巴胺和多巴脫羧酶抑制劑 Benserazide 以4:1的比例複方如:Madopar,Madopar HBS (Hydrodynamically Balanced System)。Madopar HBS 為持續釋放錠,需要整粒吞服,以保持其持續釋放性,穩定左旋多巴胺血中濃度。左旋多巴胺和多巴脫羧酶抑制劑 Carbidopa 以4:1比例的複方如:Sinemet,另外 Parcopa 口溶錠有100/10,100/25,250/25三種組合。大量的維生素B6 (Pyridoxine) 會增加左旋多巴胺 (Levodopa) 在周邊轉變成多巴胺,而影響左旋多巴胺進入中樞神經的濃度。服用左旋多巴胺與多巴脫羧酶抑制劑的複方,則不需擔心受維生素 B6的影響。
(二)第2類
抗乙醯膽鹼藥物 (anticholinergics),可改善 PD 震顫的運動症狀,這些藥物會造成口乾、便秘、鎮靜、意識混淆、尿滯留、視力模糊。
(三)第3類
COMT (Catechol-o-methyltransferase inhibitor),包括 Entacapone、Tolcapone,是阻斷左旋多巴胺向3-O-methyldopa 代謝途徑,是防止左旋多巴胺快速代謝的抗 PD 藥物之一。因為會加強左旋多巴胺之作用,因此開始服用時須調整左旋多巴胺的劑量。會與鐵形成螯合物,與含鐵製劑併用應間隔2-3小時。
(四)第4類
多巴胺促動劑 (Dopamine agonist),包含 D1和 D2雙重促動劑,如:Apomorphine (後期產生藥效波動時使用),Bromocriptine。單獨作用在 D2受體,如:Pramipexole,Ropinirole。Rotigotine (Neupro) 貼片,Neupro 貼片含有一種 sodium metabisulfate 的亞硫酸鹽,可能有呼吸或吞嚥困難,對亞硫酸鹽過敏者,請立即移除及就診。使用多巴胺促動劑又同時併用左旋多巴胺治療時,左旋多巴胺必須減量為宜。
(五)第5類
左旋多巴胺+DDI+COMT 的三合一製劑如 Stalevo,用於左旋多巴胺/多巴脫羧酶抑制劑無法達到穩定治療效果,表現藥效波動現象之 PD 的患者。
(六)第6類
Monoamine oxidase B (MAO-B) 抑制劑,如:Selegiline,Rasagline。可抑制多巴胺在腦內代謝,使多巴胺在突觸間隙的效果持續。病人接受 Selegiline 時,會出現類似安非他命 (Amphetamine) 代謝產物,不要和 Meperidine 併服,因為會過度刺激中神經系統易發生癲癇 (seizure),體溫過高 (hyperthermia) 和低血壓 (hypotension)。
(七)第7類
N-methyl-D-aspartate (NMDA) antagonist 如:Amantadine,除了對抗A型流感病毒,用於治療 PD 方面,有促動多巴胺釋放和抗乙醯膽鹼作用。當 PD 病人因為抖動明顯或高劑量左旋多巴胺所產生的異動症,Amantadine 可加入治療。
二、治療時相關症狀
使用左旋多巴胺治療超過4-5年以上,可能會出現治療效果持續的時間縮短,稱之 wearing-off 現象,另外可能會引起一連串複雜不協調運動的異動症 (dyskinesia),特徵是肌張不全和舞蹈症的特殊混合,治療時間愈久,變得愈嚴重,被認為是與使用左旋多巴胺達到最高劑量有關 (peak-dose dyskinesia, PDD),或隨藥物濃度高低起伏而狀況惡化,出現雙波段型異動症 (diphasic dyskinesia, DD)7,異動症發生時考慮將左旋多巴胺減量或多頻次使用。此外多巴胺 D1促動劑被認為與異動症發生有關。
三、飲食及營養補充品
左旋多巴胺餐前服用血中濃度上升較餐後完全,高蛋白飲食會競爭左旋多巴胺進入腦中而影響吸收。可考慮餐前三十分或餐後一小時。而其它的抗 PD 藥物則不在此限。便秘是使用左旋多巴胺的另一個副作用,PD 的病人通常缺乏運動,所以高纖維質飲食,水果,蔬菜,水份的攝取是不可缺少。補充葉酸和抗氧化劑,如:N-acetylcysteine,acetyl-L-carnitine,alpha-lipoic acid,glutathione,ginkgo biloba 等都可以成功的改善腦部的年齡8。
伍、外科手術、幹細胞移植、基因治療
伽瑪刀放射手術是採用幾何聚焦方式,經過立體定向定位,將一定劑量的伽瑪射線集中射於預定治療的病變位置。
灼燒手術是破壞丘腦下核 (subthalamic
nucleus, STN),蒼白球內核 (globus pallidus internal segment, GPi) 和丘腦的腹中央區 (ventro-intermediate nucleus, VIM) 來治療顫抖,僵硬及動作遲緩等。
腦深層電刺激 (deep brain stimulation, DBS) 是在病人腦內 STN、GPi、VIM、PPN (大腦腳旁腦核) 給電刺激以調節腦部不正常活動達到控制運動症狀9,可減少50-60%左旋多巴胺劑量,手術費昂貴,5-7年要換電池,手術後有輕微的肢體無力,是出血引起的症狀,嚴重的有顱內出血造成腦中風的危險,甚至死亡。手術前十天,病人須停止服用增加出血的藥物,如 Aspirin、NSAIDs 或 Vitamin E 等成份的藥物。雖然如此,對於使用左旋多巴胺控制不好或引起異動症的病人會考慮使用,健保署評估 DBS 雖不能直接治療 PD,但可改善病人過多藥物用量、看病次數、併發症或異動症等,病人多數能重回職場,提升社會生產力及生活品質。在104年1月1日將 DBS 納入健保給付10,104年10月29日修訂,初次接受 DBS 植入手術和更換電池、晶片兩類別給付條件:一、屬原發性 PD;二、發病五年以上,且經醫學中心評估為藥物治療至少一年以上無反應者或因長期服藥後產生不良反應而無法繼續服藥者;三、病人身體其它狀況良好,必須無失智症、無其他嚴重的內外科疾病,以及無藥物無法控制之精神疾病;四、病人的腦部磁振造影 (MRI) 檢查必須正常。須檢附影像診斷資料及病歷等相關資料,並由台灣神經學會及台灣神經外科醫學會推薦成員組成之專家小組特殊專案審查核准後使用。每位病人以給付單側型兩個或雙側型一個深層腦部刺激器為限。並送審各類別應檢附資料。
PD 的基因治療是用攜帶著基因的載體,以立體定位,用外科手術的方式送入腦內。目前主要設計方向:一、基因送到腦部以控制運動線路出口。二、基因讓腦部製造多巴胺。三、基因引導腦細胞健康長成。而攜帶基因載體需具備容易進入腦部、安定性長、不會引起發炎及免疫反應的特性11。
幹細胞移植是用流產胚胎,找出多巴胺細胞,利用立體定位,以細針注射植入到大腦基底核,促使神經細胞再生,每次手術歷程約二至三小時12。
陸、結論
目前對於帕金森氏病的治療,分為二大方面。一、補充左旋多巴胺的藥物治療;二、運動障礙的藥物治療、DBS 手術等。目前在研發或臨床試驗的治療方式包括多巴胺神經修復,防止腦部繼續退化病變以及幹細胞移植和基因治療。這些新技術可以減低藥物劑量和副作用,延長病人有效治療時間以及加強 PD 病人的生活品質。
Treatment of Parkinson’s Disease
Yu-Ying Chang
Department of Pharmacy, National Cheng Kung University Hospital
Abstract
Parkinson's disease (PD) is an age-related neurodegenerative disease, often occurring in the elderly population. The possible causes of PD include the diseases, environmental toxins, drugs, and genetic inheritance that result in the loss or decrease of dopamine neurons in substantia nigra leading to movement disorder. The development of PD can be classified into five major stages based on the modified Hoehn-Yahr scale. The severity of this disease is usually assessed using the Unified Parkinson's Disease Rating Scale (UPDRS). There are seven categories of drug therapy in PD, with levodopa being the core drug. However, as the treatment of PD requires long-term medications, movement disorders or dyskinesia may occur as a result. Since medication cannot halt brain degeneration, the disease is often controlled through use of low-dose levodopa, dopamine agonists, and anti-cholinergics, and the dosage increases over time. Early application of surgical treatments such as burn surgery, gamma knife radiosurgery, and more recently; deep brain stimulation, has been proven useful for improving the motor symptoms of PD, and thus gradually incorporated into health insurance coverage. As these procedures also do not serve to prevent brain degeneration, new technologies such as stem cell transplantation and gene therapy are under development.
參考資料:
1. Stefanie D. Vassar, Yvette M. Bordelon, Ron D. Hays et al: Confirmatory Factor Analysis of the Motor Unified Parkinson's Disease Rating Scale. Parkinson's Disease Volume 2012, Article ID 719167, 10 pages.
2. Mary Ann E. Zagaria, PharmD, MS, CGP. Parkinson's Disease Key Points for the Pharmacist. US Pharm. 2006; 3: 20-30.
3. Aroma Agape Gopalai, Shen-Yang Lim, Jing Yi Chua et al. LRRK2 G2385R and R1628P Mutations Are Associated with an Increased Risk of Parkinson's Disease in the Malaysian Population. BioMed Research International Volume 2014, Article ID 867321, 4 pages.
4. Qutubuddin AA, Pegg PO, Cifu DX, Brown R, McNamee S, Carne W. Validating the Berg Balance Scale for patients with Parkinson's disease: a key to rehabilitation evaluation. Arch Phys Med Rehabil 2005; 86: 789-92.
5. Khor SP, Hsu A. Curr Clin Pharmacol. 2007 Sep; 2(3): 234-43. The pharmacokinetics and pharmacodynamics of levodopa in the treatment of Parkinson's disease.
6. Drug facts and comparisons pocket version 17th page907.
7. Nicola Tambasco, Simone Simoni, Erica Marsili et al: Clinical Aspects and Management of Levodopa-Induced Dyskinesia. Parkinson's Disease Volume2012(2012), Article ID745947, 12 pages.
8. Mattson MP. Cellular and neurochemical aspects of the aging brain. In: Hazzard WR, Blass JP, Halter JB, et al: Principles of Geriatric Medicine and Gerontology. 5th ed. New York: McGraw-Hill, Inc; 2003:1341-1354.
9. 2005.07.01劉康渡醫師主講,腦深層電刺激(Deep Brain Stimulation)
10. 衛生福利部中央健康保險署103年12月2日發佈,治療巴金森氏症的[深層腦部刺激器將自104年1月1日納入健保給付]。
11. 巴金森氏病基因治療,台灣巴金森之友第十五期,2007年9月。
12. 『吾愛吾家』月刊274期,十月號。

