摘要
生育年齡的女性癌症患者隨著醫療的進步,雖然存活的機會增加,但可能因為接受抗癌藥物的治療,而對生殖腺產生毒性,腫瘤科醫師應該在患者接受化學治療前,對於卵巢功能的影響或不孕的可能性做詳細的溝通,並將這些影響降到最低。臨床上,可以在病人接受化學治療前,利用冷凍胚胎或冷凍卵子的方法,增加化療後病人的懷孕機率,但由於從卵巢刺激到取卵,約需要7-14天的時間,因此只適用於不需要立即接受化學治療的病人,例如:乳癌患者。近幾年的研究指出,對於需要立即接受治療或尚未進入青春期的癌症病人,利用冷凍卵巢組織的方式,可以保存患者的生育能力,但目前仍處於實驗階段。另一方面,具有卵巢抑制作用的促性腺釋放激素類似物 (Gonadotropin-releasing hormone analogues,GnRHa) 也是目前臨床醫師治療的可能選擇之一。
關鍵字:促性腺釋放激素、生育保存、化學療法、癌症治療
壹、前言
由於工商社會的發展,女性平均生育年齡逐年攀升,又因為環境的污染、職場壓力和飲食習慣的改變,生育年齡的婦女罹患癌症的數量不斷增加。在台灣,根據國民健康署癌症登記報告,2012年初次診斷為癌症的96,694人當中,約有12%(11,649人) 年齡小於45歲,即為每8位新診斷的癌友,就有1位處於育齡階段。隨著癌症診斷技術及治療水準的不斷進步,癌症患者的生存率及生存時間有了顯著提高,化學療法是目前惡性腫瘤的重要治療方法之一,然而絕大部分化療藥物會引起卵巢功能不同程度的損害,甚至出現卵巢功能早衰 (Premature ovarian failure,POF)、喪失生育功能,這些嚴重影響了患者的生活品質。因此在女性生育年齡中癌症患者的治療,保護卵巢內分泌功能以及生育功能受到越來越多的重視。
貳、 化學治療藥物 (chemotherapeutic agent) 對於卵巢的傷害
一、 化學治療藥物導致卵巢功能損傷的臨床表現
大部分化學治療藥物對卵巢有毒性作用,且對卵巢的損傷是不可逆的。因為卵巢生殖細胞的數目從胎兒時期開始就是固定的,當卵巢內的原始卵泡降至一定數量時就會發生自然絕經 (menopause)。而化療藥物除了破壞有限的卵泡,還會減少卵巢血管數量及產生卵巢間質的纖維化現象,最終出現卵巢儲備功能下降,甚至造成卵巢萎縮,從而引起月經不規則、過早絕經、不孕不育、熱潮紅、情緒改變、盜汗及骨質疏鬆等更年期症狀。幾個臨床研究已經證明,接受全身性化療的絕經前女性,發生與化療相關性閉經達30-76%1。即使患者最終沒有出現閉經,月經正常維持著,但仍面臨不孕不育的風險。
二、化學治療藥物對卵巢損害的機制
化學治療藥物對卵巢的影響,包括造成卵巢衰竭或是不孕,目前化學治療藥物對卵巢損害的機制尚未完全明確,研究顯示可能的機轉:(一)藥物對卵泡細胞的直接毒殺作用,且分裂活性高的細胞對藥物更加敏感。(二)藥物損傷卵巢血管並引起卵巢間質纖維化。(三)藥物可能會導致染色體異常,如基因缺陷、DNA 重組,最終造成胚胎死亡。(四)藥物可能存在潛在的破壞機制,如加速細胞凋亡,這些變化最終都可能導致卵巢老化2。
三、 化學治療藥物對卵巢功能的影響因素
各種化療藥物對卵巢的影響是不同的,取決於藥物的種類、劑量、療程和患者年齡等因素。通常卵巢功能損傷可分為三個類別:(一)對卵巢損傷作用最大的非細胞週期性藥物 (risk > 80%):例如 cyclophosphamide…等烷化劑。大部分的化學治療藥物對分裂中的細胞損害較大,烷化劑同時還可以作用於原始卵泡的卵母細胞和顆粒細胞,損耗原始卵泡或干擾卵泡的成熟。(二)對卵巢損害作用很小的細胞週期特異性藥物:methotrexate (MTX)、5- fluorouracil (5-FU)…等。(三)對卵巢損害作用中等的藥物:adriamycin、bleomycin、vincristine…等3。化療藥物對卵巢的損傷與其藥物的累積劑量成正比,如 cyclophosphamide 已被證明對卵巢損害存在劑量依賴性4。實驗顯示乳癌患者接受1個 CMF 療程,卵巢功能早衰的發生率為10%-33%,6個療程後為33%-81%(cyclophosphamide 累積劑量為8400 mg/m2),12個療程後高達61%-95%(Cyclophosphamide 累積劑量為16800 mg/m2)5。另外隨患者年齡增大,其卵巢功能受化學治療藥物的影響越嚴重3,如果病人年紀輕,即使短暫停經,在化療療程結束後,卵巢功能通常可以逐漸恢復;若病人年紀較大,卵巢功能往往無法完全復原。研究顯示 cyclophosphamide 治療的30歲以下全身性紅斑狼瘡患者,卵巢衰竭發生率低於50%,30-40歲之間的發生率約60%6。化學治療對於女性永久性停經風險評估 (表一)。
表一 化學治療對於女性永久性停經風險評估3

參、生育保存技術
抗癌藥物對生殖系統的毒性可能導致罹癌婦女永久失去生育能力,臨床上可以在病人接受癌症治療前,利用冷凍胚胎或冷凍卵子的方法,又或者促性腺釋放激素類似物 (gonadotropin-releasing hormone analogues;GnRHa) 的抑制療法,增加化療後病人的懷孕機率。
目前生育保存技術有四種方式:
一、 胚胎冷凍保存 (Embryo cryopreservation )
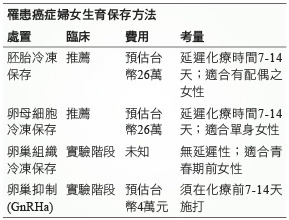
胚胎冷凍保存是目前最純熟的生育保存技術之一,傳統自然週期進行的試管嬰兒 (IVF) 治療,一個週期僅能得到一個胚胎,對於可能因為接受化療而喪失生育功能的女性,顯得緩不濟急。幸好有一些藥物可以對排卵有刺激作用,例如:tamoxifen 或 aromatase inhibitor (letrozole) 合併 FSH 刺激藥物可以在接受癌症化療之前產生多個胚胎,經腹腔鏡取卵並將胚胎冷凍保存,有助於保存病人的生殖能力7。其病人必須符合以下條件:已婚且卵巢功能正常,增加體內雌激素的含量或骨盆的穿刺並不會影響病情,而且癌症治療計劃可以延至取卵後才開始。目前最新的技術三天就可以取卵成功接著進行化療8,一般需延遲7-14天。另外在一些情況下,胚胎冷凍保存是不可行的,例如兒童患者不適用,未婚的年輕女患者則可能無法接受。
二、 卵母細胞冷凍保存
(Cryopreservation of unfertilized oocytes)
1986年曾報導了成熟卵母細胞經冷凍保存後的第一例成功受孕,但是這種方法的成功率很低。原因有:(一)經冷凍再解凍後的卵母細胞存活率降低。(二)減數分裂紡錘體的解聚和重組過程異常。但是現今由於冷凍科技的進步美國生殖醫學學會 (American Society of Reproductive Medicine,ASRM) 把卵母細胞冷凍保存證據等級從實驗性階段提升至建議生育年齡癌症婦女生育保存的推薦選項之一,目前跟胚胎冷凍保存相比,兩者的懷孕結果相似8。卵母細胞冷凍保存一樣需要卵巢刺激腹腔鏡取卵,延遲化學療法大約需至少7-14天。另外卵母細胞冷凍保存特別適合於單身女性作選擇8。
三、 卵巢組織冷凍保存 (Ovarian tissue cryopreservation)
卵巢組織冷凍保存理論上是最理想的生育功能保存方法,優點有:(一)卵巢組織的皮質部應該含有數千顆卵子,可一次保存大量未成熟卵母細胞,其效益比冷凍數十顆卵子更高。(二)女性癌症患者可以在診斷後隨時經腹腔鏡或超音波獲取卵巢皮質組織,不延誤治療,無需刺機促進排卵。(三)唯一適用於青春期前女性的技術。然而目前此方法尚處於實驗階段8。
四、 抑制卵巢功能
(Ovarian suppression)
早期一項長期臨床調查,收集240例小於15歲的罹患何杰金氏淋巴癌接受化療的兒童,其中 83%的男孩罹患無精症,而只有13%的女孩發生卵巢功能早衰,從中發現化療藥物對青春期前卵巢功能的影響較小9。此項研究顯示,臨床上可以為必須接受化學治療的生育年齡女性創造暫時性的青春期前賀爾蒙狀態以保護卵巢功能。利用促性腺釋放激素類似物保護卵巢功能,目前備受爭議,本篇將就此議題提出討論。
肆、GnRHa 對於生育保存的機轉
目前研究 GnRHa 對卵巢保護有幾種潛在的機制,其中包括(一)因為發育階段的卵泡最易受到化療藥物的毒殺作用,GnRHa 能使腦下垂體達到脫敏狀態,抑制 FSH 的分泌,使更多的原始卵泡處在靜止期,減少化療藥物對其損害10。(二)GnRHa 因能減少子宮及卵巢的血流灌注量11,從而減少卵巢接觸化療藥物的機會,最終降低化療藥物對卵巢功能的損害。(三)GnRHa 對卵巢的直接保護作用:GnRHa 可減少細胞凋亡,這個保護作用不依賴於 GnRHa 促使的 LH 及 FSH 分泌不足的內分泌環境12。另外值得注意的是,GnRHa 最初使用的1-2周內會有點火效應 (flare-up effect),可促使原始卵泡發育為成熟卵泡 (即分裂活躍的細胞),而化療藥物對分裂活躍的細胞更具敏感性,增加了對卵巢的損傷。為了避免點火效應,應盡可能在化療前1-2周使用 GnRHa,之後每個月施打一次持續至化療療程結束後的一個月,才能夠發揮 GnRHa 可靠的長時間的抑制促性腺激素的分泌作用。
伍、GnRHa 的實證搜尋結果
卵巢功能的早衰,是癌症婦女接受化學療法常見的毒性副作用,使用促性腺釋放激素類似物來保存癌症婦女的生育功能目前結論是分歧衝突的,缺乏有效的妊娠數據。目前最新2014年在 ASCO 發表的 POEMS study 備受矚目,實驗結果顯示 goserelin 併用化療能有效的防止卵巢功能早衰,減少早期停經風險並能提高生育的可能性13,但有三成的實驗數據遺失降低了實驗的有效性。2015年最新的 systemic review and mety-anaslysis 結論顯示 GnRHa 對於卵巢功能的保護與懷孕發生率沒有統計上的意義14。
陸、生育保存的選擇
目前生育年齡罹患癌症的婦女生育保存最適合的選項是胚胎或卵母細胞的冷凍保存,但是不適合需要立即接受化療的患者,而且做人工生殖的費用昂貴,胚胎卵子的冷凍保存每年還須額外的保存費用。胚胎冷凍保存適合有伴侶的女性,卵母細胞冷凍保存適合單身的女性3。卵巢組織的冷凍保存可以立即手術無須延遲化療時間,但是目前處於實驗階段,適合青春期前女孩。卵巢功能抑制施打 GnRHa 理論上需在化療前7-14天施打,每月施打一次直到化療結束後的一個月,花費較少,但是目前還沒有明確的效果與結論。罹癌婦女生育保存方法整理 (表二)。
表二 罹癌婦女生育保存方法比較整理8
柒、結論
隨著癌症治療的進步,延長癌症患者的壽命,美國臨床腫瘤醫學會 (ASCO) 從2006年開始提倡腫瘤科醫師應該為患者化療後的生育能力保存做詳細的溝通與評估,患者得知自己罹患癌症哪會想到後續生育的問題。罹癌婦女保留生育能力方式的選擇,必須考量到病人的病情、治療方式、年齡及婚姻狀態的不同,而有個別差異,目前的建議方式是胚胎或卵母細胞的冷凍保存較為理想。但這些方法都牽涉到取卵,罹癌病人在徬徨狀態下,往往很難決定考慮這個似乎遙遠的事情,也因此施打 GnRHa 可能是個非常實際的選項,花費又比較便宜。未來如果實驗結果證據更充分,GnRHa 可能會成為這個領域的主流。
New Choice of Fertility Preservation in Female Patients with Cancer
Hung-Wen Cheng1, Chun-Te Ho1, Hao-Yung Chang1, Min-Ling Tsai2
Department of Pharmacy, Chung Shan Medical University Hospital1
Institude of Medicine, Chung Shan Medical University2
Abstract
Young women suffering from cancer that require treatment with chemotherapy are at risk of premature ovarian failure and infertility. The most significant risk factors are age and type of treatment given.Dosage and regimen of chemotherapy are also influence of ovarian function and fertility. Preserving fertility is of high priority to the young patient. This article reviews the effect of chemotherapy on gonadal function and fertility, and offers different fertility preserving methods based on the literature. Embryo cryopreservation and cryopreservation of unfertilized oocytes are the recommended methods of fertility preservation now.Cryopreservation of ovarian tissue is a possible way of preserving fertility in pre-puberty female in the future but now it is investigational. Ovarian suppression that with Gonadotropin-releasing hormone analogues is fair in clinical trial,so we want to confirm the protective effects of GnRH agonists for chemotherapy-induced ovarian damage in this literature.
參考資料:
1. Meirow D, Biederman H, Anderson RA, et al: Toxicity of chemotherapy and radiation on female reproduction.Clin Obstet Gynecol 2010;53(4):727-39.
2. Meirow D, Dor J, Kaufman B, et al: Cortical fibrosis and blood-vessels damage in human ovaries exposed to chemotherapy.Potential mechanisms of ovarian injury. Hum Reprod 2007;22(6):1626-33.
3. Stephanie J. Lee, Leslie R. Schover, Ann H. Partridge,et al: American society of clinical oncology recommendations on fertility preservation in cancer patients.Journal of clinical oncology 2006;24:2917-2931.
4. Fleischer RT, Vollenhoven BJ, Weston GC,:The effects of chemotherapy and radio therapy on fertility in premenopausal women. Obstet Gynecol Surv. 2011;66(4): 248-54.
5. Goldhirsch A, Gelber RD, Castiglione M.:The magnitude of endocrine effects of adjuvant chemotherapy for premenopausal breast cancer patients. The International Breast Cancer Study Group. Ann Oncol. 1990;1(3): 183-8.
6. Manger K, Wildt L, Kalden JR, et al: Prevention of gonadal toxicity and preservation of gonadal function and fertility in young women with systemic lupus erythematosus treated by cyclophosphamide: thePREGO-Study. Autoimmun Rev. 2006;5(4): 269-72.
7. Sonmezer M, Turkcuoglu I, Coskun U, et al:Random-start controlled ovarian hyperstimulation for emergency fertility preservation in letrozole cycles. Fertil Steril 95. 2011;2125.e9-2125.e11.
8. 8.Alison W. Loren, Pamela B. Mangu, Lindsay Nohr Beck,et al: Fertility Preservation for Patients With Cancer:American Society of Clinical Oncology Clinical Practice Guideline Update.Journal of clinical oncology 2013;31:2500-2510.
9. 張英綜:促性腺激素釋放激素類似物與卵巢癌和卵巢功能保護。國際婦科學雜誌2010;37:274-276.
10. Blumenfeld Z.:How to preserve fertility in young women exposed to chemotherapy? The role of GnRH agonist cotreatment in addition to cryopreservation of embrya, oocytes or ovaries.Oncologist.2007;12(9):1044-1054.
11. Kitajima Y,Endo T,Nagasawa K,et al: Hyperstimulation and a gonadotropin-releasing hormone agonist modulate ovarian vascular permeability by altering expression of the tight junction protein claudin-5. Endocrinology 2006;147(2):694-699.
12. Imai A,Sugiyama M,Furui T,et al: Direct protection by a gonadotropin-releasing hormone analog from doxorubicin-induced granulosa cell damage.Gynecol Obstet Invest.2007;63(2):102-106.
13. Moore HC, Unger JM, Phillips KA,et al: Goserelin for ovarian protection during breast cancer adjuvant chemotherapy.N Engl J Med.2015;372(10):923-32.
14. Shen YW, Zhang XM, Lv M,et al: Utility of gonadotropin-releasing hormone agonists for prevention of chemotherapy-induced ovarian damage in premenopausal women with breast cancer: a systematic review and meta-analysis.Onco Targets Ther.2015;13(8)3349-59.

