摘要
幹細胞具有不斷自我更新和在特定生理或實驗條件下誘導成為特殊的細胞功能,而其研究使得再生醫學應運而生,未來將澈底改變許多疾病的治療方法,如血液疾病、心臟疾病、糖尿病、帕金森氏症和神經退化性疾病等,也為捐贈器官不足的器官移植問題帶來一線曙光。隨著科學的研究,它的應用不只是在於細胞療法,也應用於篩選新藥、藥物毒理和出生缺陷等研究。再生醫學是藉由控制細胞分化為基礎加上生醫材料等多專科領域和轉化的研究,從幹細胞的收集儲存和開發,到臨床試驗、移植技術、治療藥物及疾病治療等發展之醫療產業,為許多無法治療的疾病與傷害帶來無限生機。
關鍵字: 幹細胞、再生醫療、誘導性多功能性幹細胞、Stem cells、Regenerative medicine、Induced Pluripotent Stem Cells
壹、 前言
幹細胞為發育初期的原始細胞,能透過細胞分裂自我更新 (self-renewal) 維持幹細胞在一定數量並且能分化 (differentiation) 成為各式各樣的細胞。近年來,發現幹細胞不僅存在於早期的胚胎中,也可在身體中許多組織找到,例如腸道和骨髓。幹細胞經常分裂以維修和更換損壞的組織。在其它器官,如胰腺和心臟中的幹細胞只在特殊條件下分裂。現在把從早期胚胎分離出來的幹細胞稱為胚胎幹細胞 (embryonic stem cells,ESC,ES cells),而從皮膚、骨髓、臍帶血、角膜等成體組織所得到的幹細胞,就稱為成體幹細胞 (adult stem cells)、體幹細胞 (somatic stem cells) 或組織特異性幹細胞 (Tissue-specific stem cells)1。
身體內的大部分組成是已經分化成熟的細胞,例如皮膚、肝臟或是口腔細胞。這些細胞,在沒有特殊的刺激或是突變下,通常被認為細胞的命運已經決定,不會再轉變為其他細胞,這些細胞通稱為「體細胞」,這些分化完成的體細胞,當其受傷較嚴重時,就會邁向細胞死亡。
身體組織受傷後,除引起發炎反應外,受傷的組織會進行修復,有些會恢復為原本的正常組織 (組織再生),有些是由纖維組織所取代。前者組織再生就與體幹細胞有關,體幹細胞會進行所謂的「不對稱分裂」,分裂後的細胞,一個仍是原本的幹細胞,另一個則分化為替補細胞 (先驅細胞,Progenitor cell,再形成成熟細胞)。其目的為保持組織裡幹細胞維持一定的數量。人體機能的老化,也與組織幹細胞數量的減少和消失有關。
貳、 幹細胞種類2
幹細胞具備之分化能力各有所不同,依其分化潛能可分為:
一、全能性幹細胞 (Totipotent)
這類幹細胞具有分化成所有可能的細胞類型的能力,可發展成獨立的個體,例如受精卵、受精卵分裂形成八個細胞時之任一細胞皆是全能幹細胞。
二、多功能性幹細胞 (Pluripotent)
具有分化成幾乎身體內所有類型的細胞的能力,但無法發育成一個完整個體。
三、多潛能性幹細胞 (Multipotent)
此類幹細胞其具有分化成密切相關的組織的細胞,例如,肝臟造血 (成人) 幹細胞只可變成紅血球、白血球或血小板。
四、專一性幹細胞 (Unipotent)
只能產生一種細胞或兩種密切相關的細胞類型分化,例如成體肌肉幹細胞,只分化形成肌內細胞。
參、胚胎幹細胞
胚胎幹細胞是取自囊胚的內層區域 (內細胞團),具有變成身體各種細胞之潛能,但其無形成胎盤之能力[胎盤是由滋養層 (trophoblast) 形成],因此無法由母體獲得養分而成長為個體,因此胚胎幹細胞並不是全能性的 (totipotent),是屬多功能性的 (pluripotent) 幹細胞,但它具有無限制增殖且不分化的能力[自我更新 (self-renewal)],和具有分化為多重細胞組織型態之能力,提供在細胞治療、藥物開發及基礎研究方面極佳的研究平臺3。
一、來源
目前人類胚胎幹細胞 (hESC) 的建立需先得到機構之人體試驗委員會 (IRB) 同意,然後在不孕症夫婦同意捐贈多餘胚胎後才能進行。取不孕症夫婦同意捐贈多餘胚胎,在培養液中培養到第5至6天,到達囊胚期 (blastocyst) 的階段 (圖一),由囊胚的內細胞團 (inner cell mass) 分離培養而得 (圖二)4。
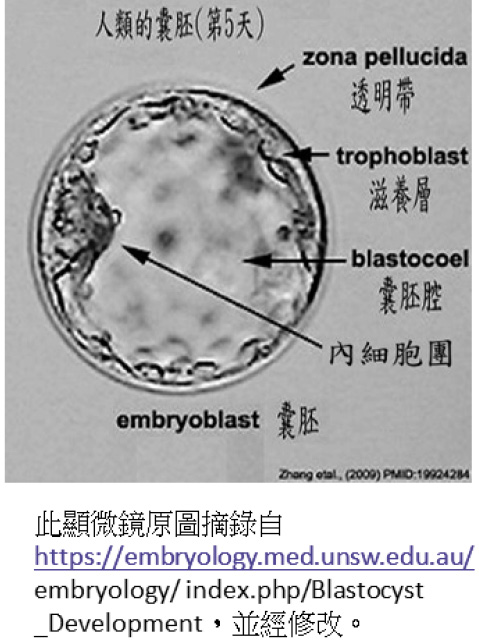
圖一 囊胚期胚胎顯微鏡圖
說明: 受精卵經發育到囊胚 (中空球狀物),其內有一團凸起物 (內細胞團),即為胚胎幹細胞的來源
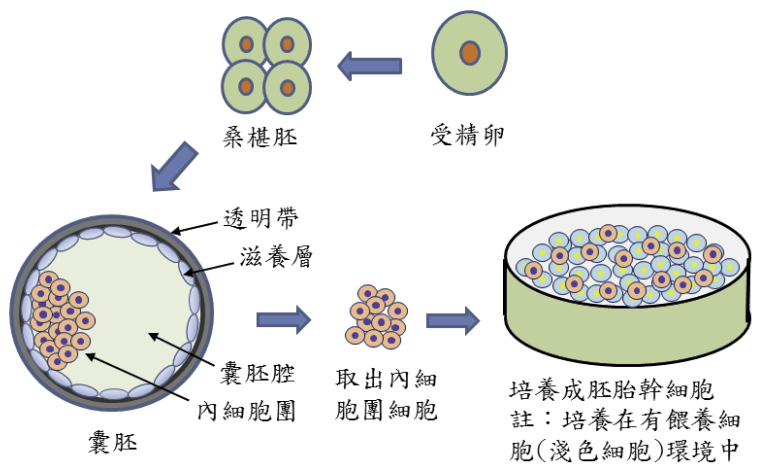
圖二 人類胚胎幹細胞培養卡通圖
說明: 培養體外受精之受精卵,經桑椹胚到囊胚期,取囊胚內細胞團細胞,接種於有餵養細胞的環境中,即可產生胚胎幹細胞的群體
二、胚胎幹細胞的培養問題5
胚胎幹細胞在培養過程中很容易進行細胞分化。目前為維持胚胎幹細胞不進行分化,須讓胚胎幹細胞培養在有餵養細胞 (feeder cell) 的環境中,一般常用的餵養細胞為小鼠胚胎纖維母細胞,此點會引起有動物性污染問題。另外也可以使用人類包皮纖維母細胞 (human foreskin fibroblast, HFF)(ATCC CRL-1635, Hs68) 或其他來源的細胞 (例如 human placental fibroblast) 等作為餵養細胞。目前努力方向:尋找建立無須餵養細胞和無外來非人類物質的培養環境,單獨用培養液來培養胚胎幹細胞,讓其能持續細胞增生且不進行細胞分化,以達到臨床應用之最基本要求。
三、胚胎幹細胞的鑑定6
胚胎幹細胞培養增殖後,需鑑定其是否仍為胚胎幹細胞。常用鑑定方法有細胞形態 (cell morphology) 特徵觀察、細胞表面標誌 (markers) 鑑定、分化潛力鑑定。其中分化潛力鑑定的作法為:把幹細胞注射進入免疫缺乏之老鼠的肌肉、腎臟 (kidney capture) 或者睪丸中,經過數週 (通常8-12週) 注射位置之胚胎幹細胞會形成大小不一定之畸胎瘤,取出畸胎瘤進行組織切片分析。觀察畸胎瘤是否有多種細胞形態,其中應包含有代表內、中、外三胚層之細胞形態。
四、胚胎幹細胞的爭議與應用7
人類胚胎幹細胞技術,涉及胚胎之破壞,因此引起倫理與道德考量上的爭議。為了解決破壞胚胎之爭議,其中一種方法:是把胚胎培養至第三天約8細胞時期,以顯微操作技術取出1-2個胚葉細胞 (blastomere),再與其他胚葉細胞共同培養,使此胚葉細胞順利形成胚胎幹細胞株。如此可建立新的胚胎幹細胞株,而原來移除1-2個胚葉細胞之胚胎,仍能繼續發育至囊胚不受影響。但此方法所得胚胎幹細胞株並非來自於患者本身,用於治療時,會引起患者本身免疫系統之排斥。因此,胚胎幹細胞在醫療臨床應用上仍有很多問題須克服。
肆、成體幹細胞 (Adult stem cell)
自體幹細胞療法 (autologous stem cell therapy) 最大優勢為從病人本身取得幹細胞,可避免異體移植的排斥反應。造血幹細胞 (hematopoietic stem cell, HSC) 是目前較常用的成體幹細胞,可用於許多血液疾病的輔助治療。常用成體幹細胞如下:
一、臍帶血 (cord blood)
屬於「年輕」而較未分化的細胞 (多潛能性幹細胞,multipotent),可發展成不同型態的細胞或組織,用於取代骨髓治療可取代骨髓,治療血液惡性腫瘤、免疫及代謝方面的疾病,以幫助正常血球生長。
二、骨髓幹細胞
骨髓是人體內成體幹細胞最多的地方,屬於多潛能性幹細胞 (multipotent),可分為:(一)造血幹細胞,可分化為任一種血球細胞,包括紅血球、白血球等;(二)間質幹細胞 (Mesenchymal stem cell, MSC),相對於其他幹細胞,在體外較易培養和增生,可分化為造骨細胞 (osteoblasts)、軟骨細胞 (chondrocytes)、脂肪細胞 (adipocytes)、肌細胞 (myocte)、神經細胞 (neuron) 和血管平滑肌細胞 (vascular smooth muscle cell) 等細胞。
三、周邊血液幹細胞 (peripheral blood mononuclear cells)
藉由施打白血球生長激素 (G-CSF),將骨髓內之造血幹細胞驅動至人體週邊血液中,經血液分離機收集取得。由於與骨髓幹細胞極為相近,逐漸取代需全身麻醉經腸骨骨髓抽取的方式。
四、脂肪幹細胞
皮下脂肪組織中含豐富的間質幹細胞,由於組織取得容易,提供組織與器官再生與修復很大的希望。
伍、 人工全能性幹細胞—利用體細胞核轉移技術
體細胞核轉移 (somatic cell nuclear transfer, SCNT) 技術,將體細胞內之細胞核注入至捐贈者之去除核的卵子中,來形成全能性幹細胞。最先發展這項技術者:英國科學家約翰.戈登 (John Gurdon)。
英國牛津大學教授 約翰‧戈登 (John Gurdon) 在1962年,將雙親皆有白化症之蝌蚪,取出其小腸壁上的細胞 (體細胞),將細胞核轉移到不帶有白化症基因的已去核青蛙卵子中,結果部份有發展成為有白化症的蝌蚪。證明細胞核帶有發育成青蛙所需要的完整資訊8。
綿羊桃莉 (Dolly,1996.07.05-2003.02.14) 是第一個用細胞核移植技術將體細胞成功培育出新個體的哺乳動物。桃莉有三個母親:一個 (A) 提供細胞核,一個 (B) 提供卵細胞,一個 (C) 代孕羊母。其處理過程簡約如下:從懷孕母羊 (A) 取出乳房細胞 (屬體細胞)。從另一隻羊 (B) 取出未受精的卵細胞,將卵的細胞核去除。然後將去核卵細胞與前面乳房細胞以電刺激進行細胞融合,組成有外來細胞核的卵細胞 (變成類似受精卵),在試管中培養,形成胚胎。然後再將其植入代理孕母 (C) 的子宮內,最後長成新羊 (桃莉)。桃莉羊後來與另一隻威爾斯山羊交配,先後產下六個羔羊後代。
桃莉羊及其他複製動物仍有一些問題,就是其壽命較短,推測可能是在核轉移的過程中,對於端粒造成了傷害。另外早衰老問題,其原因爭論很多,其中一派人說法,認為複製動物的壽命應從母體年齡算起,而桃莉的細胞內端粒被發現也比較短9。另外在體細胞核轉移 (SCNT) 技術中,A細胞之細胞核與B去除細胞核之卵子融合再一起變成新的幹細胞,一般都會認為新的幹細胞遺傳物質應與A者細胞一樣,但細胞的遺傳物質並非僅存於細胞核內,粒線體內尚有些 DNA (mtDNA,mitochondrial DNA) 存在。因為粒線體是存在於細胞質內,而細胞質就是由卵子所提供,是母系遺傳。因此 SCNT 技術所得的新的幹細胞,仍與原提供細胞核轉移之細胞有些不同。
體細胞核轉移技術會讓人抱著希望,因其可幫助解決不孕症夫婦、同性戀之撫育小孩問題,但也會怕製造出複製人,使整個社會倫理、價值觀念及社會秩序產生很大的衝擊。
陸、 誘導性多功能性幹細胞 (Induced Pluripotent Stem Cells, iPS)
此技術為日本京都大學教授山中伸彌 (Shinya Yamanaka) 在2006年利用四種轉錄因子 (Oct3/4、Sox2、Klf4和 c-myc) 轉錄因子植入皮膚細胞,將皮膚細胞 (為成熟體細胞) 重新編程 (reprogramming) 成為幹細胞 (具備胚胎幹細胞功能),逆轉細胞生長時鐘。山中伸彌因此項研究結果與約翰‧戈登 (John Gurdon) 的體細胞核轉移 (somatic cell nuclear transfer, SCNT) 技術共同獲得2012諾貝爾獎10,11。
用病人自己的體細胞,重設程式逆轉細胞分化程序,變回個人化的幹細胞型態,再使其分化成為肌肉、神經與骨骼等細胞,幾乎能做到所有胚胎幹細胞能做的事,包括細胞療法、器官移植、新藥開發等應用,是屬多功能性的 (pluripotency) 幹細胞。iPS 技術的優點,在於取自病人自己的細胞,重新植回體內時,較無免疫排斥問題,也避開了破壞胚胎的道德爭議。另外 iPS 細胞也提供了研究細胞分化很好的材料。然此技術目前的疑慮,在於 c-myc 為一致癌基因,怕應用此技術,產生癌細胞,因此有科學家研究,嘗試直接只用化合物(非植入基因)來誘導出 iPS 細胞,此類用化合物誘導出幹細胞,稱之為 CiPS (stem cells created using chemical alone)12。
過去醫學的觀念認為,細胞分化到體細胞就無法再變成幹細胞,但英國科學家戈登 (John Gurdon) 利用體細胞核轉移技術發現,將青蛙小腸壁上的體細胞的細胞核移植到已除去細胞核的卵子中,也能夠發育成正常的蝌蚪。其後其他再生醫學方面的新進展也都與卵細胞有關,此代表在卵細胞內含有發揮幹細胞功能的重要物質 (細胞分化的調控因子)。問題是,難道一定要有卵細胞的參與,才能讓細胞變成幹細胞嗎?這個問題直到 2006 年,山中伸彌教授將細胞誘導成幹細胞,免去卵細胞的參與,此舉振奮了相關的科學界。因為此方法讓將來客製化專屬病人自己無免疫排斥性的器官移植或治療成為可能,即用自己的體細胞 (例如口腔黏膜細胞) 誘導成幹細胞,在分化成身體的任何細胞或器官。
這幾年科學家又發現,可用一些小分子物質,增進重新編程的效率,甚至可以取代部分 iPS 細胞製造所需的轉錄因子基因的過程,直接從某類細胞變成另一類細胞,不須經過回到幹細胞過程。這方面的進展越來越多樣化且進展很快。
柒、嵌合體 (Chimera)
Chimera,源自希臘神話,指的是身上有由不同動物器官所組成的混合怪獸。嵌合現像亦在人類出現。例如美國案例13,2002年,某婦女 (L) 要申請社會救濟,申請 DNA 驗證與小孩的親屬關係;結果發現她和她的小孩之間的 DNA 不匹配 (三個兒子,其中兩個不匹配)。其後探討可能原因是這位婦女 (L) 在其母體懷孕初期為異卵雙胞胎,但在後來懷孕過程中,異卵雙胞胎共同形成一個胚胎,導致這位婦女 (L) 體內有兩種不同 DNA 的細胞,一個是自己的 DNA,另一個是異卵姊妹的 DNA,造成婦女 (L) 身體的一些部分是自己細胞形成的,而另一部分細胞來自另一個人 (異卵雙胞胎)。推論該婦女卵巢的細胞也是兩種不同細胞共同組成。因此才會有三個兒子中,有兩個兒子 DNA 與母親 DNA 不匹配情形。
一、人豬嵌合體-人體器官移植的來源
現階段要利用幹細胞製造可供人體使用之器官 (如心臟、胰臟等) 的技術尚未成熟。為解決器官移植所需之捐贈器官來源不足的問題,科學家利用嵌合體觀念,在豬隻體內培育人體器官。例如最近成功育出人豬嵌合體胚胎,利用 CRISPR 基因編輯技術,將豬胚胎細胞控制胰臟發育的 DNA 移除,胚胎在母豬的子宮發育到要展開器官形成階段前,用 iPS 誘導人類病人之體細胞成為 iPS 幹細胞,再將這個幹細胞植入豬胚胎內。由於豬胚胎細胞控制胰臟發育的 DNA 已移除,豬胚胎細胞無法形成胰臟,當豬胚胎需要形成胰臟器官時,就由人類 iPS 細胞遞補來形成胰臟,此胰臟是屬於人類的胰臟,如此就形成了「人豬嵌合體」,豬身卻有人類的胰臟,此胰臟即可當作器官移植的來源,且此胰臟是由病人自己細胞所培養而來,所以應無器官排斥問題14。此方法可類似用於其他器官。此方法引起的爭議:是否會長出豬身人腦問題、如何精準控制 iPS 幹細胞在獸體胚胎內的分化等;此外,動物保護組織也質疑這類實驗違反生命權,沒有生命是為了延續其他生命而誕生的。
捌、結語
目前幹細胞的使用,有安全及道德上的疑慮,限制其研究發展,而 iPS 細胞較無此方面的疑慮。iPS 細胞提供了良好的研發平台。目前很多藥物無法治癒的疾病,透過 iPS 細胞的發展,直接替代衰老或壞掉的組織,根本治癒疾病,意味將來醫療方式會很大改變。這些發展對藥師的影響很大,因治療非只有化學藥物而已,甚至不需要化學藥物治療,將來也會有幹細胞藥物出現。另外,iPS 細胞技術日新月異,例如也已發展出直接把皮膚細胞轉變成腦細胞,繞過細胞需先「誘導式」回到幹細胞在分化到體細胞過程。這些發現,都將會影響未來醫療的模式。
Introduction to Stem Cells and Regenerative Medicine
Introduction to Stem Cells and Regenerative Medicine
An-Cheng Huang1, Su-Jing Chen2, Li-Hsueh Huang2, Yu-Chieh Chen2, Ching-Chan Lin3
Department of Nursing, St. Mary's Junior College of Medicine, Nursing and Management1
Department of Pharmacy2,
Department of Hematology and Oncology, China Medical University Hospital3
Abstract
Stem cells have the ability of constant self-renewal, and can be induced to become a particular cell under specific physiological or experimental conditions. The research of stem cell has facilitated the development of regenerative medicine that is going to completely change the treatment in many diseases in the future, including blood diseases, cardiovascular diseases, diabetes, Parkinson's disease and neurodegenerative diseases. It also brings hope to solve the problem of shortage of organ donation in transplantation. With the progress of scientific research in stem cells, it can be applied not only in cell therapy, but also in the screening of drug development and testing of drug toxicity and genetic problems. Regenerative medicine uses the stem-cell related technology to produce or induce functional tissue or organ that can repair or replace the unhealthy tissues or organs caused by aging, illness, or trauma. Currently, many diseases resulted from damaged organs and tissues still could not be treated with medications. Development of regenerative medicine holds the promise of finding the cure for previously irreparable diseases and injuries.
參考資料:
1. International Society for Stem Cell Research (2015), Stem cell facts . Retrieved from http://www.isscr.org/docs/default-source/isscr-publications/stem-cell-facts-brochure92203E27C59B.pdf?sfvrsn=2
2. National Institutes of Health, U.S. (2016), Stem Cell Basics. Retrieved from https://stemcells.nih.gov/info/basics.htm
3. Roberts RM, Fisher SJ. Trophoblast stem cells. Biol Reprod 2011; 84(3):412-21.
4. 陳信孚、何弘能(2012):第一章人類胚胎幹細胞之建立、於游正博、錢宗良總編輯,幹細胞學(1-16)、台北市:教育部。
5. Landry DW, Zucker HA. Embryonic death and the creation of human embryonic stem cells. J Clin Invest 2004; 114(9):1184-6.
6. 郭紘志、陳淑華、張為芳等(2012)、第二章胚胎幹細胞的鑑定、於游正博、錢宗良總編輯,幹細胞學(17-23)、台北市:教育部。
7. Klimanskaya I. Embryonic stem cells from blastomeres maintaining embryo viability. Semin Reprod Med. 2013; 31(1):49-55.
8. Gurdon, J., Nuclear reprogramming in eggs. Nat Med 2009; 15(10): 1141-4.
9. Shiels, P.G., et al: Analysis of telomere length in Dolly, a sheep derived by nuclear transfer. Cloning, 1999; 1(2): 119-25.
10. The Nobel Prize in Physiology or Medicine 2012. http://www.nobelprize.org/nobel_prizes/medicine/laureates/2012/
11. iPS cells and reprogramming: turn any cell of the body into a stem cell. EuroStemCell, http://www.eurostemcell.org/factsheet/reprogramming-how-turn-any-cell-body-pluripotent-stem-cell
12. Masuda, S., et al: Chemically induced pluripotent stem cells (CiPSCs): a transgene-free approach. J Mol Cell Biol 2013; 5(5): 354-5.
13. Extraordinary People(July 8, 2015), Lydia Kay Fairchild The Twin Inside Me – Chimera. http://mymultiplesclerosis.co.uk/ep/lydia-kay-fairchild-chimera/
14. Fergus Walsh, BBC News: Human transplant organs grown in pigs (6/6/2016) http://www.msn.com/en-us/news/us/human-transplant-organs-grown-in-pigs/ar-BBtTok4

