摘要
骨質疏鬆症 (osteoporosis) 是一種全身性骨骼疾病,臨床表徵為骨量減少、骨結構變差,導致骨質脆弱,骨折危險性增高。而藥物引起之骨質疏鬆症也是影響健康的重要課題之一,有些醫療人員常不清楚藥物可能導致骨質流失及骨折風險,此類藥物包括:glucocorticoids (GCs)、proton pump inhibitors (PPIs)、antiepileptic drugs (AEDs)、medroxyprogesterone acetate (MPA)、aromatase inhibitors (AIs)、gonadotropin-releasing hormone agonists (GnRHs)、selective serotonin receptor inhibitors (SSRIs)、thiazolidinediones (TZDs)、anticoagulants 及 antipsychotics 等,目前已知藥物引起骨質疏鬆之相關文獻有限,本文將回顧常見導致骨質流失之藥物,並探討其致病機轉及預防與治療選擇。
關鍵字: 骨質疏鬆症、藥物引起之骨質疏鬆、osteoporosis、Drug-induced osteoporosis
壹、前言
骨質疏鬆症已是全球重要的疾病之一。依據世界衛生組織 (World Health Organization, WHO) 之定義「成人骨質疏鬆症」指因骨量減少或骨密度降低導致骨骼微細結構破壞之疾病,結果將導致骨骼脆弱及骨折危險性增高1,臨床上將「骨質疏鬆症」分為原發型和續發型。「原發型骨質疏鬆症」可再細分為停經後骨質疏鬆症和老年骨質疏鬆症;「續發型骨質疏鬆症」指由其他疾病引起之骨質流失,如:服用類固醇、甲狀腺疾病、性腺機能低下、類風濕性關節炎、肝腎臟疾病、吸菸、酗酒、骨折、腸道吸收不良等。而藥物引起之骨質疏鬆也會影響成人健康問題,大部分醫療人員並不清楚藥物引起骨質疏鬆的可能性及機轉;許多藥物本身也會影響骨質代謝,如:glucocorticoids、medroxyprogesterone acetate、heparin、warfarin 等藥物都可能造成骨質流失。骨密度 (bone mineral density, BMD) 為診斷骨質疏鬆最常用之指標,以T值 [T值= (骨密度測量值-年輕女性的骨密度平均值) ÷ 標準差] 及Z值 (骨質密度與同齡人的平均骨質密度進行比較) 表示骨質疏鬆的程度;停經前婦女或50歲以下男性之骨質密度,建議採用Z值來做判斷是否為藥物引起之骨質疏鬆。本文將回顧常見藥物引起骨質流失之機轉,並提供替代藥物及治療方法。
貳、骨骼重塑過程 (bone remodeling)
骨骼內包括成骨細胞 (osteoblast) 與破骨細胞 (osteoclast),其分別負責骨細胞新生及清除死亡骨細胞;在正常活動與受力負荷下,成骨與破骨細胞活動反應處於一動態平衡,以維持骨質數量之恆定,當骨質疏鬆症發生時,此一動態平衡被打破,則造成破骨細胞經再吸收作用溶蝕老化或損壞的骨頭,而成骨細胞會造出新的骨質,此過程即為骨質重塑2。
參、可能引起骨質疏鬆之藥物
一、Glucocorticoids (GCs)
GCs 常用於治療各種疾病,包括自體免疫疾病、發炎症狀、皮膚疾患及呼吸道疾病等,使用 GCs 病人約30-50%會發生骨折,即使低劑量 (prednisone 3-10 mg/天) 仍有骨折風險3。GCs 會直接與間接影響骨骼發育,其直接影響骨細胞 (osteocytes)、成骨細胞及破骨細胞,使骨細胞凋亡 (apoptosis),於 BMD 下降前造成早期之骨折風險,也會降低骨細胞前驅物的生成,最終降低骨質的形成,另會延長破骨細胞的生存期,讓骨質再吸收作用過度活動;間接影響則是引起骨質流失,降低鈣的再吸收,抑制生長荷爾蒙及改變性荷爾蒙。
二、Proton pump inhibitors (PPIs)
Calcium carbonate 為不溶性鈣,在酸性環境才能有最佳吸收。許多大型觀察性研究指出 PPIs 可能與骨質疏鬆或引起骨折風險有關4,2010年美國 FDA 發布警訊建議 PPIs 藥品仿單應說明使用 PPIs 可能產生髖部、脊髓或徑向骨折之相關風險。PPIs 增加骨折風險的機轉目前仍未知,推測可能與抑制胃酸分泌,降低腸道鈣吸收,導致增加骨質再吸收有關。許多研究評估長期使用 PPIs 一年以上證實會增加髖部骨折風險20-62%及脊椎骨折40-60%,短期使用 PPI 則與增加骨折風險無關。長期使用一年以上骨折風險增加勝算1.44倍,若使用超過七年則骨折風險增加勝算4.55倍,故骨折風險與藥物使用時間的長短有關5,6,而每個研究 PPIs 的給藥劑量不同,所以暫時無法釐清 PPIs 劑量與骨折風險之相關性,目前得知停藥後,骨折風險則降低。
三、Antiepileptic drugs (AEDs)
AEDs 與降低 BMD 有關,特別是停經後婦女及65歲以上之男性,然而 phenytoin 卻曾發生在年輕病人。許多 AEDs 如:phenobarbital、phenytoin、carbamazepine 會誘導 cytochrome P-450 (c-P450) 酵素的活性,使 vit D 分解成無活性代謝物,進而血中 PTH 上升,導致鈣移動儲存及骨轉換增加,臥床病人長期使用 AEDs 與 BMD 降低及骨折增加有關。Valproic acids 為非 c-P450酵素誘導劑,但仍被指出會加速骨質流失,有導致骨鬆引起骨折之風險3。2005年統合分析發現 AEDs 與增加骨折風險有關,其相對風險比 (Relative Risk,RR) 為2.2,且與藥物的累積劑量及使用期間長短有關7。
四、Medroxyprogesterone acetate (MPA)
低劑量 MPA (5-10 mg/天) 常與 estrogen 合併用來作為停經後荷爾蒙之補充療法,estrogen 對預防骨質流失沒有影響;但高劑量 MPA 用來治療婦科疾病與避孕,則可能增加骨質流失。Dopt MPA (DMPA) 每季以肌肉或皮下注射,以抑制促性腺激素分泌及排卵,因降低 estrogen 生成,造成 BMD 下降2-8%。骨質流失最快是出現在使用藥物的前2年,大部分研究指出 DMPA 引起之骨鬆是可逆的,停藥後即可恢復3。
五、Aromatase inhibitors (AIs)
AIs (如:exemestane、anastrozole、letrozole) 可輔助治療停經後 estrogen receptor (+)之乳癌。Exemestane 之結構屬固醇類 AIs,以不可逆方式與 aromatase 酵素結合,使其喪失活性,減少 estrogen 合成,抑制依賴雌激素生長之腫瘤8。Anastrozole、letrozole 之結構屬非固醇類 AIs,則是以可逆方式與 aromatase 酵素結合,能阻斷97%之 aromatase 酵素活性。AIs 會抑制 cytochrome P-450 (CYP-19) 酵素及阻斷周邊 androgens 轉換成 estrogens,導致骨質流失。
六、 Gonadotropin-releasing hormone agonists (GnRHs)
GnRHs 作用劑 (如:leuprolide、goserelin、triptorelin 等) 會抑制促性腺激素 (gonadotropin) 使性腺機能減退,GnRHs 與腦下垂體 GnRHs 受體結合,向下調節 LH (luteinizing hormone) 及 FSH (follicle-stimulating hormone) 之分泌,使卵巢功能受到抑制,estrogen 生成減少,最後造成骨質流失。用 GnRHs 作用劑治療攝護腺癌可能與抗雄性激素作用有關,使血中 testosterone 濃度下降,導致骨質流失。雄性激素剝奪治療 (androgen-deprivation therapy, ADT) 用來治療轉移性攝護腺癌可有效增加病人存活時間,但使用 ADT 的第一年,病人 BMD 下降2-5%;使用五年後骨折風險會增加20-50%9。
七、 Selective serotonin reuptake inhibitors (SSRIs) 與 serotonin norepinephrine reuptake inhibitors (SNRIs)
SSRIs (如:fluroxetine、sertarline、paroxetine、fluvoxamine、citalopram) 與 SNRIs (如:duloxetine) 皆有研究指出可能造成骨質流失10,成骨與破骨細胞上有 serotonin 受體,經由 endocrine、autocrine、paracrine 等調節骨質的恆定,但因 SSRIs 引起骨折病人之 BMD 並沒有下降,故 SSRIs 可能有其他作用於骨質的機轉目前仍不清楚,而藥物使用劑量與時間長短皆與骨折風險有關。
八、Thiazolidinediones (TZDs)
TZDs 類降血糖藥 (如:rosiglitazone、pioglitazone) 為胰島素之增敏劑,PPARγ (peroxisome proliferator-activated receptor γ) 可控制脂肪、肝臟、肌肉的能量代謝轉換。這些蛋白質也控制骨骼的代謝轉換和細胞分化。TZDs 經與 PPARγ transcription factor 結合而活化其作用。目前認為活化 PPARγ 對骨骼的影響:(一)減少骨生成及增加骨吸收(二)減少成骨細胞量及增加脂肪細胞量,使 RANKL (receptor activator for nuclear factor-k B ligand) 量增加,促進破骨細胞新生 (osteoclastogenesis)11。目前無已證實之策略可降低 TZDs 所引起之骨折風險,建議使用此類前應利用骨折風險評估工具 (Fracture Risk Assessment Tool, FRAX) 或雙能量X光吸光式測定儀 (Dual energy X-ray absorptiometry, DXA) 評估風險。另外,也應避免用於已有骨質疏鬆之病人。
九、Anticoagulants
(一)Heparin
Heparin 造成骨質流失之機轉為降低骨形成及增加骨吸收,長期使用 heparin 會降低 BMD,低分子量 heparin (low molecular weight heparin, LMWH) 比傳統 heparin (unfractionated heparin) 較不會影響骨質流失,但會抑制成骨細胞分化與其功能,導致骨形成降低。許多研究顯示約30%孕婦使用 heparin 治療時會降低 BMD 2.2-3.6%,未懷孕婦女長期使用後導致脊柱骨折發生率約15%3,且常見於開始治療後的6個月內;Heparin 引起之骨質疏鬆具劑量依存性,停藥後幾乎可完全恢復。
(二)Warfarin
口服抗凝血劑 warfarin 會降低 BMD 及增加骨折風險,其作用機轉為降低γ carboxylation 及骨鈣蛋白 (osteocalcin)。因長期使用 heparin 之主要族群為孕婦,因雙磷酸鹽可能導致胎兒骨骼生長缺陷,故無相關研究及建議指引用於預防或治療 heparin 或 warfarin 導致之骨質流失。對於高骨質疏鬆風險病人目前僅能補充鈣及維生素D,而 heparin 則可考慮用 LMWH 或 fondaparinux 作取代3。
十、Antipsychotics
Antipsychotics 引起骨質疏鬆之機轉非常複雜,最常見為高泌乳血症 (hyperprolactinemia),許多研究指出長期使用 antipsychotics 造成知覺失調症病人之 BMD 下降12,典型較非典型 antipsychotics 易引起 prolactin 分泌增加,故建議長期使用 (6個月以上) 典型 antipsychotics 病人,需監測血中 prolactin 濃度13。
肆、藥物引起骨質疏鬆之處理
一、非藥物治療
生活型態的改變相當重要,特別是戒菸,因抽菸會降低血中性荷爾蒙濃度及影響鈣吸收,且可能會損害成骨細胞功能。運動可增加年輕女性的骨峰量 (peak bone mass),改善老年人之肌肉張力、平衡及協調能力;所有健康成人應做中強度負重運動 (moderate intensity weight-bearing exercise),最好再加上每週兩次阻力運動 (resistance exercise)。跌倒與骨折關係密切,故減少跌倒發生率可降低骨折風險,建議檢視生活環境是否有跌倒危險因子,如:光線不明、不安全的浴室與樓梯設備等,降低環境潛在之危險因子以預防跌倒的發生。
二、藥物治療
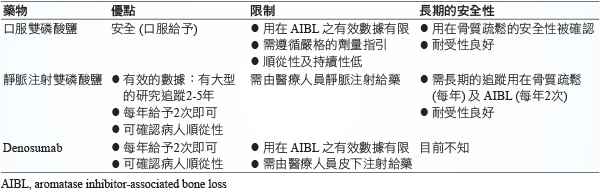
攝取足夠鈣及維生素D是重要的,特別是使用可能導致骨質流失藥物之病人,鈣每日建議攝取量:19-50歲為1000 mg,50歲以上則為1200 mg;維生素D之每日建議攝取量不一,國家骨質疏鬆症基金會 (The National Osteoporosis Foundation) 建議50歲以上每日攝取1000 IU,而臨床醫師則建議每日攝取2000-4000 IU。若使用誘導 c-P450酵素之 AEDs 建議每日攝取維生素 D 2000-4000 IU,以維持25-hydroxyvitamin D 血中濃度超過30 mg/mL,而使用非誘導 c-P450酵素之 AEDs,則建議每日應攝取維生素 D 1000-1200 IU。許多藥物被核准治療骨質疏鬆,但僅有雙磷酸鹽、teriparatide 及 denosumab 研究證實可用於藥物引起之骨質疏鬆,藥物治療仍有其優點、限制及長期安全性等的考量 (表一)。
表一 抗骨吸收藥物 (antiresorptive agents) 之比較14
伍、結論
雖然研究證實低 BMD 與骨折有關,而許多與 BMD 高低無關之危險因子也可能導致骨折,故建議使用可能引起骨質疏鬆之藥物與導致骨折風險前,除監測病人的 BMD,需合併評估病人年齡、身體質量指數 (body mass index, BMI)、之前是否有脆性骨折病史、抽煙、過量酒精攝取等危險因子。若為骨質疏鬆高風險者,則建議可選用替代藥物治療 (表二);若需長期使用可能導致骨質流失之藥物,則應與病人說明可能引起骨質疏鬆之風險,並衛教改變生活型態與檢視生活環境可降低骨折風險。
表二 常見之藥物引起骨質疏鬆的處置與建議3,12

Treatment of Drugs Induced Osteoporosis
Tzu-Rong Peng, Ta-Wei Wu, Ping-Yu Wang
Department of Pharmacy, Taipei Tzu Chi Hospital
Abstract
Osteoporosis is a systemic skeletal disease characterized by reduced bone mass, deterioration of bone structure, resulting in fractures increased risk of disease. Drug-induced osteoporosis is a significant health problem and many physicians are unaware that many commonly prescribed medications contribute to significant bone loss and fractures. Many commonly prescribed drugs are known to cause bone loss, included glucocorticoids, proton pump inhibitors, selective serotonin receptor inhibitors, thiazolidinediones, anticonvulsants, medroxyprogesterone acetate and aromatase inhibitors. Due to limited literature known drug-induced osteoporosis. This article reviews the common medications associated with bone loss, the pathogenesis, and possible treatment option.
參考資料:
1.Consensus Development Conference: Diagnosis, prophylaxis, and treatment of osteoporosis. Am J Med.1993;94(6):646-50.
2. Martin TJ, Sims NA, Ng KW: egulatory pathways revealing new approaches to the development of anabolic drugs for osteoporosis. Osteoporos Int. 2008;19: 1125-38.
3. Panday K, Gona A, Humphrey MB: Medication-induced osteoporosis: screening and treatment strategies. Ther Adv Musculoskelet Dis. 2014;6:185-202.
4. Targownik LE, Lix LM, Metge CJ, et al: Use of proton pump inhibitors and risk of osteoporosis-related fractures. CMAJ. 2008;179(4):319-26.
5. Roux C, Briot K, Gossec L, et al: Increase in vertebralfracture risk in postmenopausal women using omeprazole. Calcif Tissue Int. 2009;84(1):13-9.
6. Corley D, Kubo A, Zhao W, et al: Proton pump inhibitors and histamine-2 receptor antagonists are associated with hip fractures among at-risk patients. Gastroenterology. 2010;139(1):93-101.
7. Vestergaard P: Epilepsy, osteoporosis and fracture risk–a meta-analysis. Acta Neurol Scand. 2005;112(5):277-86.
8. Gaillard S, Stearns V: Aromatase inhibitor-associated bone and musculoskeletal effects: new evidence defining etiology and strategies for management. Breast Cancer Res. 2011;13(2):205.
9. Shahinian V, Kuo Y, Freeman J, et al: Risk of fracture after androgen deprivation for prostate cancer. N Engl J Med.2005;352(2):154-64.
10. Richards JB, Papaioannou A, Adachi JD, et al: Canadian Multicentre Osteoporosis Study Research Group (2007) Effect of selective serotonin reuptake inhibitors on the risk of fracture. Arch Intern Med. 2007;167(2):188-94.
11. Grey A: Thiazolidinedione-induced skeletal fragility—mechanisms and implications. Diabetes Obes Metab. 2009;11(4):275-84.
12. Wu H, Deng L, Zhao L, et al: Osteoporosis associated with antipsychotic treatment in schizophrenia. Int J Endocrinol. 2013:167138.
13. Susan KB. Drug-induced osteoporosis. In: Pharmacotherapy Self-Assessment Program (PSAP), Book 3. 2th ed. American College of Clinical Pharmacy, 2014.
14. Hadji P, Aapro MS, Body JJ: Management of aromatase inhibitor-associated bone loss in postmenopausalwomen with breast cancer: practical guidance for prevention and treatment. Ann Oncol, 2011; 22(12): 2546-55.

