摘要
目前C型肝炎的治療仍無有效疫苗可以預防,健保給付之主要藥物治療包括長效型干擾素 (pegylated interferon,PegIFN) 與抗病毒藥物 (如 ribavirin,RBV) 兩大類。臨床經驗顯示,合併使用此兩類藥物雖然有不錯的療效,但需持續注射干擾素並每日口服多顆藥物,且副作用讓病人難以忍受,如類流感症狀、疲倦、頭痛、禿髮、貧血和憂鬱等1。近年美國食品及藥物管理局 (Food and Drug Administration,FDA) 陸續核准多種直接作用抗病毒藥物 (direct-acting antiviral,DAA),只需口服給藥,可縮短療程且副作用相對較小,其成效指標持久性病毒反應 (sustained virologic response,SVR) 的比率可達到90%以上,但價格昂貴,在病人經濟能力許可下,可提供新的治療選擇2。
關鍵字: C型肝炎、長效型干擾素 (PegIFN)、直接作用抗病毒藥物、持久性病毒反應、direct-acting antiviral (DAA)、sustained virologic response (SVR)
壹、前言
C型肝炎的感染途徑為血液及體液感染,主要途徑為輸血及注射血液製劑、性接觸、母子之間的垂直傳染等。臺灣C型肝炎感染者約40-70萬人,大部份感染者可能症狀輕微或無症狀,但約有50-80%發展成慢性感染。在慢性C肝帶原的病人,約有20%-50%會發展成肝硬化或肝癌3,4。目前各種基因型C型肝炎的治療,仍以長效型干擾素 (pegylated interferon,PegIFN) 合併 ribavirin (RBV) 治療24-48週為主,但因基因型不同,而造成療效上有所差異5。根據台灣研究指出,罹患C型肝炎患者,僅10萬人接受治療,主要原因為害怕藥物副作用 (37%)、合併其他疾病不適合治療 (17.6%)、不符合健保規定 (17.6%) 及偏鄉地區缺乏治療意識 (17.6%) 等6。近年來,直接作用抗病毒藥物 (direct-acting antiviral,DAA) 的發展日異月新,目前的合併療法甚至不需使用干擾素,全口服治療可以達到90%以上的持久性病毒反應 (sustained virologic response,SVR)2;也就是說病人停止治療24週後,血中仍偵測不到C型肝炎病毒 (HCV RNA),即可表示達 SVR。
貳、致病原與流行病學概況
C型肝炎病毒為 RNA 病毒,直徑大小30 nm~50 nm、具脂質外套,其基因體 (genome) 在宿主細胞體內可轉譯成約3000個胺基酸的多蛋白,再經由宿主與病毒的蛋白酶切割成結構蛋白質 (Core、E1、E2) 與非結構蛋白質 (NS2、NS3、NS4A、NS4B、NS5A、NS5B1)3。
根據世界衛生組織統計,全球約有1.3-1.5億人患有慢性C型肝炎。根據基因體序列的差異,目前C型肝炎病毒主要可分為六種基因型,以基因型1的個案最多,約占全球個案的46.2%,其次是基因型3,約佔30.1%;基因型2、4與6最少,約佔22.8%3,7。在臺灣,一般成人C型肝炎抗體陽性率估計約為2-5%,C型肝炎感染者約40-70萬人,以基因型1b 的感染居多,約占50-70%,其次為基因型2a8。其基因型的分佈會因地理位置而有所差異,對抗病毒藥的感受性也不盡相同,因此了解C型肝炎病毒基因型對於治療上是很重要的。
參、 直接作用抗病毒藥物 (direct-acting antiviral, DAA)
目前上市的口服 DAA 藥物,主要作用機轉是針對非結構蛋白中的絲胺酸蛋白酶 NS3/NS4A 病毒複製、組合相關的 NS5A 以及病毒 RNA 依賴型 RNA 聚合酶 NS5B 作用,抑制幾個非結構蛋白的製造,而讓C肝病毒無法複製 (圖一)9(表一)。
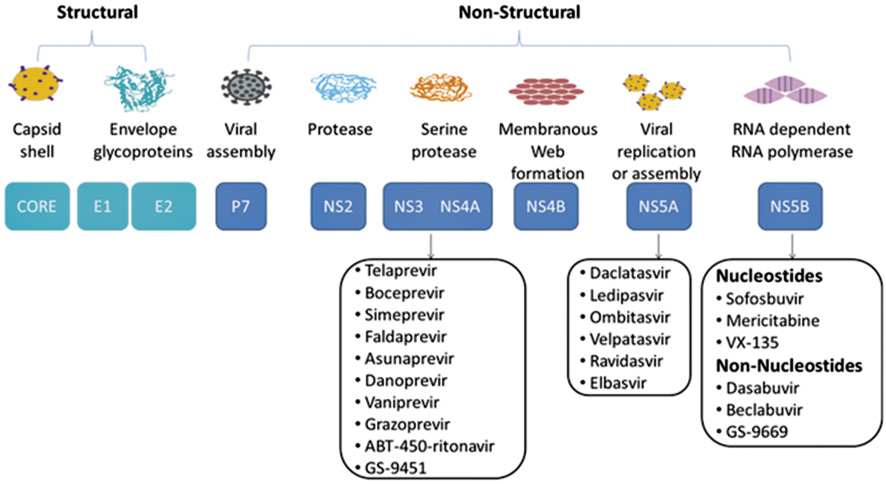
圖一 口服直接作用抗病毒藥物 (direct-Acting Antiviral,DAA) 機轉
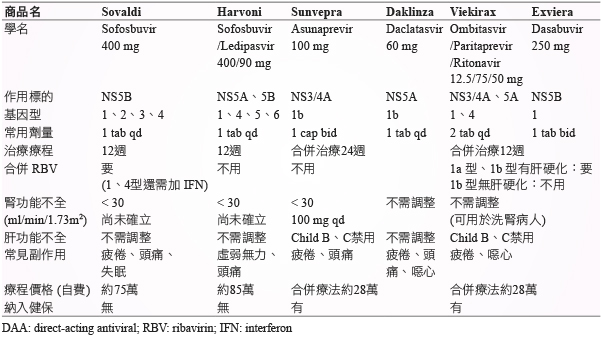
表一 C型肝炎直接作用抗病毒藥物 (DAA) 之比較
一、Sovaldi (sofosbuvir 400 mg)10
為 NS5B 抑制劑,適用於治療成人的慢性C肝基因型1、2、3或4感染症,每天服用一次口服1顆,此藥不可單獨治療,需與其他藥物合併使用。與 PegINF 併用 RBV 12週,可治療基因型1和4;與 RBV 併用12週與24週,分別可治療基因型2和310。Sovaldi 併用 Daklinza 可治療基因型1、2和3,其 SVR 可達89-100%。懷孕分級B。對重度腎功能不全者 (eGFR < 30 mL/min/1.73 m2) 的安全性尚未確立,肝功能不全者不需調整劑量8。
二、 Harvoni (sofosbuvir 400 mg + ledipasvir 90 mg)2,11
為 NS5B/5A 抑制劑,目前研究顯示對C肝基因型1、4、5和6型感染症皆有效,台灣目前核准的適應症為基因型1,每天服用一次口服1顆,不可與同類藥物如 Sovaldi 併用。未曾接受治療且併有或未併有肝硬化者建議療程12週;曾經接受治療且未併有肝硬化者12週,曾經接受治療且有肝硬化者12-24週,其 SVR 可達98-100%。常見副作用有疲倦、頭痛和噁心。與制酸劑併用時,建議將制酸劑與 Harvoni 隔開4小時給藥。懷孕分級B。對於重度腎功能不全者的安全性尚未確立,肝功能不全者不需調整劑量。
三、Sunvepra (asunaprevir 100 mg) 與 Daklinza (daclatasvir 60 mg)12
Sunvepra 為 NS3/4A 抑制劑,每天服用兩次,一次1顆;Daklinza 為 NS5A 抑制劑,每天服用一次口服1顆,兩者併用治療C肝基因型1b,建議療程為24週。此合併療法在治療前,應檢測病毒是否有 NS5A L31或 Y93H 抗藥性病毒突變 (resistance-associated variants,RAV),若有則不建議使用;若無抗藥性病毒突變,SVR 可達90-96%,而如果有抗藥性病毒突變,此藥的 SVR 會大幅降低約40%13。Sunvepra 用於重度腎功能不全者,建議調整劑量至100 mg 每日一次,中重度肝功能不全者 (Child B、C) 禁用;Daklinza 對肝腎功能不全者皆不需調整劑量,兩者皆禁用於懷孕婦女。
四、 Viekirax (paritaprevir 12.5 mg/ritonavir 75 mg/ombitasvir 50 mg) 與 Exviera (dasabuvir 250 mg)
Viekirax 為 NS5A、NS3/4A 抑制劑,每天服用一次口服2顆;Exviera 為 NS5B 抑制劑,每天服用兩次,一次1顆。兩者併用可治療C肝基因型1感染症,建議療程為12週;1a 型伴隨肝硬化之患者需併用 RBV,服用24週2。使用於未經治療的第1型C型肝炎病人,SVR 可達90%以上,如果合併 RBV 治療,更可達97%以上,不過骨髓抑制等副作用也會增加14。Viekirax 合併 Exviera 對於重度腎功能不全者不需調整劑量,可使用於洗腎患者;中重度肝功能不全者 (Child B、C) 禁用。目前用於懷孕女性的資料相當有限,建議避免使用。
肆、結語
口服 DAA 藥品的誕生提供C型肝炎患者治療新的選擇,但價格過於昂貴,暫時無法全部納入健保給付。另外美國食品藥物管理局 (FDA) 近期發佈一則藥品安全性警訊,接受 DAA 治療的C肝患者,如果同時感染B肝,需注意B肝再發的風險15。故開始使用 DAA 前,應先篩檢病人是否感染B肝,並在治療過程與結束後持續檢驗追蹤B肝,並因價格昂貴需與病人充分做好溝通。除此之外,所有 DAA 皆會與細胞色素 P450酵素抑制劑/誘導劑或 P-glycoprotein 受質產生交互作用,因此服用前須做好完整性的評估。
New Treatment Options for Hepatitis C
Wen-Yen Yen1, Hung-Fang Pan1, Ho-Yin Huang2, Hsiu-Mei Chang1, Wei-Hsuan Huang1Department of Pharmacy, Kaohsiung Municipal Ta-Tung Hospital, Kaohsiung Medical University Hospital1Department of Pharmacy, Kaohsiung Medical University Hospital2
Abstract
Nowadays, there is still no vaccine available against hepatitis C virus (HCV). Current treatment of HCV infection provided by National Health Insurance is the combination of pegylated interferon (Peg IFN) and ribavirin (RBV). Clinical experiences show promising result in the combined therapy. However, unbearable side effects occurred such as injection site reactions, flu-like symptoms, fatigue, headache, alopecia, anemia and depression1. In recent years, the US Food and Drug Administration (FDA) has approved a variety of oral direct-acting antiviral (DAA), shortening the treatment course with few side effects. Besides, all oral DAA regimens can achieve at least 90% high sustained virologic response (SVR) but expensive. The DAA treatment might be a new option for patients that can afford2.
參考資料:
1. Masao Omata, Tatsuo Kanda, Ming-Lung Yu, et al: APASL consensus statements and management algorithms for hepatitis C virus infection. Hepatol Int 2012;6:409-35.
2. Chung RT, Davis GL, Jensen DM, et al: Hepatitis C Guidance: AASLD-IDSA Recommendations for Testing, Managing, and Treating Adults Infected With Hepatitis C Virus. Hepatology. 2015; 62(3):932-954.
3. Sleisenger MH, Feldman M, Friedman LS, Brandt LJ. Sleisenger & Fordtran's gastrointestinal and liver disease: pathophysiology, diagnosis, management. 8th ed. Philadelphia: Saunders Co. 2006; 1681-712.
4. 宋瑞樓、陳定信、廖運範。肝炎、肝硬化與肝癌。一版。台北市:橘井文化,2006;233-66.
5. Lai MY. Combined interferon and ribavirin therapy for chronic hepatitis C in Taiwan. Intervirology 2006; 49: 91-5.
6. Yu ML, Yeh ML, Tsai PC, et al: Huge Gap Between Clinical Efficacy and Community Effectiveness in the Treatment of Chronic Hepatitis C. Medicine 2015; 94(13):e690.
7. 衛生福利部疾病管制署:臺灣地區病毒性C型肝炎流行病學。2016。
8. Chan CY, Lee SD, Hwang SJ, Lu RH, Lu CL, Lo KJ. Quantitative branched DNA assay and genotyping for hepatitis C virus RNA in Chinese patients with acute and chronic hepatitis C. J Infect Dis 1995; 171: 443-6.
9. Feeney ER, Chung RT. Antiviral treatment of hepatitis C. BMJ 2014;349:g3308.
10. Catherine Stedman: Sofosbuvir, a NS5B polymerase inhibitor in the treatment of hepatitis C: A review of its clinical potential. Therapeutic Advances in Gastroenterology. 2014; Vol. 7(3): 131-140.
11. FDA, U.S. Food and Drug Administration, Harvoni®仿單
12. Manns M, Pol S, Jacobson IM, et al: All-oral daclatasvir plus asunaprevir for hepatitis C virus genotype 1b: a multinational, phase 3, multicohort study. Lancet 2014; 384:1597-605.
13. Yoshimi S, Imamura M, Murakami E, et al: Long term persistence of NS5A inhibitor-resistant hepatitis C virus in patients who failed daclatasvir and asunaprevir therapy. J Med Virol 2015; 87: 1913-20.
14. Poordad F, Hezode C, Trinh R, et al: ABT-450/r-ombitasvir and dasabuvir with ribavirin for hepatitis C with cirrhosis. N Engl J Med. 2014;370:1973-82.
15. FDA Drug Safety Communication: FDA warns about the risk of hepatitis B reactivating in some patients treated with direct-acting antivirals for hepatitis C.
通訊作者:黃微瑄/通訊地址:高雄市前金區中華三路68號B1樓
服務單位:高雄市立大同醫院藥劑科藥師/聯絡電話:(O) 07-2911101 ext 8372

